
尊敬的大会主持人,尊敬的各位同道们、朋友们,大家好。
我分下列几个方面,就“抑郁症肠道微生物研究进展”给大家做简要的汇报。

我们都知道,微生物组是在全球同步发展的一个重大的科学计划,而我们国家紧随国际,也在开展这项工作。

这张照片是2017年我应邀参加了中科院微生物研究所举办的“中国微生物组计划——人口健康领域专题研讨会”。
实际上,肠道微生物与人体健康密切关联。2021年,科技部在生命大分子领域里面已经启动了国家微生物组计划。
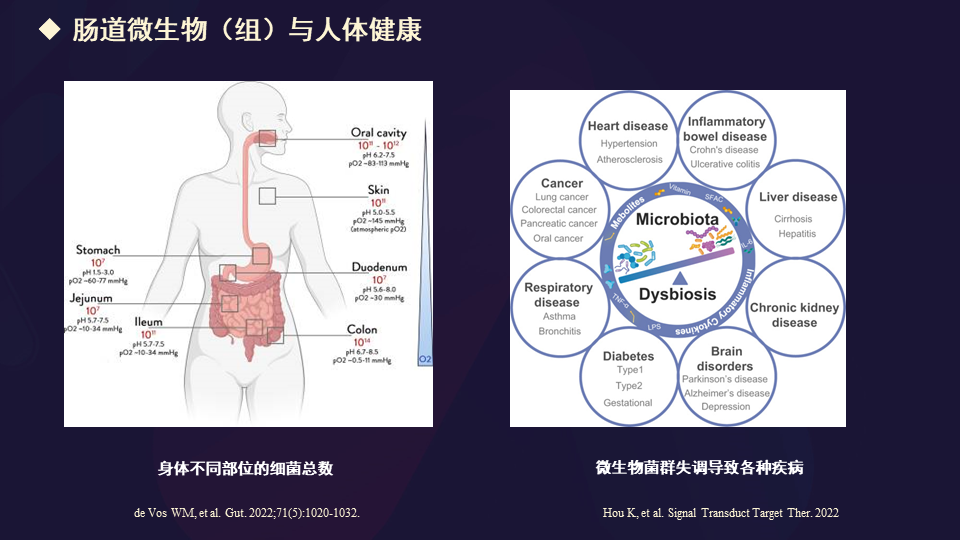
作为神经科医生,我们关注的是大脑疾病、大脑功能与肠道微生物有怎么样的关联。

其实国际上公认的就是一个脑-肠轴的概念。
我们过去总是强调中枢大脑对周围器官系统的影响,但现在反过来更关注的是:尽管肠道跟大脑相距甚远,但是肠道的改变,特别是微生物改变能影响大脑的结构与功能吗?
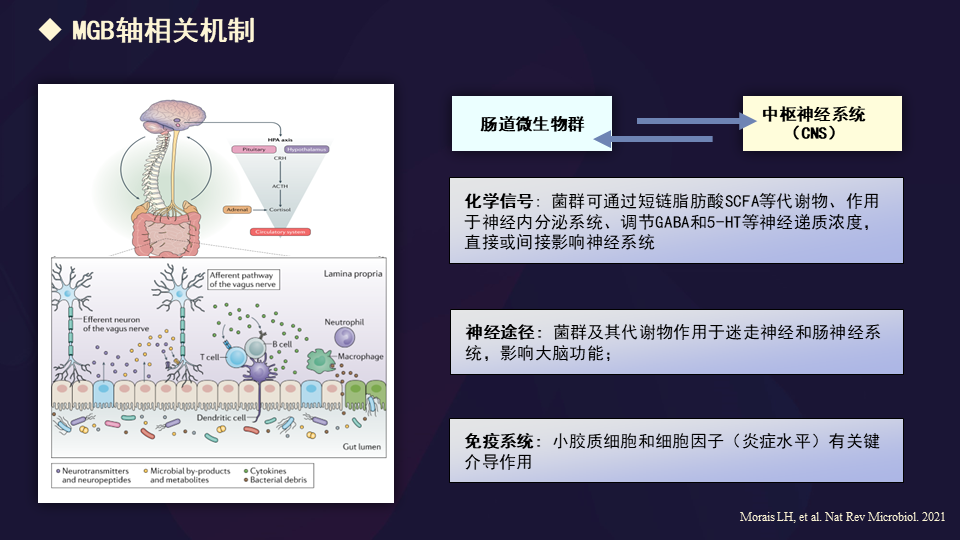
如果要把距离如此远的两个部位相连,依照通俗的观点,可能通过化学信号、神经途径和免疫系统相互关联。
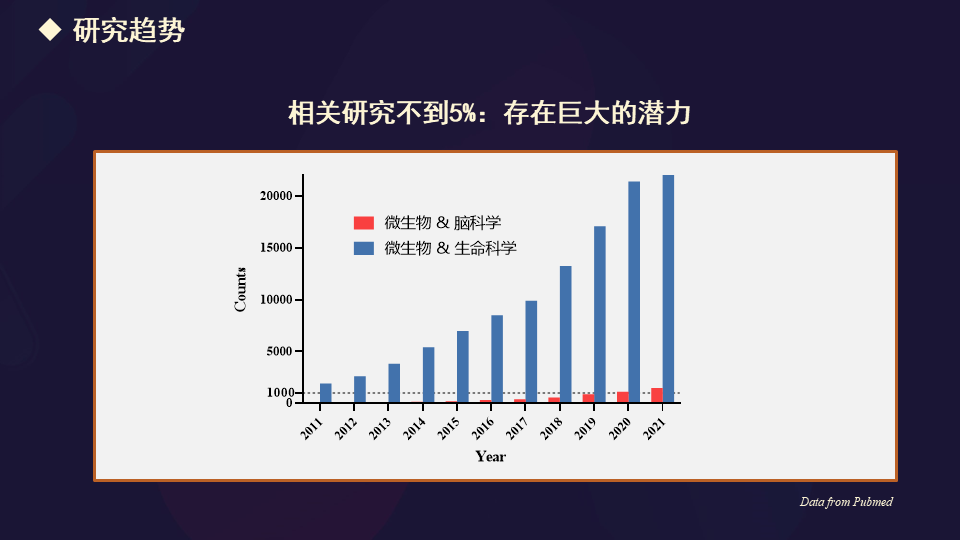
但是将微生物与脑科学紧密结合起来的研究确实是不太多的,这个柱状图里面的红色相对比例很小。
不可否认,在生命科学研究的两大主要计划,我觉得是在奥巴马政府时代提出的四大计划当中的一个微生物组计划,一个脑计划,两者有机结合有可能进一步地推动生命科学,特别是脑科学的发展。
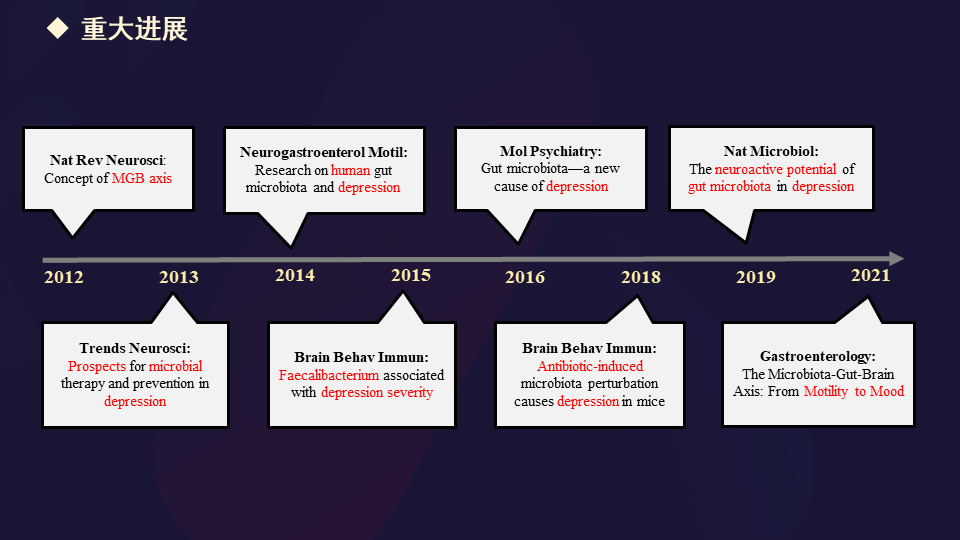
我们回到肠道微生物与抑郁症,最近有哪些研究报道,我们简单地梳理了一下总之,在不同时间点有不同的重大的发现,将抑郁症这样一个非常复杂、非常异质性的重大疾病跟肠道微生物密切关联起来。这也是我们脑计划重点研发的三大疾病之一。
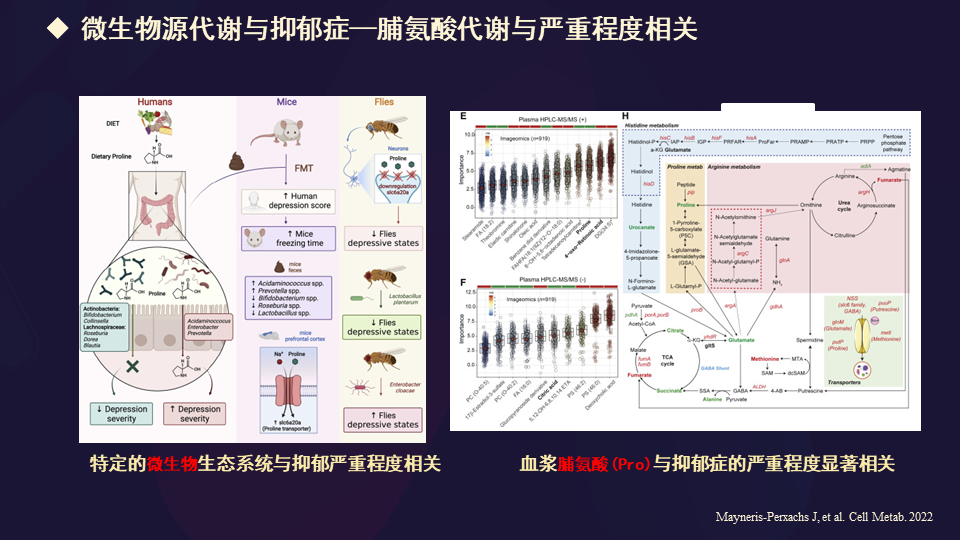
比如这张幻灯片告诉我们,肠道微生物来源的这些代谢产物跟抑郁症的关系,提出了脯氨酸代谢与抑郁症的严重程度是密切关联的。
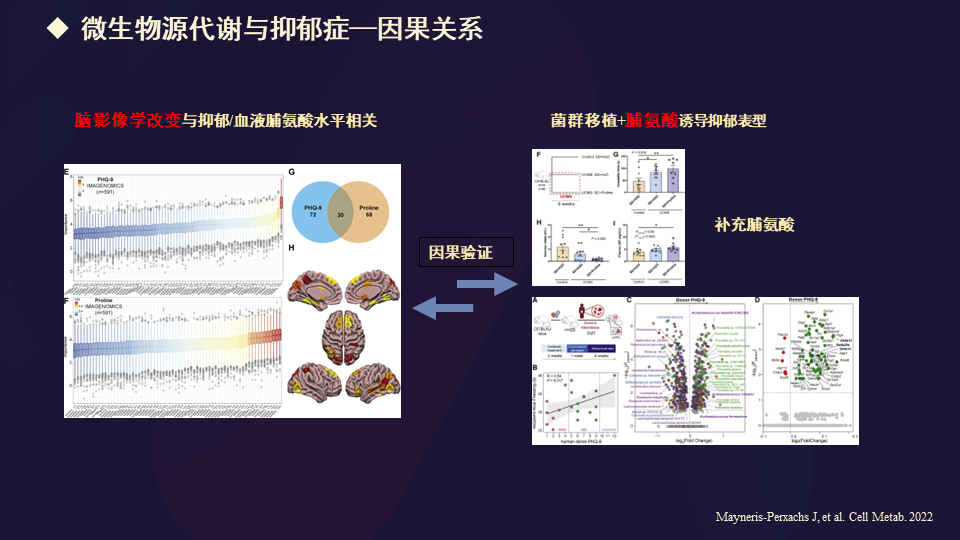
同时证实了这些微生物源代谢产物跟抑郁症存在着一定的因果关系。因为进行菌群移植+脯氨酸诱导抑郁表型,补充以后发生改变,从而证实不仅存在相互的关联,还可能含有一定的因果关系。

这篇文章提到,单菌移植就可以改善抑郁的表型。
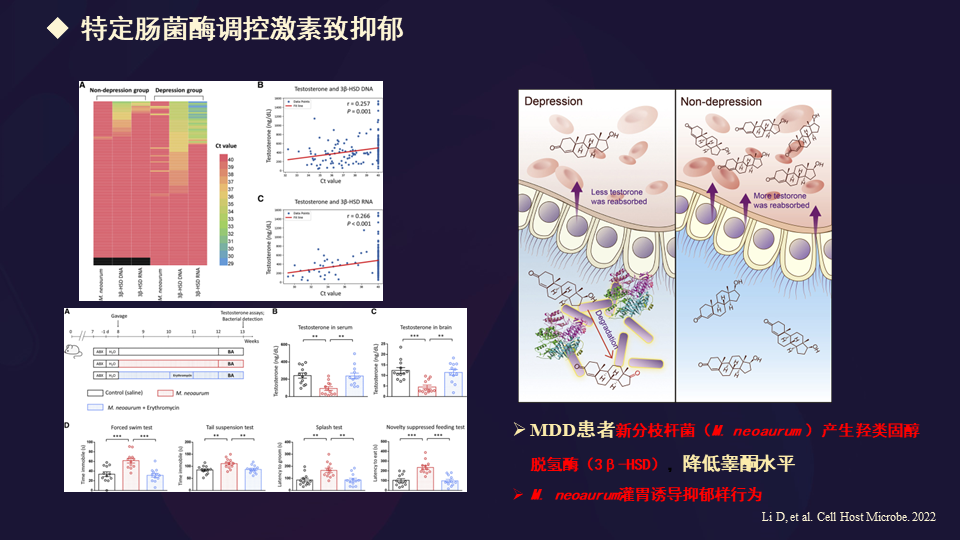
今年我们也看到了另外一篇文章,发现特定肠菌酶调控激素可引起抑郁。在重度抑郁症患者,这种新分枝杆菌M.neoaurum产生的羟类固醇脱氢酶(3β-HSD)降低了睾酮水平。而且用这个菌去灌胃,可以在实验动物诱导抑郁样行为。
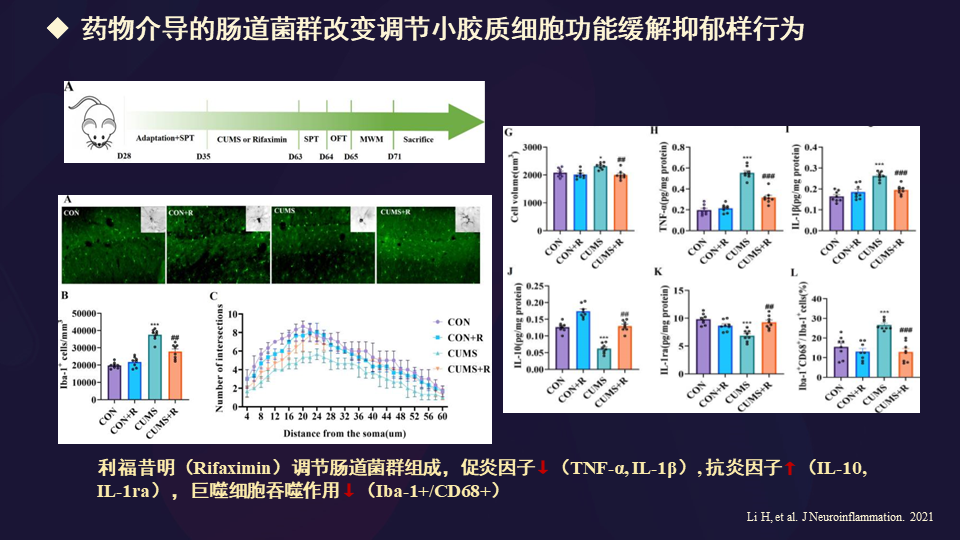
去年的另外一篇文章也报道了药物介导的肠道菌群改变可以调节小胶质细胞功能,缓解抑郁样行为。主要应用利福昔明调节肠道菌群的组成,使促炎因子下调,抗炎因子增高,同时巨噬细胞的吞噬作用降低,进而缓解了抑郁行为。
除了这些,当然还有很多报道,这里只取了一部分。
肠道微生物和其他精神疾病,我主要关注的还有一个是双相情感障碍(BD)。
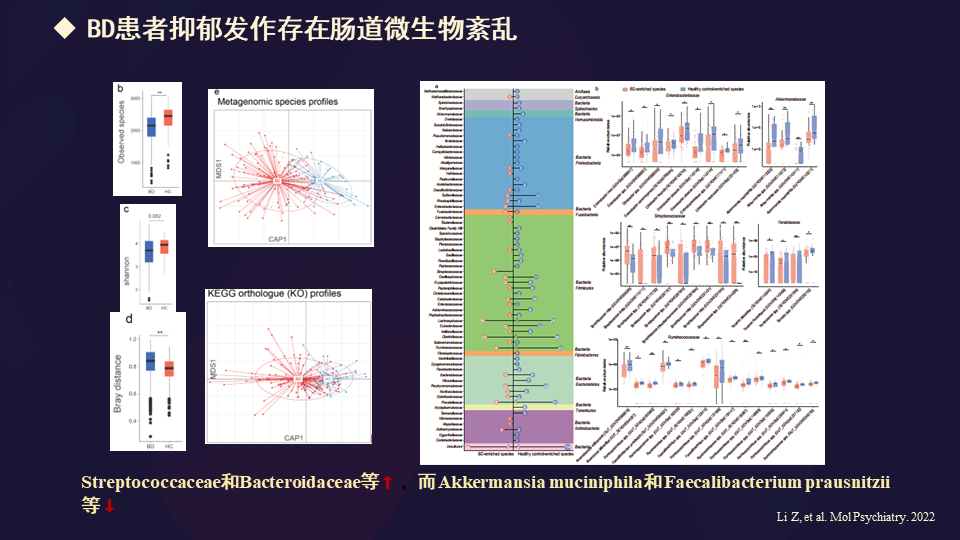
我们看到Molecular Psychiatry的报道发现,双相情感障碍患者抑郁发作的时候,确实存在肠道微生物的紊乱。
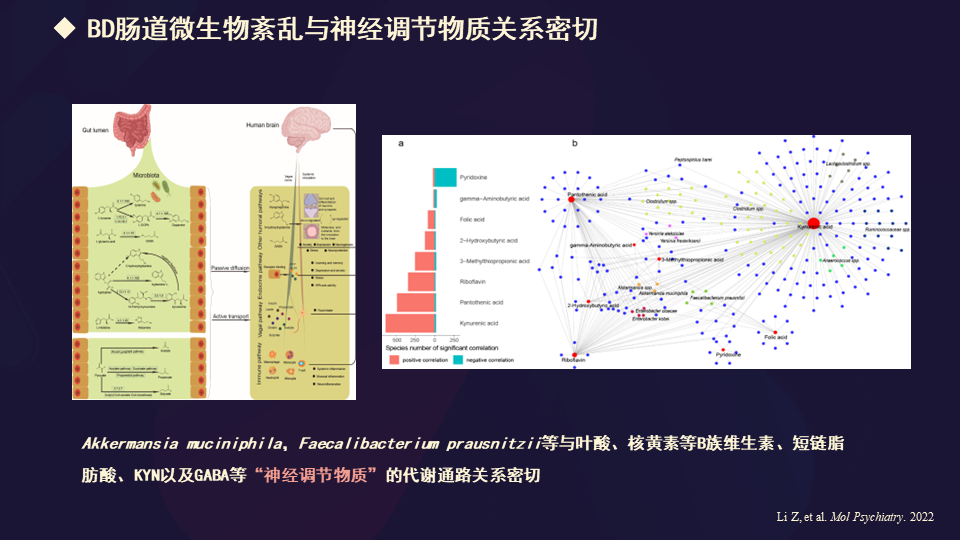
而且,这种肠道微生物的紊乱与神经调节的物质是密切关联的。

2021年另外一篇文章报道,肠道菌群参与TRANK1调控的双相情感障碍。BD患者外周血的TRANK1表达增加,FMT诱导小鼠行为障碍,增加了脑内TRANK1及神经炎症,从而过表达TRANK1后降低了神经元树突棘密度。
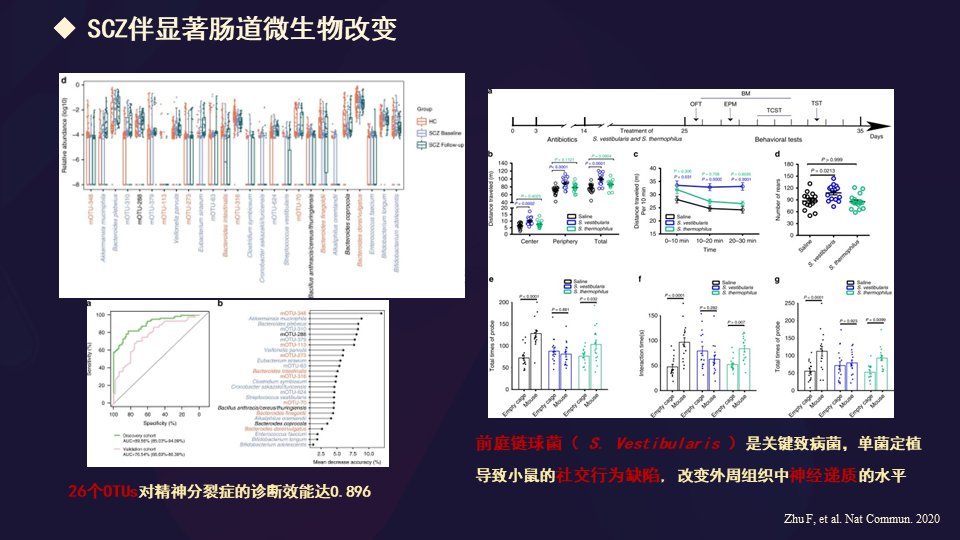
2020年也报告了,精神分裂症患者有显著的肠道微生物改变。

微生物通过调控犬尿氨酸代谢诱导精神分裂症。
我想重点地给大家汇报一下,我们团队在这方面做了哪些工作。
线索:抑郁症尿微生物源代谢紊乱

第一,我们还是从溯源开始。对尿液抑郁症生物标志物的研究发现了微生物源头的代谢改变。
这是我们在2013年发表的两篇JPR(Journal of Proteome Research)和MCP(Molecular and Cellular Proteomics)的文章,发现肠道微生物与抑郁症的关联。这是10年前我的报告。

当时也认为,这个工作可能是对抑郁症的全新认识的重要工作。
随后我们也证实了肠道微生物紊乱是导致抑郁症的新的病因。
证据:肠道微生物紊乱是抑郁症的新病因

我们就采用类似Koch法则,首次将抑郁表型从人传递到无菌动物,证实了肠道微生态紊乱是导致抑郁的新的病因。


2016年在《分子精神病学》发表以后,在国际上引起了广泛的影响。

2016年发表到现在已经他引880多次,这是前段时间的数据。
特异性:抑郁症肠道微生物独特的紊乱模式
我们想知道这样一个病因改变,它是否在抑郁症是特异的,还是所有精神疾病都是这样的,我们开展了进一步的研究。
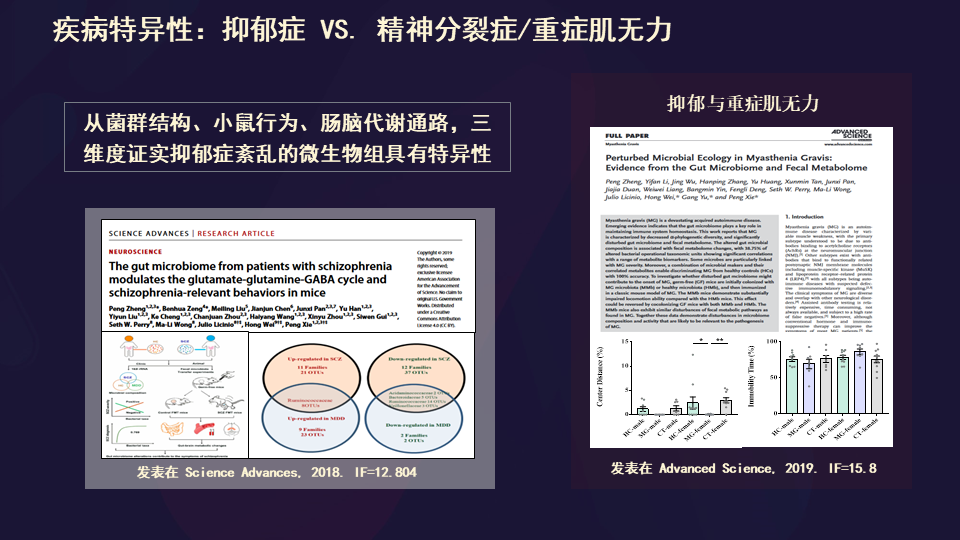
首先,以精神分裂症作为精神疾病代表,以重症肌无力作为远离大脑的神经系统改变作为代表,我们分析后发现两者确实是不一样的。这就说明引起抑郁症的肠道微生态的失衡有相对的特异性,不同的疾病是不同的。

除了神经和精神疾病,还有很重要的一个疾病跟抑郁症是一样的,就是我们说的双相情感障碍。它在绝大多数的状态下表现抑郁的时候跟抑郁症没有区别,而我们前面发表的文章发现不一样。
上面是重度抑郁症,下面是双相情感障碍,都是抑郁相,但是它相同的非常少,这是我们非常震惊的发现。过去发现,双相情感障碍的抑郁相和抑郁症的抑郁相没有什么区别,很难找到它们的区别。
这是个重大的发现,正如我们在临床上长期争论不休,神经系统疾病中多发性硬化和视神经脊髓炎是一个病理改变,所以这一点应该给我们启示。

所以,在国外备受关注。
锁定病原:筛选潜在致病菌并明确调控通路
这样确定引起抑郁症的病因以后,我们话必须锁定可能有哪些病原,找到潜在的致病菌和调控通路。
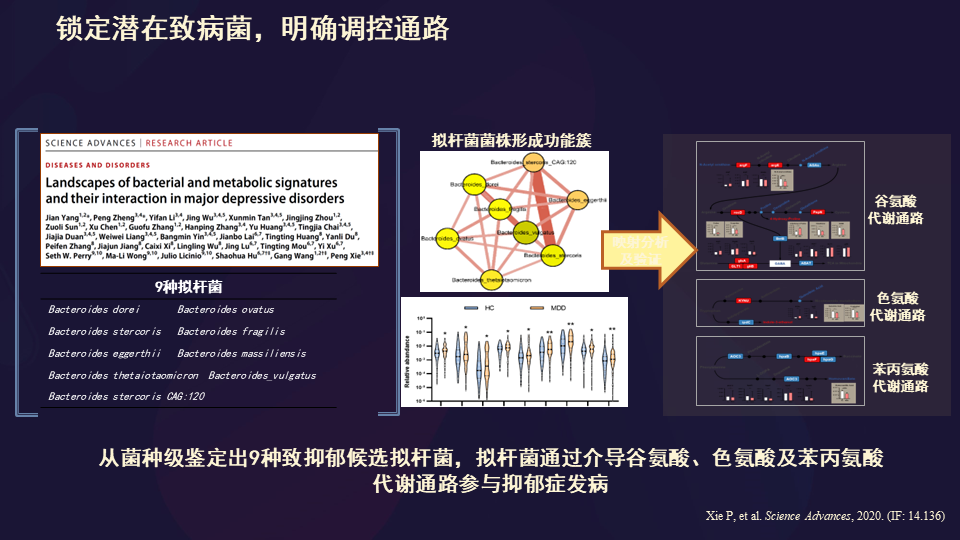
于是我们又发表了文章,从菌种级别鉴定出了9种导致抑郁症的候选拟杆菌,通过介导谷氨酸、色氨酸和苯丙氨酸代谢通路参与抑郁症发病。
跨物种机制探索:非人灵长类自然抑郁模型
但是它进一步的怎么致病的机制,我们想能不能通过非人灵长类抑郁动物模型做一些探索。

这是我们做的抑郁猴模型。

结果我们发现,肠-脑甘油磷脂代谢紊乱是微生物介导抑郁发作的关键途径。
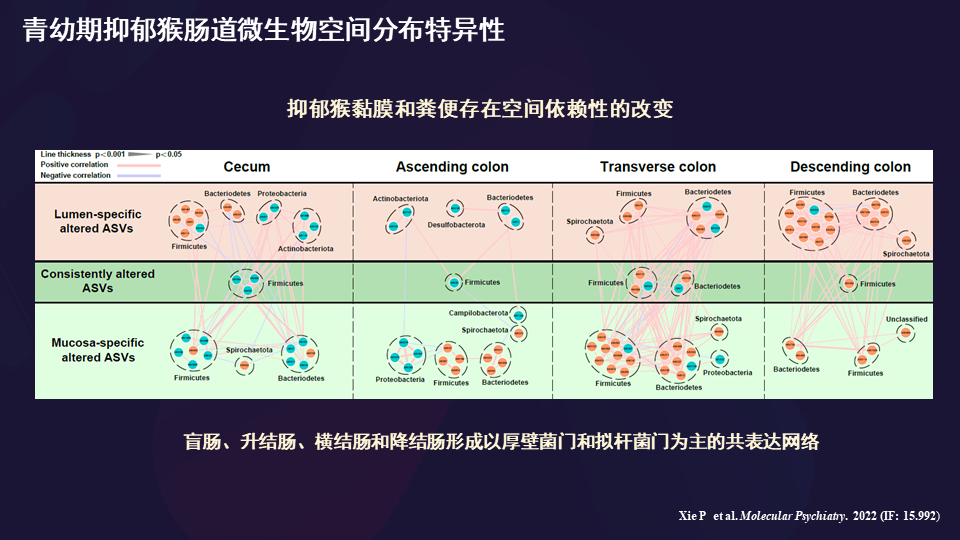
针对抑郁猴黏膜和粪便的改变,我们是做的青幼猴。发现青幼猴的肠道内部和肠壁的微生物组成是不同的,而且跟成年猴不一样。
这回答了临床上非常关心的问题,为什么抗抑郁剂不能够在儿童、青少年使用。儿童不是小大人,不能以公斤体重减量应用,我们之前不知道原因。
尽管我们在《柳叶刀》发表的文章提出除氟西汀有效外,抗抑郁剂对儿童、青少年无效。一经发表以后被FDA采用,氟西汀成为全球唯一推荐用药,但我们无法解释原因。2021年,发表在《分子精神病学》上的这篇文章就回答了这个问题。
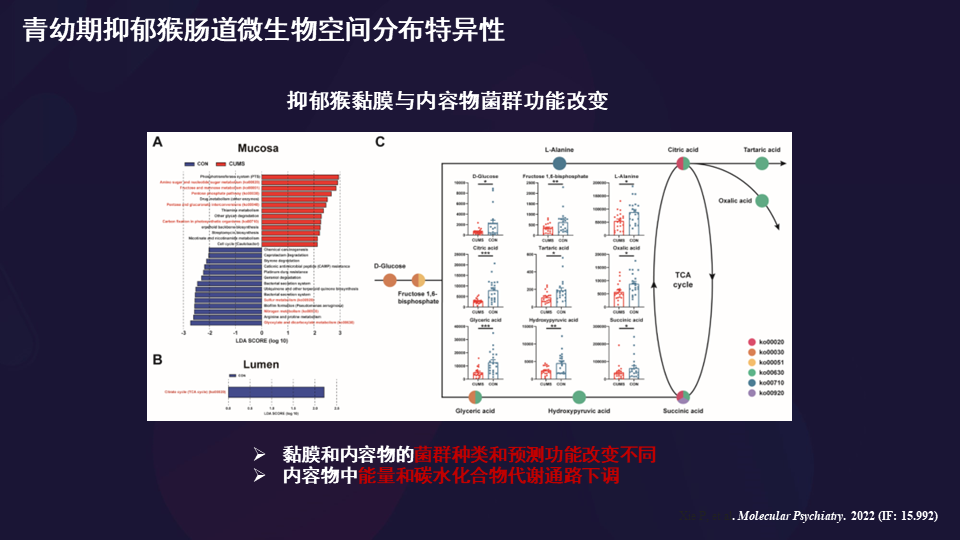
这是我们发现它的菌群改变,存在一些不同的差异。
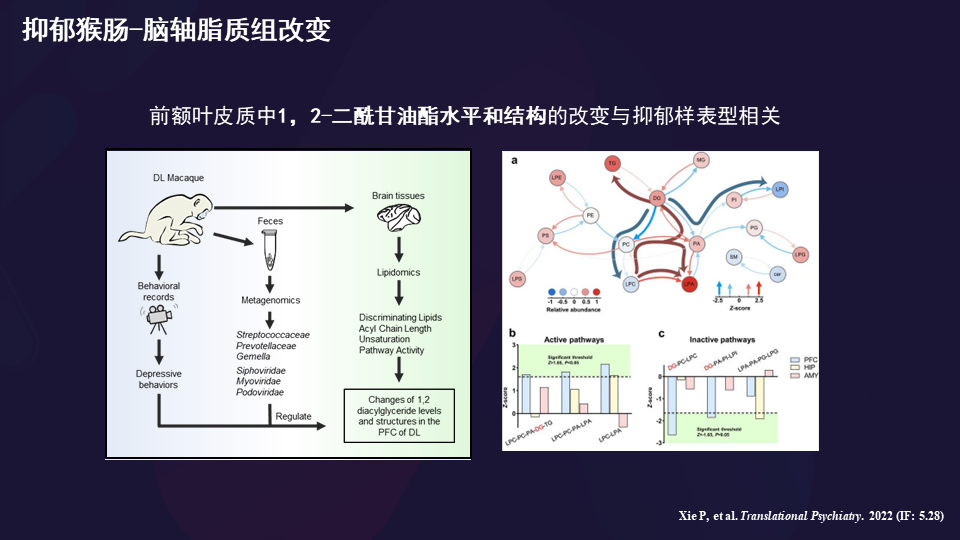
同时,肠-脑轴脂质组改变也是非常突出的。
跨物种机制探索:啮齿类动物抑郁模型
再下面,我们做啮齿类动物的抑郁模型介绍。

我们做了与抑郁相关的肠道微生物改变的转录调控网络,发现跟神经发生有关。
所以由这一点的研究,考虑到我们下面正在做的一个工作,就是希望从发育生物学的角度去探索肠道微生物怎么调控大脑,它的生理状态对大脑功能的结构的重塑、生理行为表型的改变可能有哪些影响。

我们也做了MiRNA-mRNA调控网络介导的抑郁相关TH17细胞分化障碍相关研究。
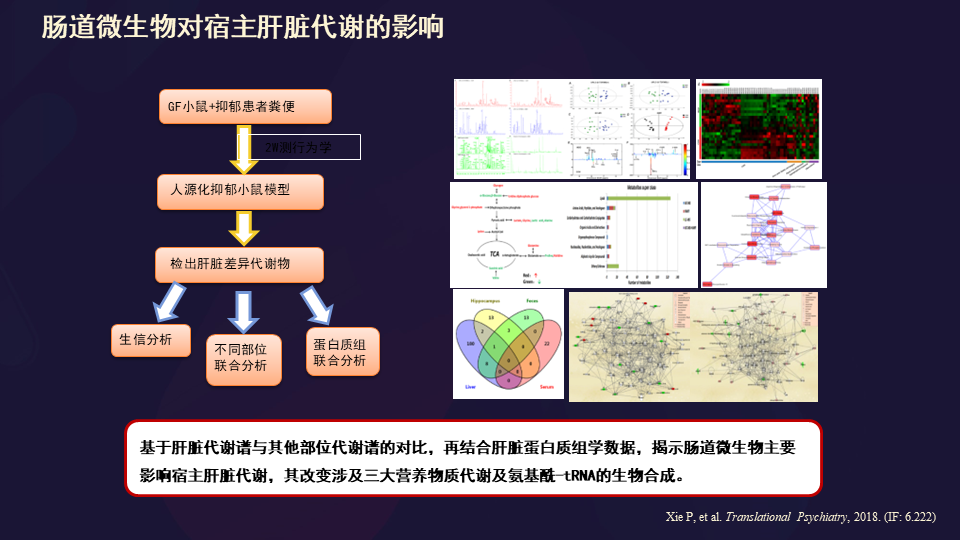
我们也发现了肠道微生物对宿主肝脏代谢的影响。
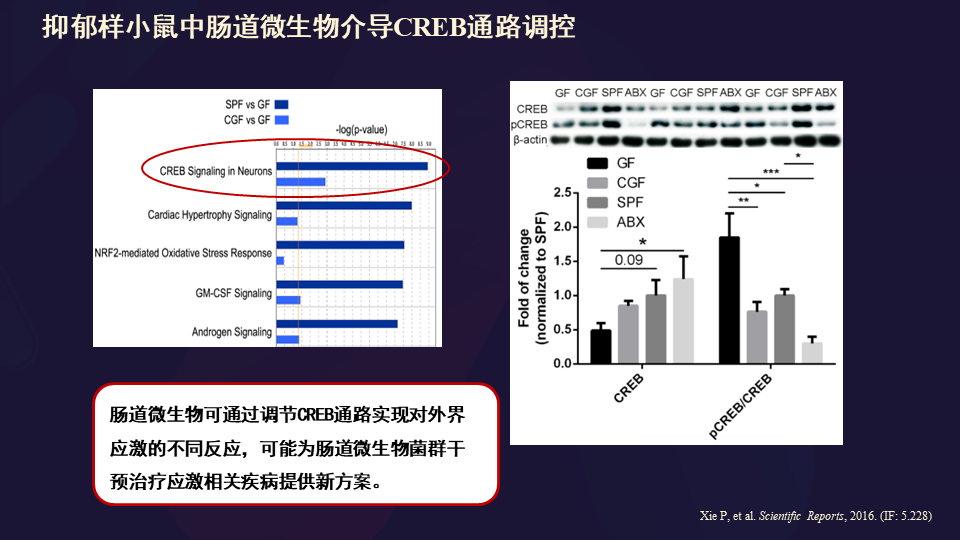
这里面存在连续的这些通路改变。

提到肝脏的话,我们想到的可能是肝脏是我们的情绪调控器官,认为其实还是有道理的。
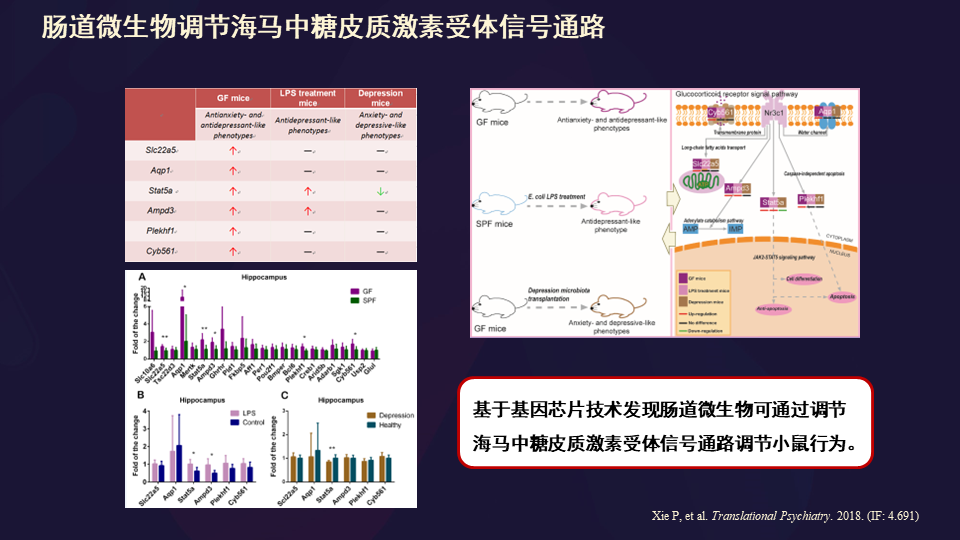
还有就是我们微生物调节海马中糖皮质激素受体相关研究。
我们最近正在做肠道微生物调控小胶质细胞演变的相关研究,并已经投稿在送审。我们采用一些单细胞组学的技术,看看在海马和前额叶究竟哪些细胞参与了哪些改变。结果发现,小胶质细胞的基因表达模式明显改变,而且小胶质细胞亚群存在着相互的转化。
我们期待这篇文章发表以后,能够对我们做抑郁比较多的两个部位——海马和前额叶的细胞、亚细胞的定位有所帮助。
疾病干预
讲到疾病干预呢,我们团队试图做了一点原来的工作。一个就是酪酸梭菌可以减少抗生素处理抑郁模型小鼠盲肠的体积,增加海马树突状分支的数量和树突棘的密度,使它表型发生变化。
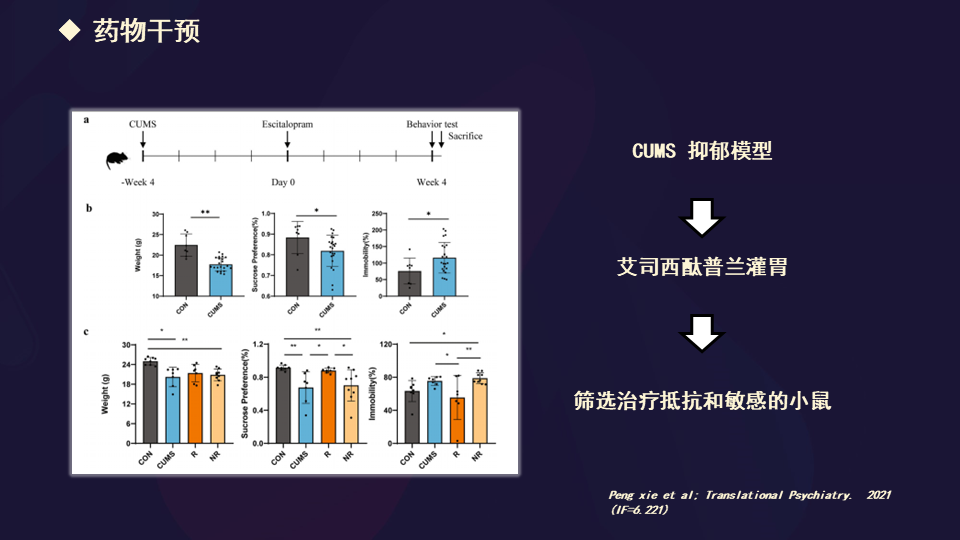
同时我们也做了一项工作,是用CUMS抑郁模型,通过一个抗抑郁剂的灌胃,筛选出对治疗抵抗和敏感的这些小鼠。
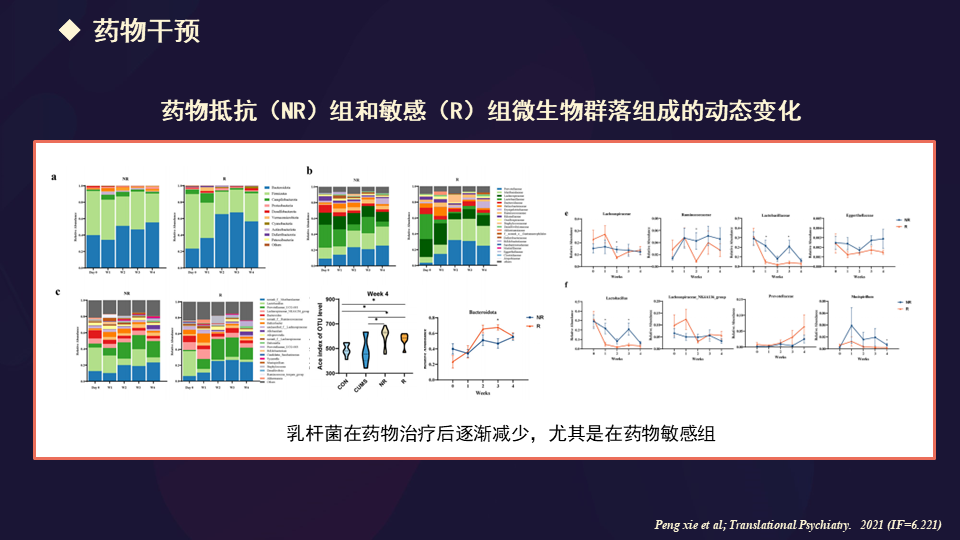
找到这些药物抵抗或敏感小鼠的微生物群落组织的动态变化的规律,这也是我们做的工作。这个发表在Translational Psychiatry。

我们也做了一个改变肠道微生物菌群和代谢物之间的共现网络,发现了一些敏感组当中,毛螺菌科的5个操作分类单元(OUT)与豆甾醇显著正相关。这种分子对细菌饱和度和降解有抵抗力。

我们这些研究也得到国家973、国家重点研发计划等等一系列项目的支持。

为此我们也被写进了国家2019年中国科学院的年度报告《精神疾病肠道微生物组研究现状及展望》。我们也欣喜地看到,一年以后,科技部就在国家微生物组计划进行了布局。

而我们也应邀在《中华医学杂志(英文版)》撰写有关神经精神疾病与肠道微生物的改变。
同时,我们也应中国科学杂志社的邀请,在《中国科学:生命科学》对肠道微生物跟神经精神疾病的相互关联做了一个系统的回顾。

我们目前也参加了重庆市英才计划·智创未来的一些工作。

这是项目成果的总决赛项目,在成都、北京、深圳、上海、重庆各赛区700多项目,我们进入了最后的总决赛,大概排在第七位。

该项目也得到了重庆市政府的重点推进和支持。

作为一名神经科的医生,首先,我希望能攻克部分引起抑郁症的肠道特定菌群的分离、鉴定和培养技术。
再有,明确这些菌株哪些是关键的致病菌株,它是以什么途径去调控脑-肠轴的改变,并且构建相应疾病相关的菌种资源库和相应的诊断试剂研发。
这是我们目前正在一步步开展的工作。
谢谢各位!


