
大家好,我是谢黎炜研究员,来自广东省科学院微生物研究所华南应用微生物国家重点实验室。我今天演讲的题目是“衰老相关肠道菌群及其代谢物调控肌卫星细胞稳态”。

骨骼肌在我们机体内占据到35%~45%的重量,除了支撑我们机体的运动,在组织间的交互调节、稳态调节中扮演了重要的角色。
不管是营养不良,还是恶病质以及衰老,都会导致骨骼肌出现萎缩,加剧代谢综合征的发生和发展,以及衰老的加剧。
Q1 骨骼肌生长发育调控因子?
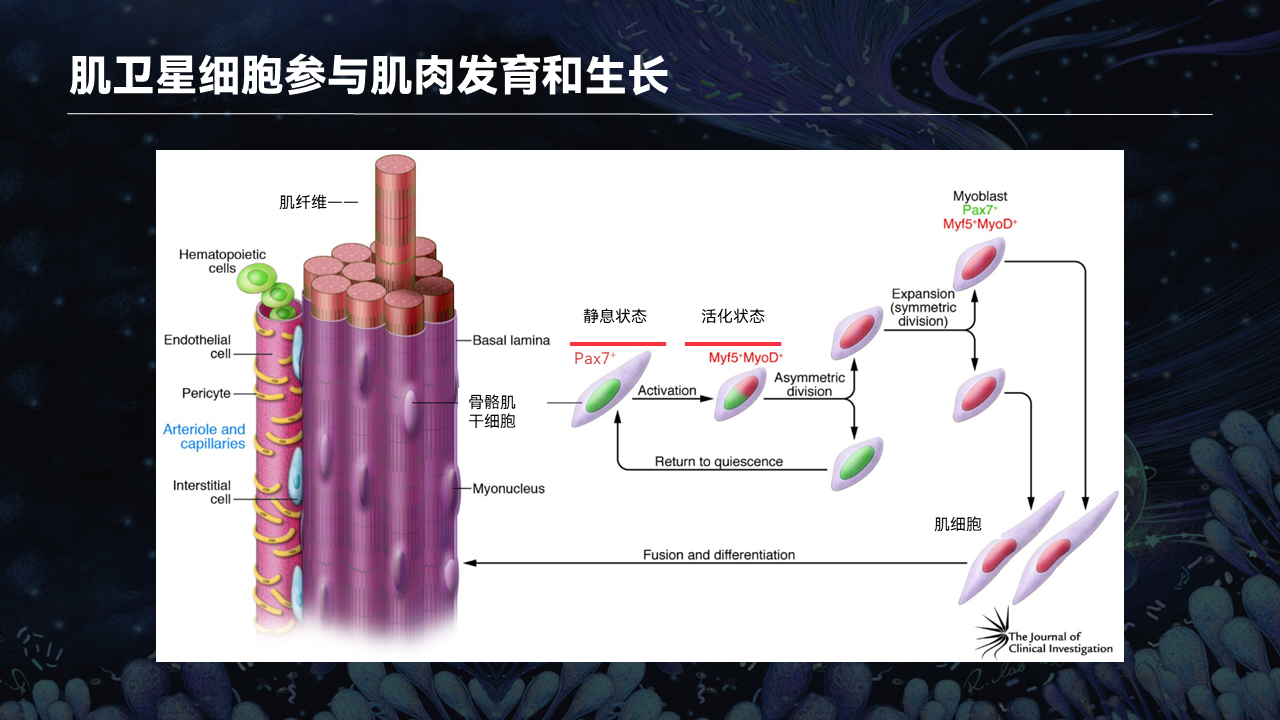
在正常情况下,肌卫星细胞会处于静息状态。当我们机体的肌肉受到损伤抑或在健身的过程中,肌卫星细胞会被活化。
在肌卫星细胞中,有两类转录因子表达。在静息状态下,主要表达Pax7。当肌卫星细胞活化之后,会有另外一个转录因子,叫做MyoD。
MyoD会激活肌卫星细胞增殖变成myoblast,也叫做成肌纤维细胞。这些成肌纤维细胞会进一步地分化成肌管,融合到损伤的肌肉,加速肌肉的损伤修复,包括骨骼肌的肥大。
另外一小部分的成肌纤维细胞会继续表达Pax7,而MyoD的表达会被受到抑制。那么这些部分的成肌纤维细胞会回到静息状态,去补充干细胞池的数量,等待下一轮的损伤修复以及干细胞的活化。
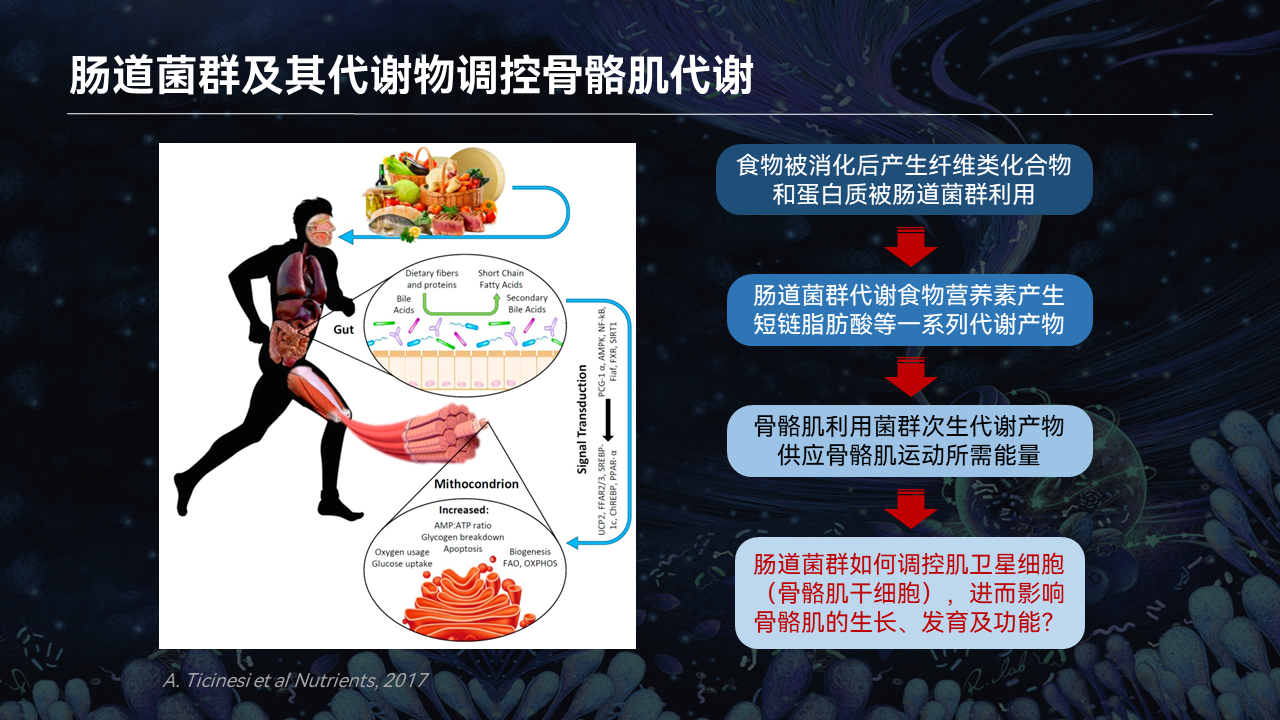
我们肌肉在肥大以及再生的过程中,需要多种的营养物质或代谢物。我们在食物中所摄取这些营养物质、代谢物在跟肠道菌群发生互作之后,经过肠道吸收入血、循环到骨骼肌,参与到骨骼肌的损伤、再生以及肥大。
那么在这个过程中,到底什么样的菌群,产生了什么样的代谢物,如何参与到调节干细胞稳态以及骨骼肌的肥大和再生,是不清楚的。
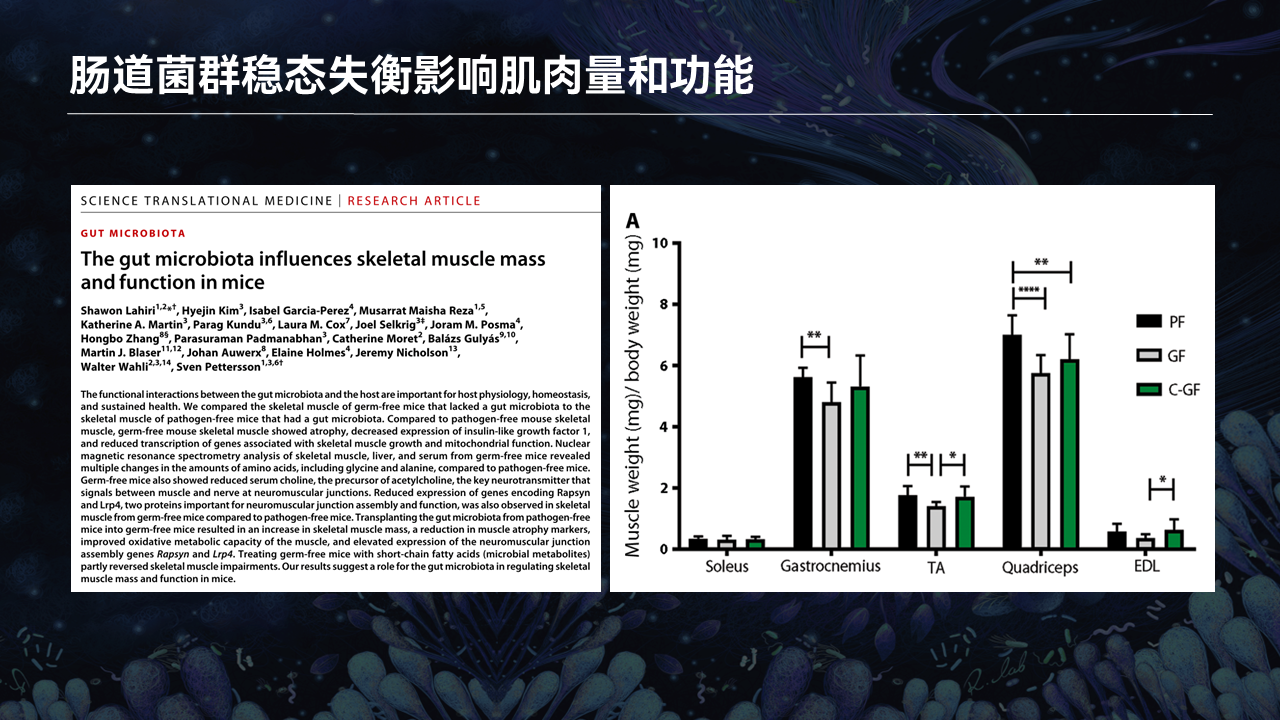
2019年的时候,我们在Science Translational Medicine上发表了一篇文章。
无菌小鼠和常规小鼠相比,无菌小鼠的肌肉出现功能性障碍以及肌肉量降低。当他们将无菌小鼠和常规小鼠合笼之后,能够逆转由于肠道菌群缺失所导致的骨骼肌发育障碍。
这也就暗示,肠道菌群参与骨骼肌功能的调节以及骨骼肌肌肉量的调节。
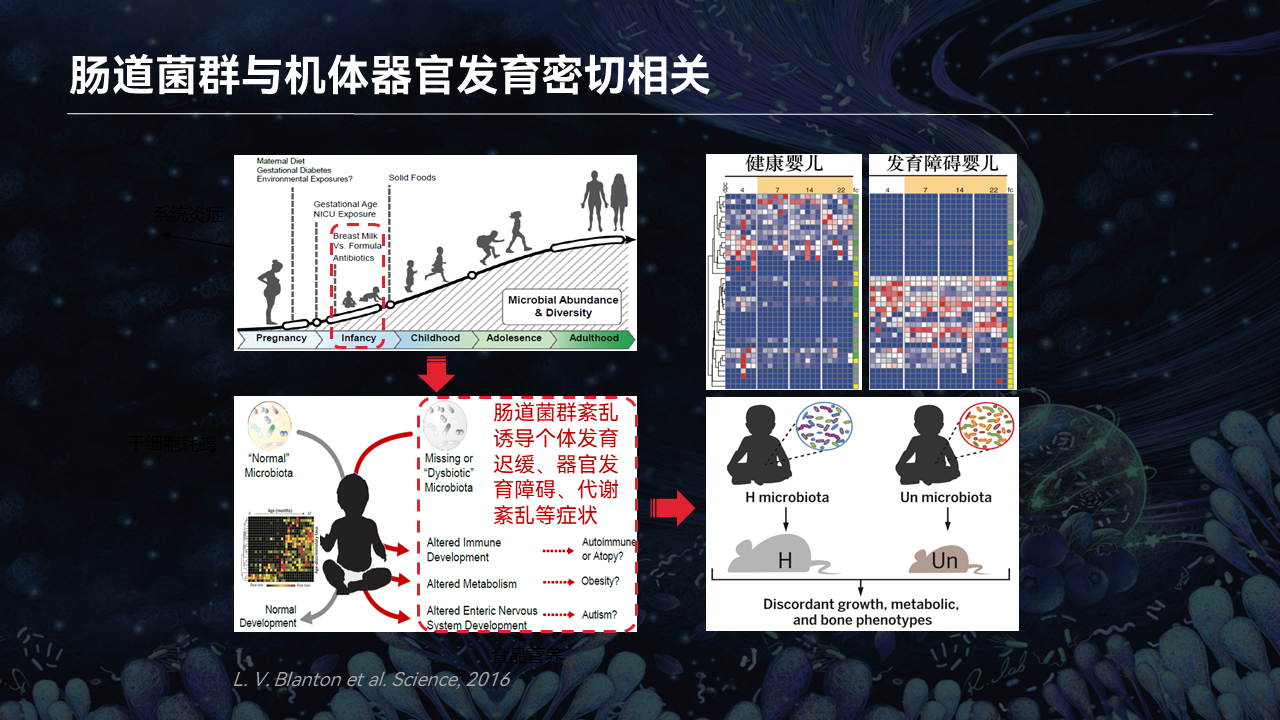
我们知道,肠道菌群不仅参与到骨骼肌的发育、再生,肠道菌群在机体的早期发育,尤其是小婴儿出生之后,早期肠道菌群稳态的调节都与疾病的发生和发展,尤其是代谢综合征、大脑的发育以及神经相关的疾病存在密切的关系。
当肠道菌群的稳态受到影响,包括由于抗生素、饮食和环境,都会诱发一系列的代谢综合征和器官发育障碍。这些状况现在逐渐趋于年轻化。
Q2 菌群及代谢物是否参与骨骼肌调控?

我们这个研究主要想去观察,在整个生命周期中,从小婴儿出生到衰老以及到死亡,肠道菌群及其代谢物的变化规律,以及它们调节骨骼肌干细胞稳态所扮演的一些角色,进而去理解肠道菌群及其代谢物跟骨骼肌再生、发育、衰老之间的关系。

在这个研究中,我们设计了两套肠道菌群稳态失衡的模型。
第一套模型,我们利用抗生素清除肠道菌群,进而去观察骨骼肌干细胞所发生的变化。
另外一套模型,我们使用粪菌移植模型。与传统的观念和实验设计所不同的是,我们将衰老小鼠的粪便移植给成年的小鼠,观察在成年小鼠肠道菌群发生改变的时候,或者是肠道菌群出现扰动的时候,骨骼肌干细胞的稳态发生什么样的变化。
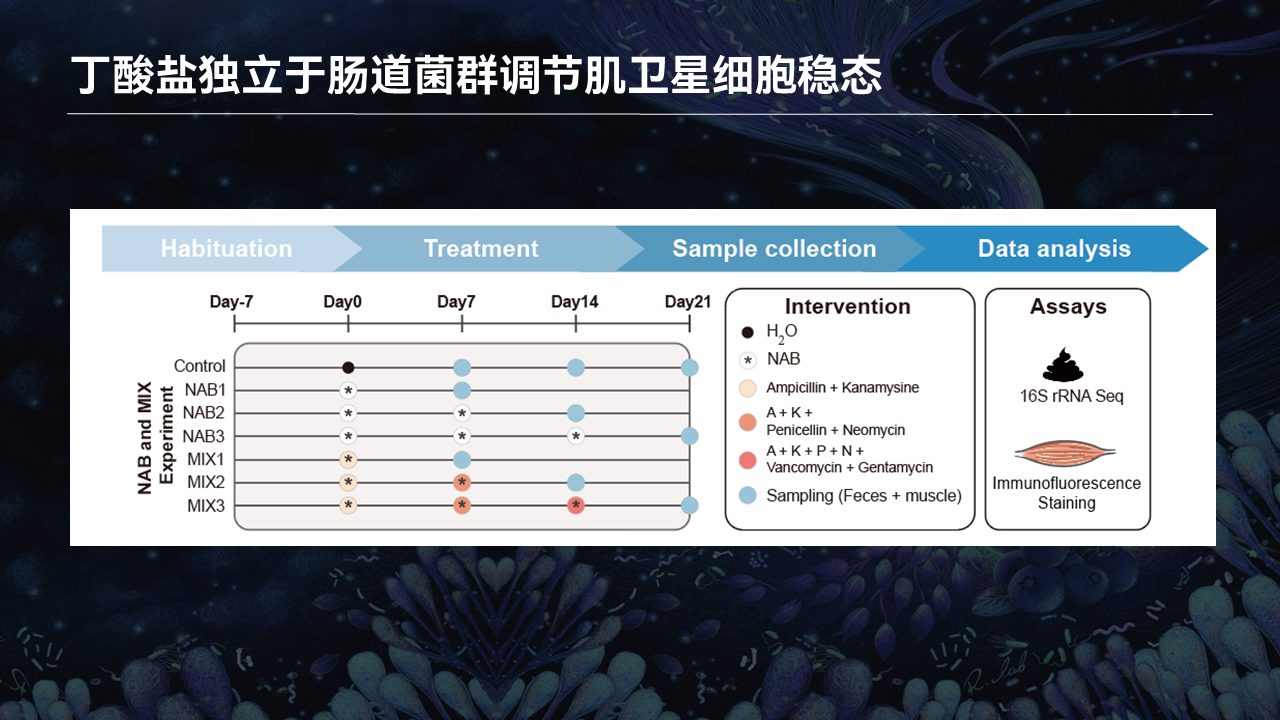
在第一套模型里边,我们没有直接像传统的实验设计,一次性加入了6种或者8种的抗生素混合物。相反我们在整个3周的实验周期,头一周加入2种抗生素,第二周再加入2种以达到4种,第3周加入最后的2种以达到6种抗生素,避免一次性多种抗生素可能导致的耐药菌的出现。
在这个实验过程中,我们选用了单根肌纤维分离、骨骼肌再生以及胫骨前肌冰冻切片染色,来观察干细胞稳态发生的变化,损伤再生的过程中新生成肌管速度发生的变化,以及评估跟肠道菌群稳态之间的关系。

在第一套模型里边,与喝水组相比,3周的实验周期过程中,不管是2种还是4种或6种的抗生素,都会导致肠道菌群香农指数(Shannon's Diversity Index)所代表的α多样性,以及肠道菌群的β多样性受到极大的扰动。
利用PICRUSt去分析肠道菌群功能,我们也从热图中看到,肠道菌群的功能在抗生素的干预条件下,出现了功能性改变。
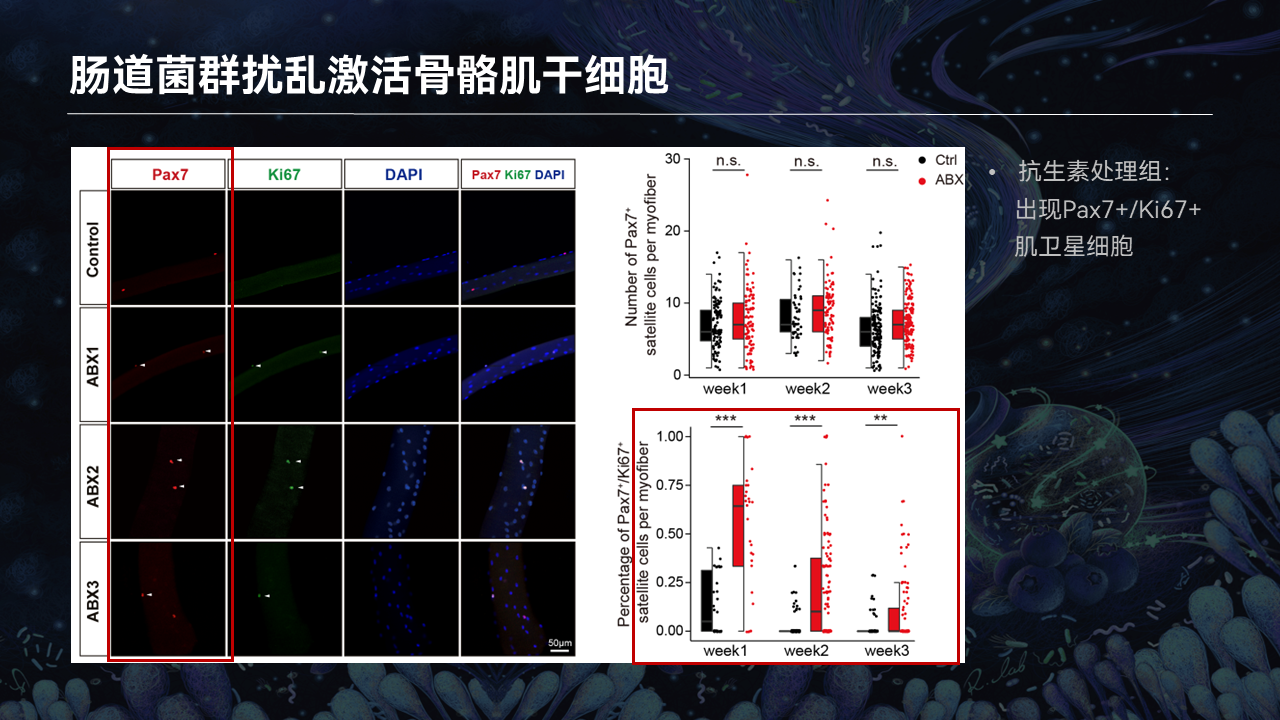
在单根肌纤维分离以及荧光染色里边,利用Pax7去标记骨骼肌干细胞。与喝水组相比,ABX1、2、3分别代表了抗生素干预的第一周、第二周、第三周。
利用Ki67荧光染色去标记那些活化的干细胞,我们可以看到,喝水的对照组里边,Ki67时刻保持阴性。在抗生素清除了肠道菌群之后,几乎所有的干细胞变成了Ki67阳性,而且这样的阳性状态从第一周维持到了抗生素干预的第三周。
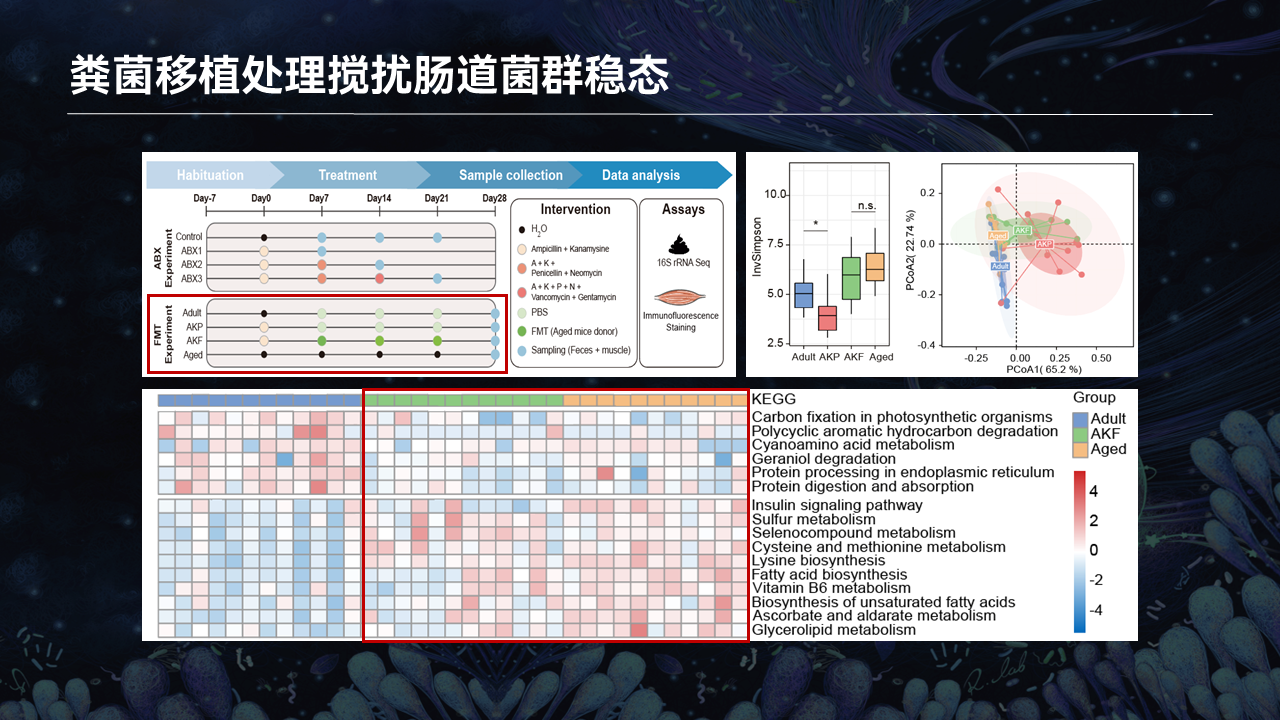
另外一套肠道菌群扰动的模型,我们将衰老小鼠的粪便移植给成年的小鼠。连续3周的移植之后,绿色的柱、土黄色的柱分别代表移植了衰老小鼠粪便的受体小鼠以及衰老小鼠粪菌的供体。
从香农指数所代表的α多样性以及β多样性,我们可以看到,衰老小鼠的供体和移植了衰老小鼠粪便的成年小鼠,它们的α多样性、β多样性都趋近一致,包括PICRUSt所预测的菌群功能也趋近于一致。
以上结果暗示,成年小鼠在接受了衰老小鼠的粪菌移植之后,它的肠道菌群的组成、结构、功能都趋向于衰老的小鼠。
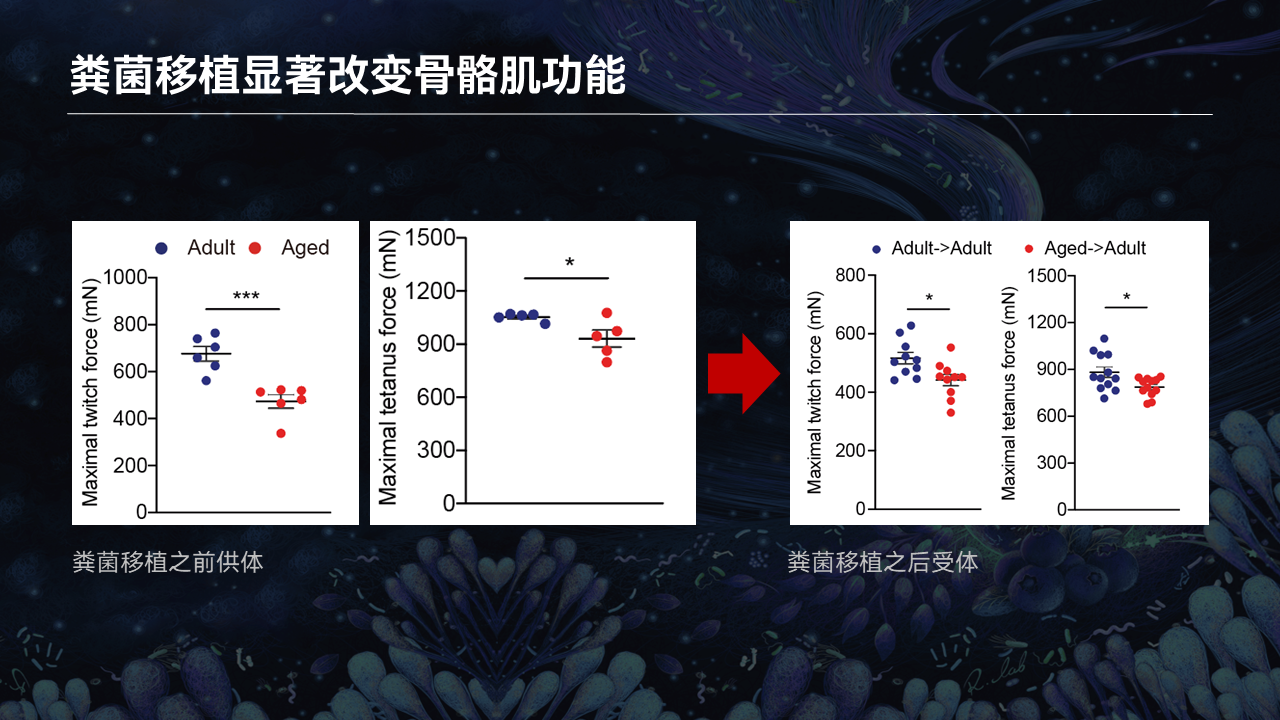
在骨骼肌功能评估方面,我们检测了供体和受体的骨骼肌的拉伸力。
从左边的拉伸力检测图,我们检测了粪菌的供体的成年小鼠和衰老小鼠,可以看到,红色的点代表了衰老小鼠的骨骼肌的拉伸力,是显著低于成年小鼠的供体。在经过3周的移植之后,它的肌肉拉伸力依然维持比较高的水平。相反,移植了衰老小鼠粪便的成年小鼠的肌肉拉伸力出现了显著的降低。
这也就暗示,当肠道菌群稳态受到扰动之后,会导致肌肉的功能出现障碍。
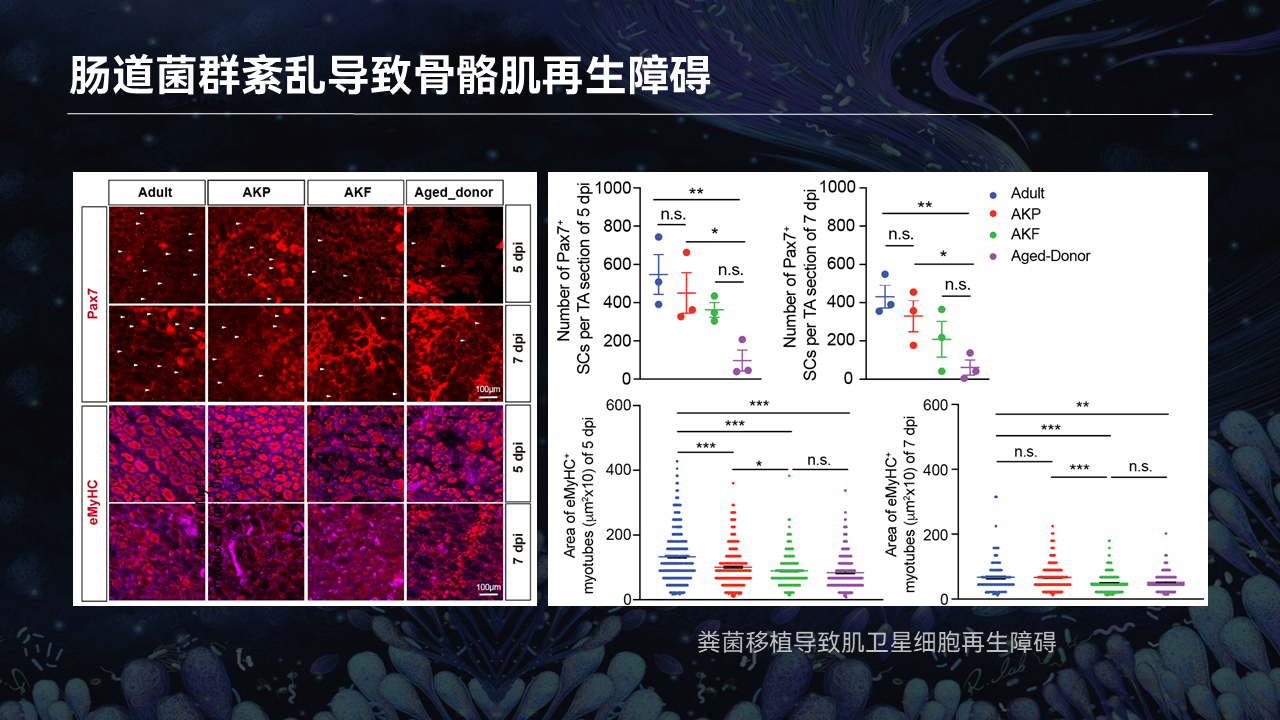
对于移植了衰老小鼠粪便的小鼠,骨骼肌再生会受到什么样的影响,骨骼肌干细胞的增殖速度、分化速度在这几组小鼠中会发生什么样的变化。
我们通过胫骨前肌注射蛇毒来诱导骨骼肌的损伤再生。可以看到,与第一组对照组相比,衰老小鼠的供体这一组,整体Pax7阳性骨骼肌干细胞在损伤的第五天和第七天,它的增殖速度是显著慢于对照组的小鼠。
同时接受了衰老小鼠粪便移植的年轻小鼠,Pax7阳性干细胞的增殖速度也显著低于对照组。而和衰老小鼠的供体这一组相比的话,它其实是类似的。也就暗示,肠道菌群的扰动会让骨骼肌干细胞在损伤再生过程中,增殖速度受到显著影响。
另外,我们也通过荧光染色去检测了eMyHC阳性的新生成的肌管数量。与对照组相比,衰老小鼠的供体和成年小鼠的受体,它的eMyHC阳性的肌管数目也是少于对照组。这就暗示,新生成肌管的速度、成肌纤维细胞的分化速度也受到了严重的抑制。

我们来简单地总结一下第一部分的重要发现。
我们发现,在两套肠道菌群扰动或肠道菌群紊乱的模型里边,抗生素处理和衰老小鼠的粪菌移植给成年小鼠都会导致骨骼肌干细胞出现自活化,同时会降低骨骼肌干细胞在损伤再生过程中增殖、分化的速度以及新生成肌管的速度。
Q3 哪些菌群及代谢物参与骨骼肌稳态调节?
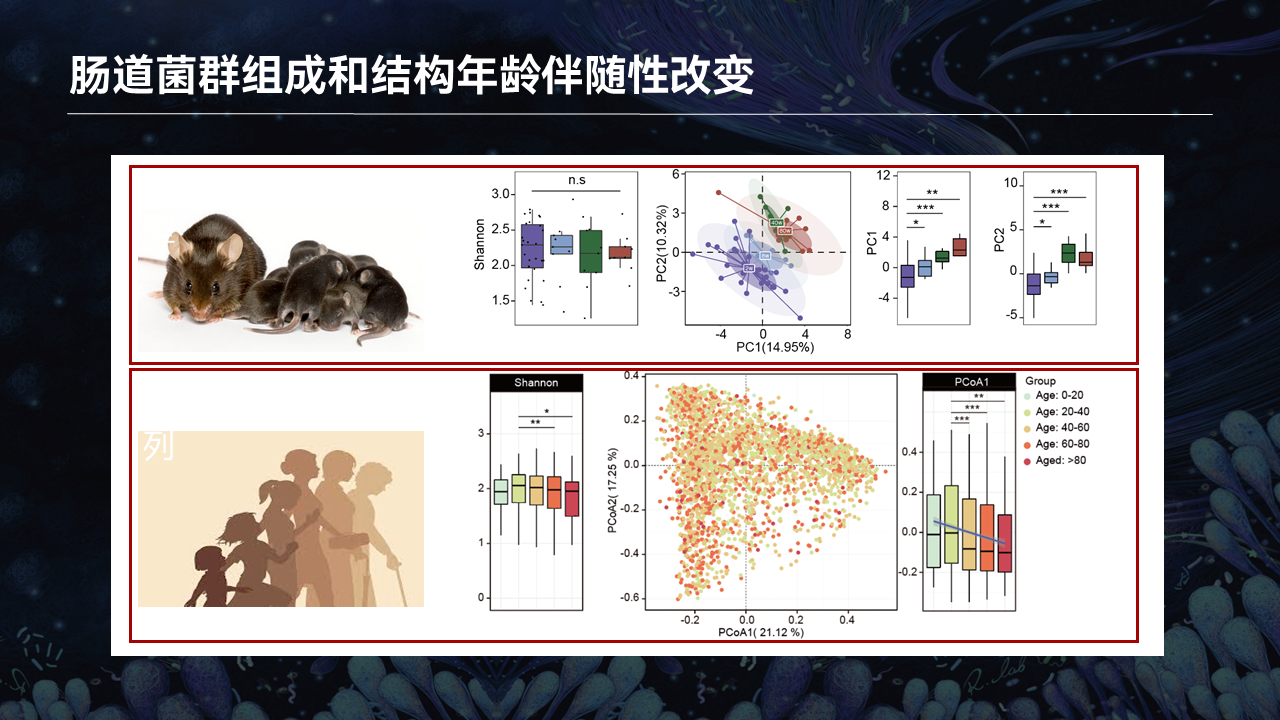
现在还有一个重要的问题是,到底是什么肠道菌群以及其代谢物参与骨骼肌干细胞稳态的调节呢?
为了回答这个问题,我们收集了不同年龄段的小鼠以及人群的粪便16S测序的数据。在小鼠数据里边,我们收集了2周、10周、40周以及80周,覆盖了整个生命周期的小鼠粪便。
通过16S测序,我们发现,虽然肠道菌群的α多样性在不同的年龄段没有显著的差别,但是整体肠道菌群的结构出现了非常显著的动态性变化。
这些变化在广东省微生物组计划健康人群里边也看到了类似的趋势,就暗示肠道菌群会伴随年龄出现动态性变化。
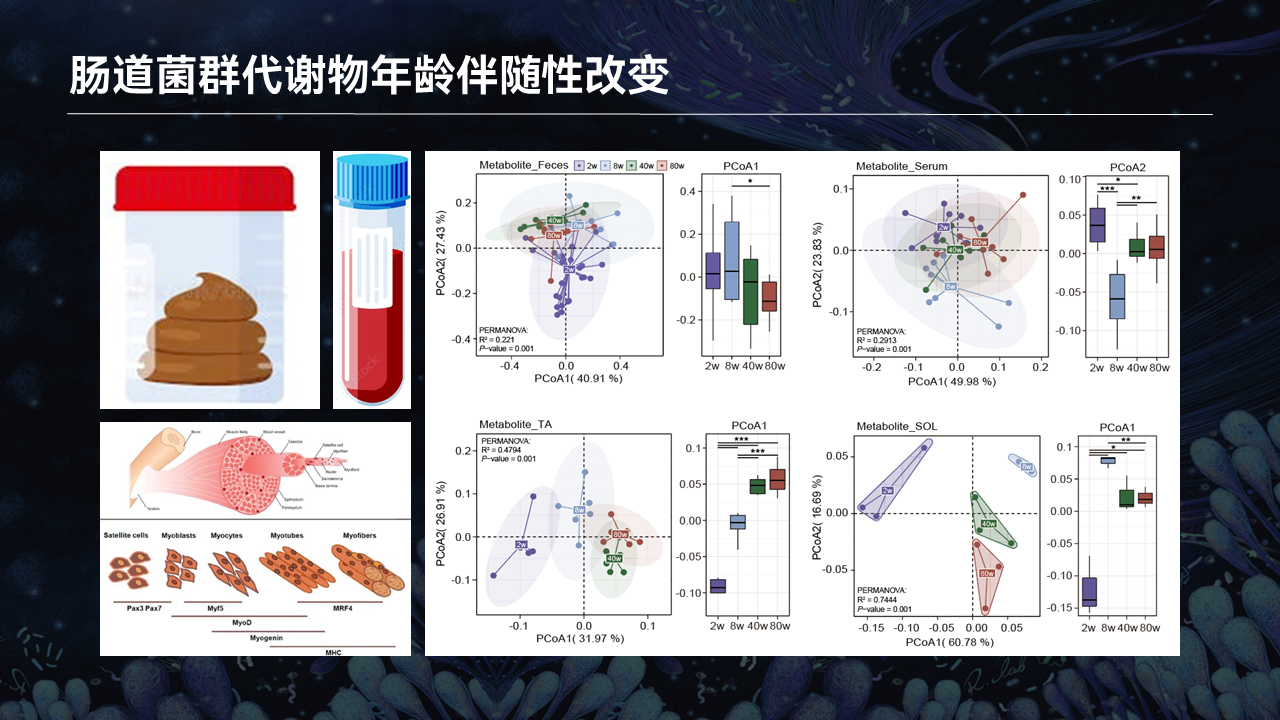
伴随着衰老的过程,肠道菌群的代谢物会发生什么样的变化呢?
我们同时收集了不同年龄段小鼠的粪便、血清,以及反映两种不同肌纤维类型的胫骨前肌和比目鱼肌。通过靶向代谢组学检测,去分析这些肠道菌群代谢物或者肠道菌群跟宿主共代谢的代谢物的变化趋势。
通过降维分析以及结构分析,我们发现,不管是在粪便、血清或者在肌肉中的代谢物,都呈现出与年龄关联性的动态性变化。
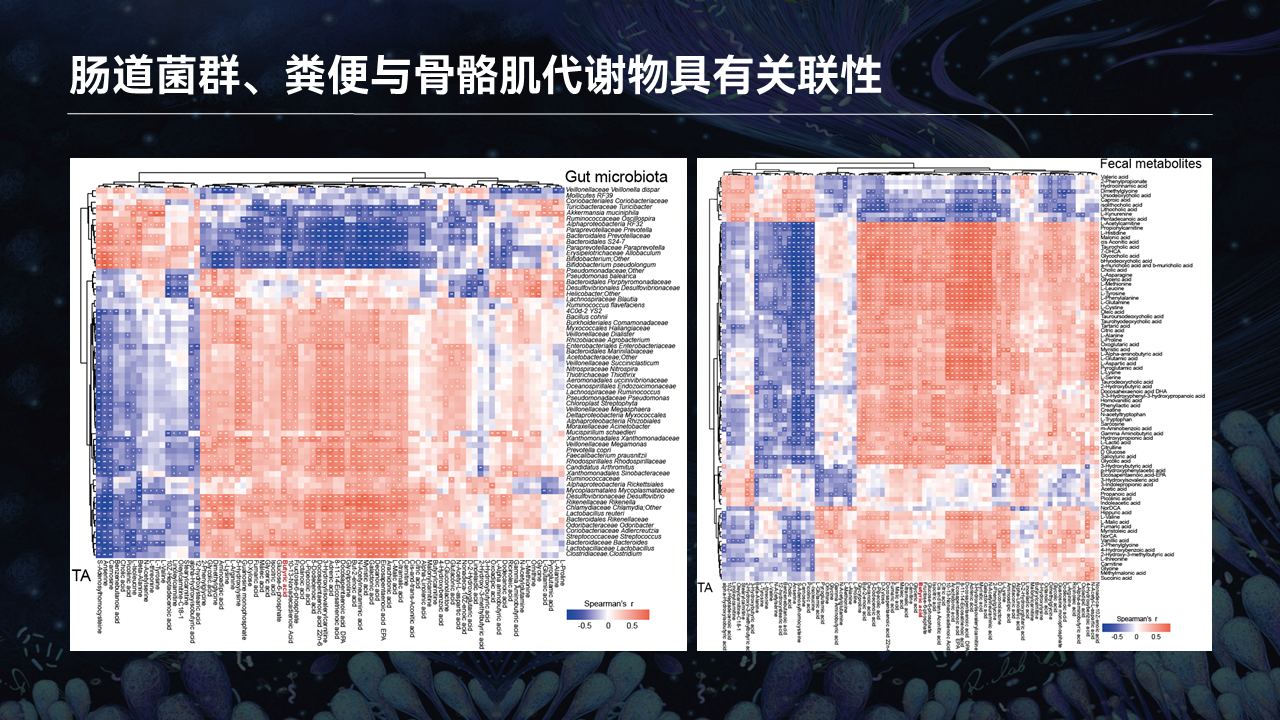
将胫骨前肌中的代谢物跟肠道菌群以及肠道菌群的代谢物进行关联性分析,我们发现了一系列强关联的代谢物,和菌群之间存在一定的正相关和负相关。
为了进一步的分析这些代谢物与肠道菌群之间的关系,我们开展了以下的分析。我们将与胫骨前肌密切相关的肠道菌群和肠道菌群代谢物,功能性地富集到KEGG通路后,发现了103个共有的代谢物。
我们筛选了那些含有至少3个以上代谢物的通路,发现了21个强相关的KEGG通路。将这21种通路又跟胫骨前肌的转录组数据进行联合分析,我们发现了4条共有的KEGG通路。
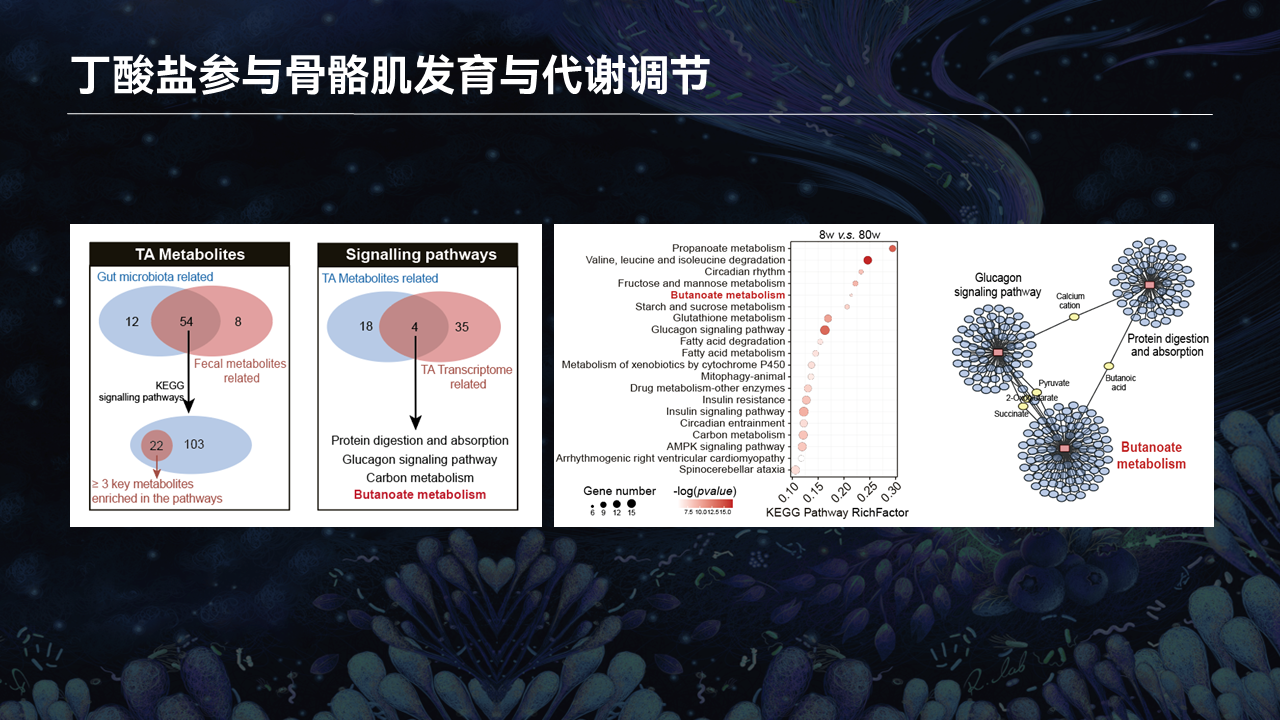
在4条共有的KEGG通路里边,我们发现丁酸的代谢是主要来源于肠道细菌。

接下来我们更加集中关注于,丁酸相关的代谢跟骨骼肌干细胞稳态以及骨骼肌再生之间的关系。
我们进一步检测了不同年龄段小鼠粪便、血清、胫骨前肌和比目鱼肌中丁酸的含量。可以看到,在小鼠40周龄的时候,其实丁酸的含量不管是在粪便、血清,还是在骨骼肌中,都出现了非常显著的降低。在10周龄的时候,成年小鼠血清、粪便以及骨骼肌中的丁酸含量都处于较高的水平。
那也就暗示着在衰老的过程中,尤其是达到40周以上的时候,丁酸的含量会出现陡崖式的降低。
如果在衰老过程中出现了显著的降低,那么是否丁酸参与了骨骼肌干细胞稳态的调节呢?
我们进一步的实验设计了这样的一套模型,就是将丁酸回补回抗生素的饮水中。我们想观察,丁酸的回补是否可以去逆转抗生素诱导的肠道菌群紊乱所诱发的骨骼肌干细胞的活化。
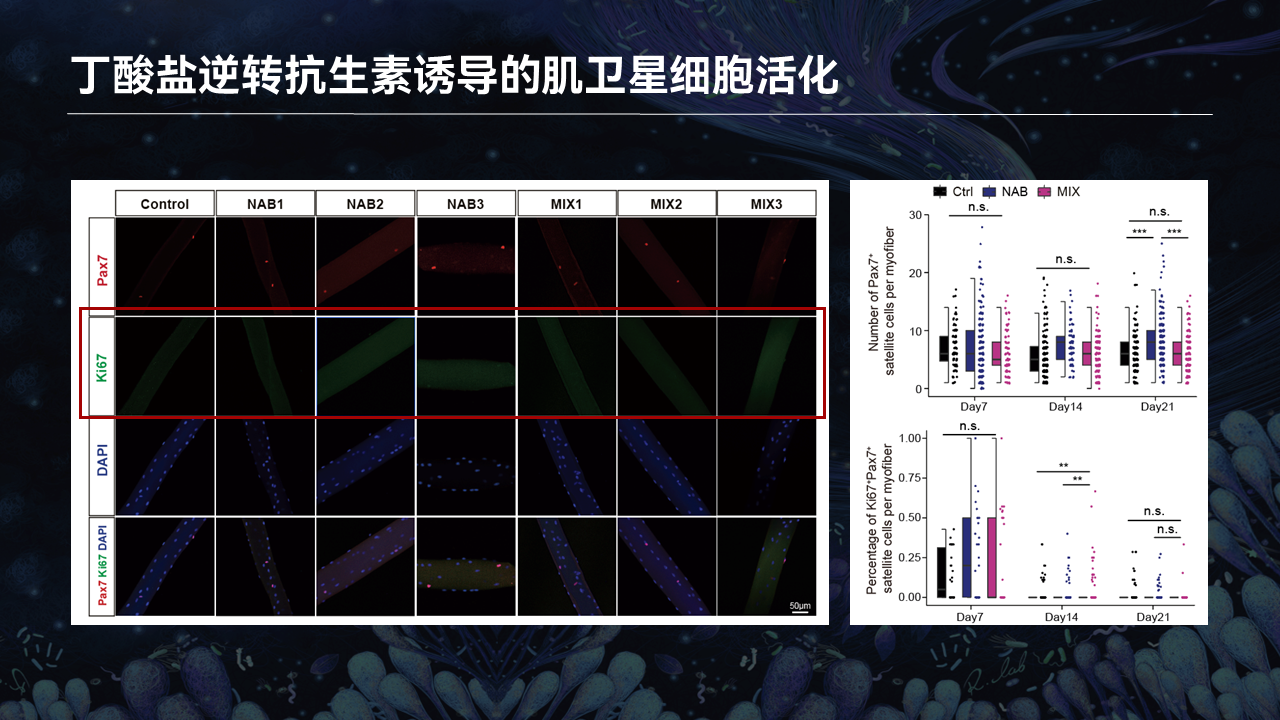
同样我们通过分离小鼠的单根肌纤维,利用Pax7和Ki67染色,去观察丁酸是否会逆转抗生素所诱导的干细胞稳态的失衡。
我们可以看到,在抗生素小鼠Pax7阳性干细胞中所看到的Ki67阳性现象,在丁酸的存在下会得到完全的逆转。也就暗示着,丁酸能够独立于肠道菌群,去抑制骨骼肌干细胞的活化。
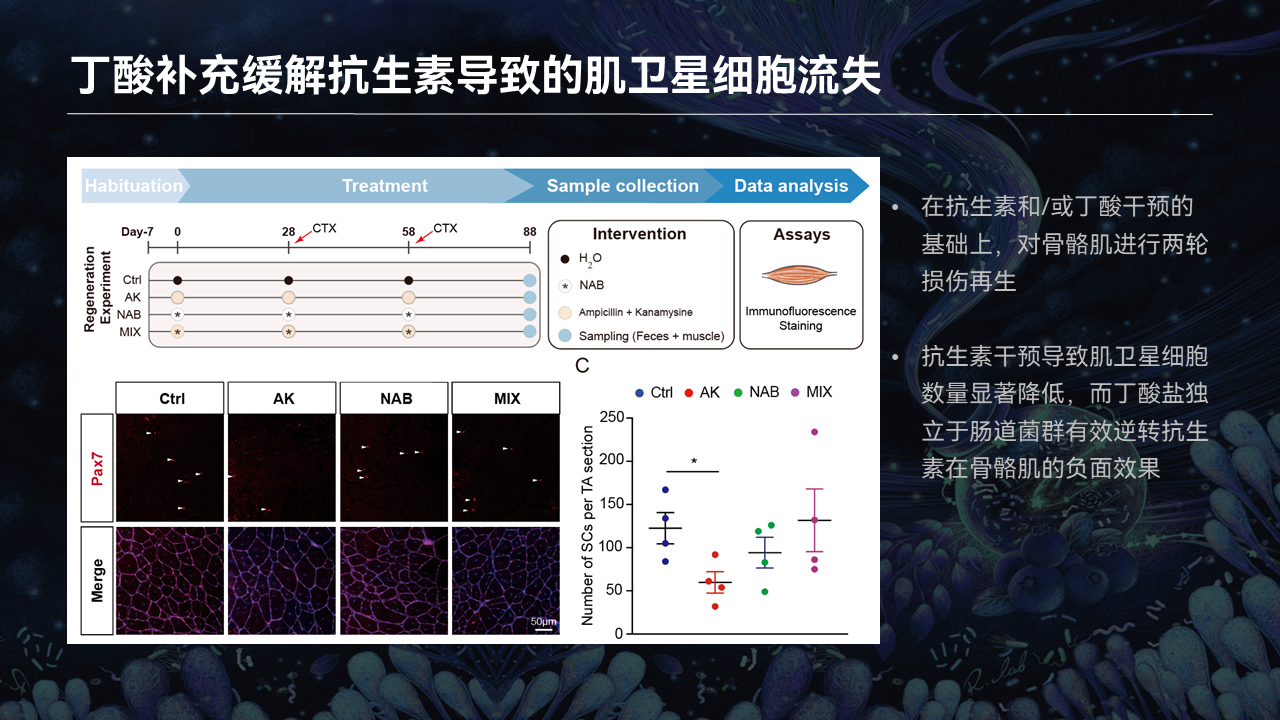
那么问题来了,如果我们将丁酸添加回到抗生素里边,是否能够缓解骨骼肌干细胞增殖、分化,尤其是在损伤再生过程中肠道菌群对于干细胞的影响呢?
我们做了这样的一个实验,我们设置了喝水的对照组、抗生素清除肠道菌群的抗生素组、丁酸组和抗生素加丁酸组。
给予小鼠1周的干预之后,诱导骨骼肌两轮的损伤再生,每轮损伤再生的时间是30天。在60天之后,通过胫骨前肌的冰冻切片,去统计冰冻切片上骨骼肌干细胞的数目。
在这样一套模型里边,我们认为,骨骼肌干细胞的自活化会伴随再生的过程出现流失。可以看到,在抗生素添加的这一组,两轮损伤修复之后,干细胞的数目与对照组相比,降到了对照组的一半水平。抗生素添加丁酸这一组里边,干细胞的数目依然维持跟喝水的对照组一模一样的水平。
这也就暗示,丁酸能够独立于肠道菌群动态性地调节干细胞的功能,尤其是在多轮损伤修复之后,依然能够维持干细胞的稳态,保持其跟正常喝水的对照组处于一样的水平。
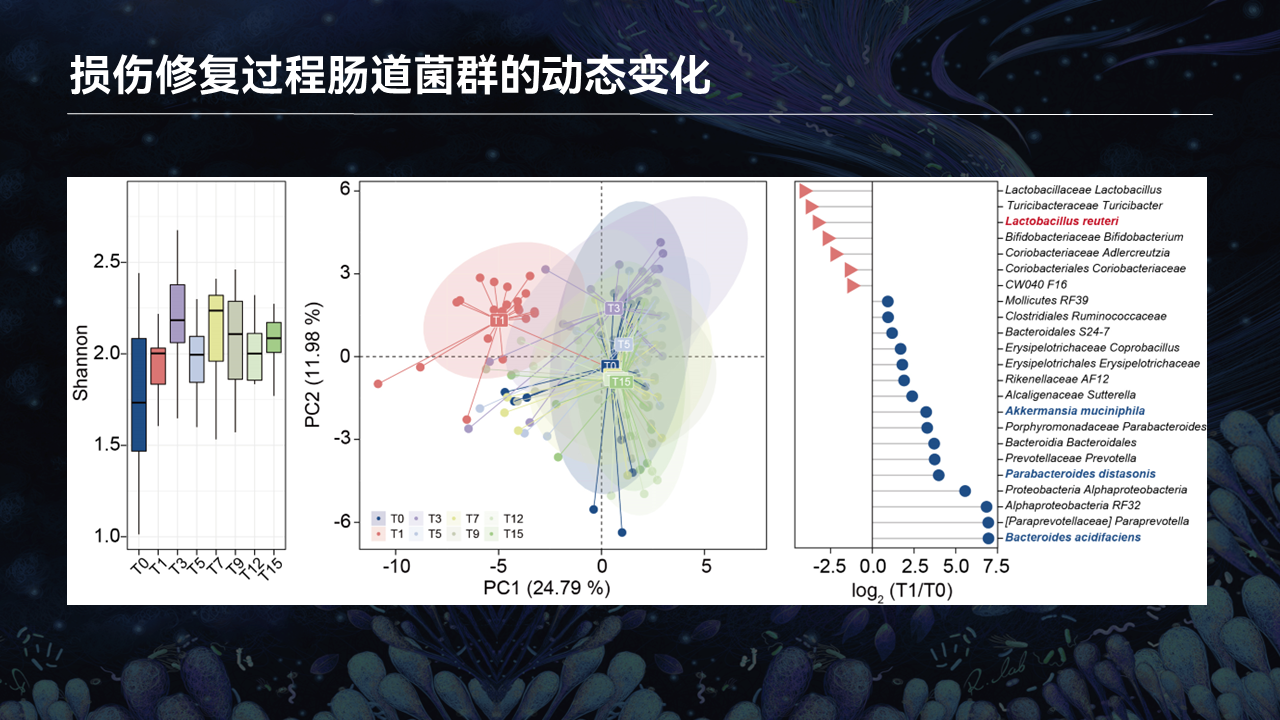
在损伤再生的过程中,肠道菌群、丁酸、产丁酸的这些菌的功能以及肠道菌群的结构、组成、稳态、功能,到底会发生什么样的变化呢?
我们选取了骨骼肌损伤再生的15天的时间周期。我们在不同的时间点,收集了小鼠的粪便、血清、肌肉,分别去检测了菌群的变化以及血清、肌肉的丁酸的变化。
我们可以看到,在整个骨骼肌损伤再生的15天的周期里,它的α多样性并没有发生非常显著的变化。相反在β多样性中,红色圈所代表的T1,也就是损伤24小时之后所收集的粪便16S的数据,它出现了非常显著的偏移。而在之后的损伤再生修复的过程中,肠道菌群会逐渐恢复到正常对照的水平。
我们进一步地去比较了T1和T0之间差异的这些肠道菌群发现,包括罗伊氏乳杆菌、阿克曼菌和狄氏副拟杆菌,都出现了非常动态的变化。也就暗示这些一代或者是二代的益生菌,可能作为骨骼肌损伤再生干预的潜在靶标。
进一步通过PICRUSt去预测了肠道菌群功能的变化,我们可以清楚地看到,丁酸的代谢功能在T1的时间点出现了非常显著的降低,而在后期的损伤修复过程中回到正常的水平。

在骨骼肌中,我们也发现丁酸的含量会出现非常显著的降低。我们认为,骨骼肌本身能够动态性地去调节摄取血清丁酸的含量,为骨骼肌干细胞提供一个优质的环境,进入到增殖以及分化的状态。
由此暗示,丁酸可能跟骨骼肌的损伤再生以及干细胞的增殖和分化存在密切的关系。而在这个过程中,血液的丁酸作为一个大的储存池,连接了肠道、粪便和骨骼肌,而整体丁酸的含量并没有发生显著的变化。

是否我们如果将丁酸回补之后,能够显著抑制骨骼肌增殖和分化呢?
我们选用了成肌纤维的C2C12模型、单根肌纤维的培养模型以及在体的原位注射丁酸的模型,去观察丁酸回补对干细胞增殖、分化以及骨骼肌再生的影响。
在C2C12成肌纤维细胞模型里边,我们观察到丁酸能够显著地去抑制C2C12成肌纤维细胞的增殖和分化。相反,其他的短链脂肪酸像乙酸和丁酸,对于C2C12成肌纤维细胞的增殖、分化并没有起到显著的影响。
在单根肌纤维培养的模型里边,我们通过去观察干细胞形成的簇(cluster)的大小、数目以及Pax7、MyoD的表达情况。整体丁酸的添加是会抑制干细胞的增殖,干细胞簇的大小是显著小于对照组。同时,簇里边表达Pax7、MyoD阳性细胞的数目也是显著低于对照组。
此外在骨骼肌再生的模型里边,给予胫骨前肌在损伤之后1剂丁酸的原位注射,我们可以看到eMyHC阳性的新生成肌管的速度,在丁酸原位注射的这一组里边是显著低于对照组。
这暗示骨骼肌在损伤再生的过程中,会动态性地调节骨骼肌内丁酸的含量,让干细胞有一个低丁酸的含量,进入到高增殖和分化的状态。这也提示,丁酸会参与到骨骼肌干细胞稳态的调节。
结论:丁酸参与骨骼肌干细胞稳态调节
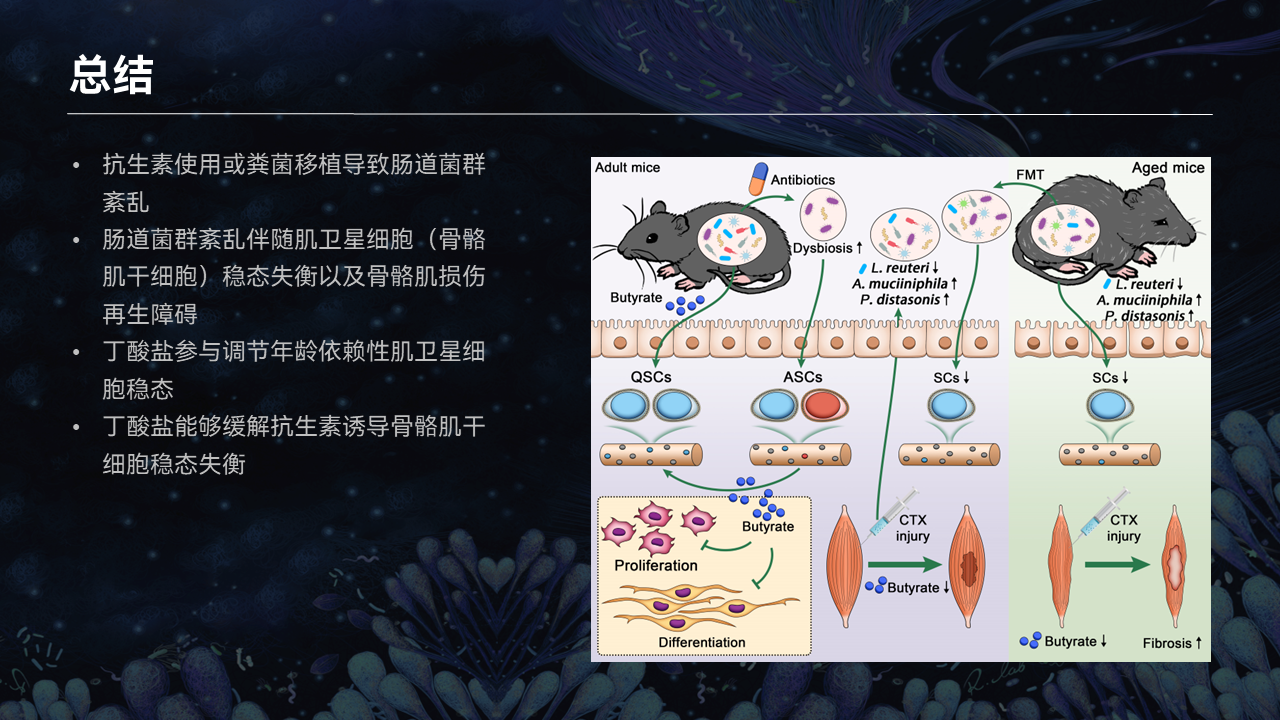
让我用这张图文摘要来总结一下今天报告的内容。
在衰老的过程中,肠道菌群以及肠道菌群所产生的代谢物都会发生动态的变化。在这个过程中,我们发现了一系列可能参与到骨骼肌干细胞稳态、骨骼肌再生过程的一代和二代的益生菌,包括罗伊氏乳杆菌、阿克曼菌等。
在这个过程中,我们发现肠道菌群,尤其是益生微生物所产生的丁酸,可能是比较关键的代谢物。它会进入到血液循环,进入到骨骼肌,参与到骨骼肌干细胞稳态的调节。
相反在衰老的过程中,由于肠道菌群稳态的失衡,丁酸含量的降低会导致骨骼肌干细胞在这个过程中出现自活化,进而出现干细胞耗竭。我们通过丁酸回补的模型进一步地证实,丁酸能够降低干细胞的自活化,以及由于衰老或疾病所导致的干细胞耗竭的过程。

我要感谢陈淑洁博士参与以及领导这个课题,同时要感谢黄柳菁和刘秉东博士参与到整体肠道菌群数据的分析,也要感谢我们团队对于课题的大力支持。
我还要感谢广东省科学院、广东省科学院微生物研究所启动基金的支持,以及广东省科技厅杰出青年基金和国家自然基金的支持。
最后感谢大家的聆听,谢谢!


