
大家好,我是来自中国科学院深圳先进技术研究院合成微生物组研究中心的戴磊研究员。今天很高兴来到我们的《肠·道》演讲,和大家分享我关于微生物组工程方面的一些心得。
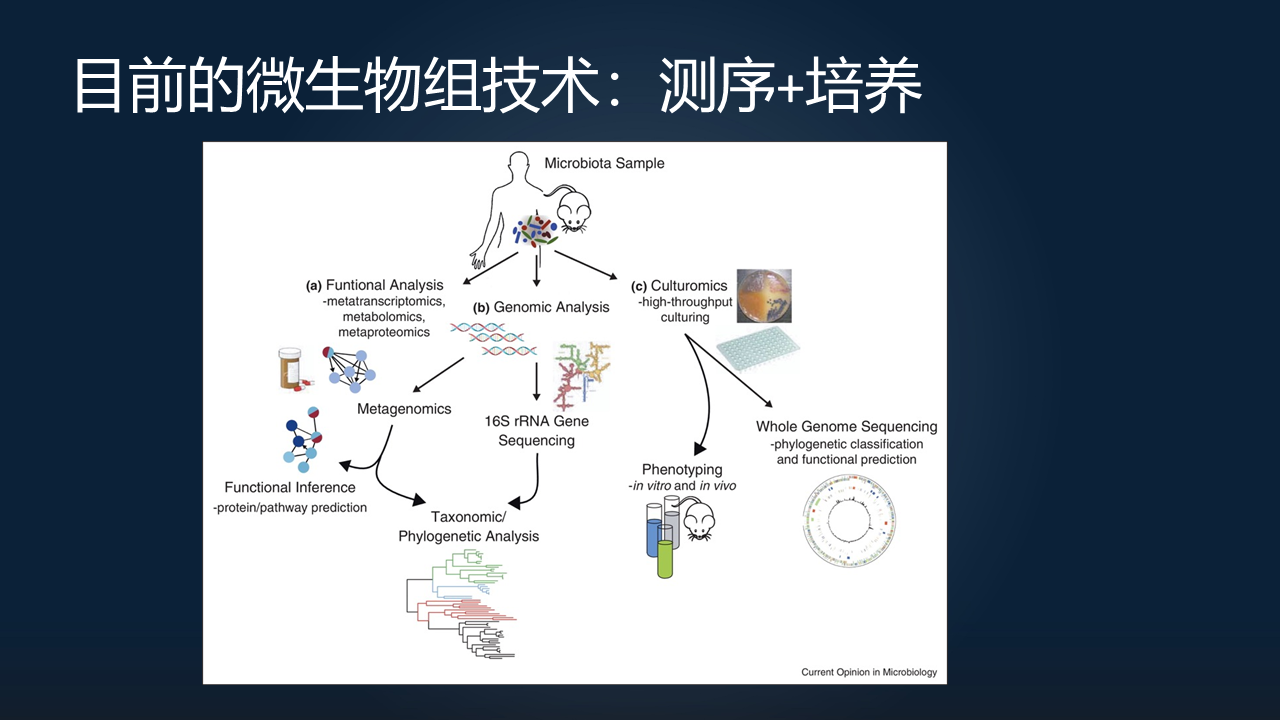
我们知道,目前的微生物组技术主要是分为测序和培养这两条不同的技术路线。
拿我们非常熟悉的肠道微生物的研究为例的话,当我们从人体或者动物上面取得了样本之后,我们可以提取其中的微生物的 DNA,进行宏基因组或者扩增子的测序,来分析得到其中的物种和基因的组成。
另外,最近几年,也是非常火的一个方向就是高通量的培养组学。在实验室当中,现在有越来越多的原来我们认为难以培养的肠道微生物物种,被我们分离培养得到,可以进行全基因组测序和各种各样的表型研究,这也大大推动了我们对于肠道微生物组的功能的认识。
今天我想和大家分享的是下一代的微生物组技术。
在进入我们的主题之前,我想先和大家聊一聊基因组工程。
为什么聊基因组工程呢?因为我觉得在过去的半个世纪,随着 DNA 双螺旋结构的发现以及 DNA 作为遗传物质的中心法则的确立,我们对于基因组的研究已经进入到了一个非常深入的层次上面。
基因组的精准解析技术和靶向改造技术,以及现在最前沿的合成基因组技术,给我们带来了许多新的启示,也打开了许多实际应用的大门。

那么基因组的精准解析是指什么呢?
如果我们把基因组上的 ATGC 比作一本书的话,那么一种一维的想法就是,我把这本书从头到尾读一遍我不就理解了吗?
但其实并没有这么简单。我们现在发现,基因组当中可能有很多区域是不编码蛋白质的,它有很多区域可能是不在特定的环境下、条件下表达的。那么读这本书,从头读到尾,本身就不是那么容易的一件事。
第二,我们再进入一个层次。随着 2000 年左右我们人体基因组的整个测序的结束,很多人认为,我们是不是能够破解人体基因组的这本密码天书了?其实并没有这么容易。因为我们发现,许多基因之间存在着非常复杂的互作关系。
以这个网络图为例,我们可以想象,其中有一些基因,它就好像一个 hub(枢纽)一样,可能同时调控许多其他基因的表达。那么这样的网络,通过系统生物学研究发现,它是一种 scale-free 的网络,就是其中有一些节点是非常核心的,它可能跟大量的其他的基因相连接、相调控。那么这样的系统生物学视角让我们从另外一个维度理解了,基因组其实并不是一个一维的字符串,而是由许多相互作用的元件组成的。
再深入一些,如果我们从物理的 3D 结构来思考基因组的话,我们会发现,其实基因组有非常复杂的结构,上面有很多蛋白质来调控整个基因组的结构。那么蛋白质就决定了基因组哪些地方可能是沉默的,哪些地方是表达的。通过了解染色体的这样一个 3D 的结构,我们对于整个基因组的表达有了更加深入的认识。那么这也是伴随着我们精准解析的技术不断地发展。
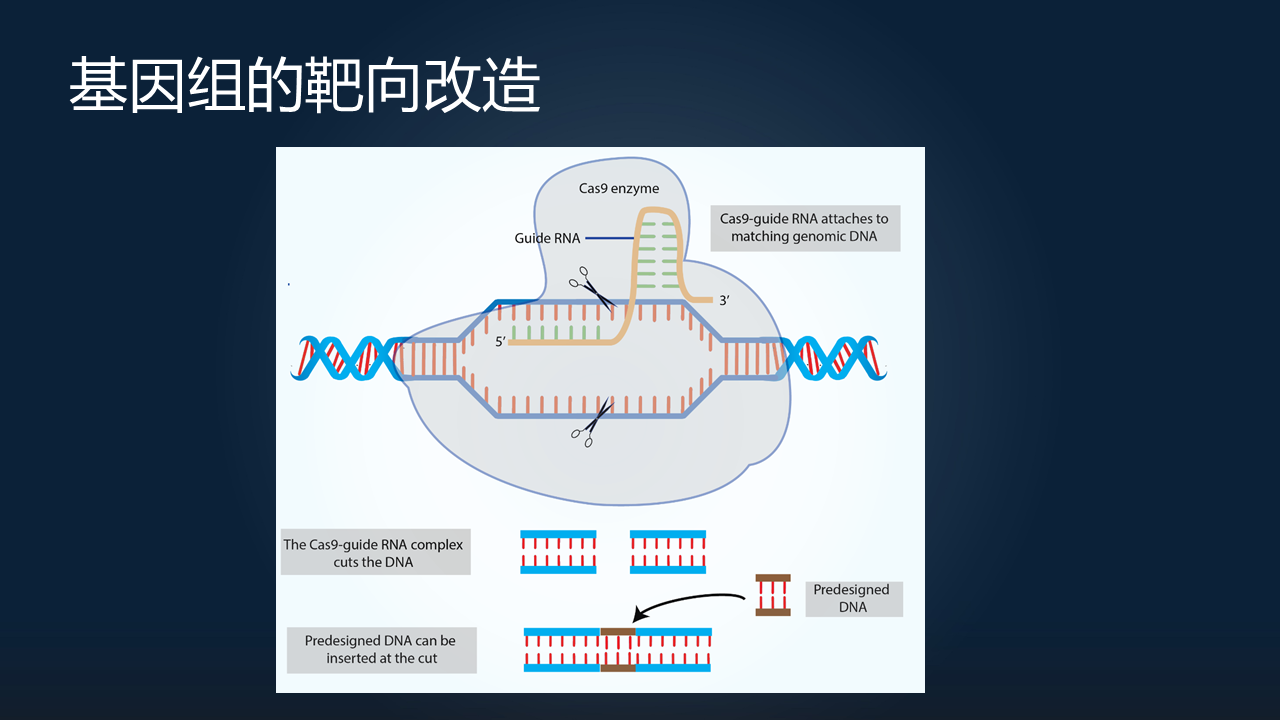
另外一个就是,我们除了能够去读基因组之外,很多时候我们需要去改它。为什么呢?很多时候,我们并不知道一个基因是如何发挥它的功能的。
今年(2020 年)得了诺奖的 CRISPR 技术,我想大家都不是很陌生了。它是一种以 RNA 为介导的、对基因组进行精准编辑的技术。通过对基因进行精准地敲除、插入,我们可以非常深入地研究特定基因的功能对于生物体表型的影响。

另外一个最前沿的领域,就是合成基因组技术。从最早的 Craig Venter 开始,从头合成一个细菌的基因组,到 2017 年,以中国科学家在内的一个国际大科学计划,完成了酵母的合成基因组,我们对基因组的从头设计与合成的能力也在不断提高。
其中合成基因组——像酵母,我们现在知道,可以把它的 16 条染色体变成一条染色体。我们在合成的过程当中,也颠覆了许多我们原来对于基因组的认识。

所以,这就引出了我今天想要聊的这个话题,就是微生物组的解析和调控的新技术。

仿照刚才基因组工程的这三个方向,我把微生物组工程归结为微生物组的精准解析、靶向改造与合成微生物组。
我们都知道,人体微生物组被称为“第二基因组”。人体有 2 万多个基因。在我们身上生活的微生物的细胞数量大约与我们自身的细胞数相当,它的基因数量大约是我们的 100 倍以上。
对于这样一个非常复杂的宏基因组,我们怎么样能够用基因组工程的思路,来对它进行解析、改造以及从头合成呢?

首先,我想说一说微生物组目前研究的套路。这是一个我相信许多在我们领域内并不陌生的技术路线。
也就是说,当我们拿到了一个粪便样本之后,我们可以提取其中的 DNA,然后进行二代或者三代测序,然后通过生物信息学的方法来得到其中的物种、基因通路的分布。然后,我们通过和人体的表型、大数据的比较,我们可以找到,其中到底哪一些微生物的物种可能与疾病相关,甚至开发出来具有可预测性的模型。
那么在过去的十几年当中,这样的研究越来越深入,也积累了大量的数据,为我们理解微生物与人体健康打下了非常好的基础。
但是,相信大家也听过一句话,叫做“肠道菌群,机制不明”。那么在未来的下一个阶段的微生物组研究当中,我想我们不得不去思考,我们如何用精准解析的方法,来真正地发现微生物组与宿主互作的一些机制以及一些新的现象。
这里我想大家要思考的是,微生物组与时间、与空间以及与它的分辨率这几个未知的问题。
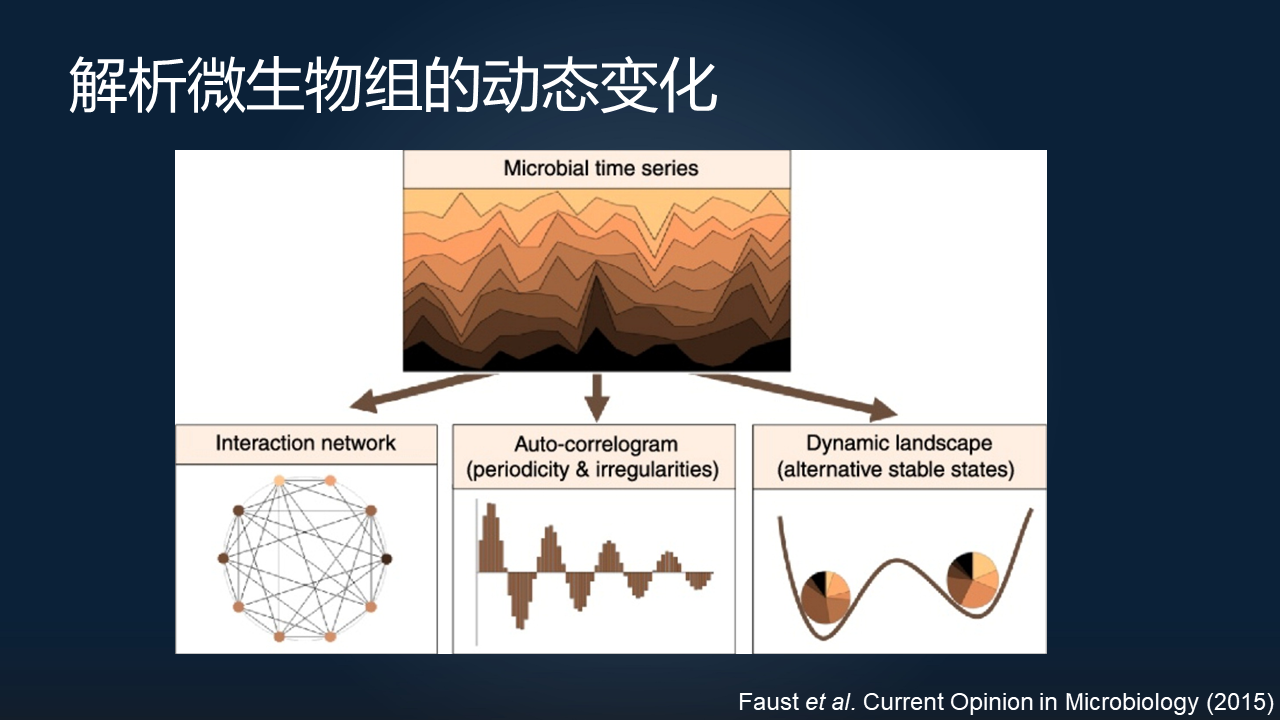
这里我想先聊聊关于微生物组的动态变化。
这一块我想其实在最近几年,有越来越多的研究开始关注这个问题。就是我们很多的研究都是一个横断面式的,研究了很多不同人的微生物组,但是我们也要关注同一个个体随着时间的微生物组的变化。
比如说,我们通过时序上面微生物物种组成的一个改变,可以很好地帮助我们去推断其中一些关键的微生物之间的一些互作关系。
其次,通过对时序数据的分析,我们可以发现一些静态的数据没有办法发现的一些现象。
比如说,微生物组在一个短时间的尺度上可能存在一些昼夜的节律,包括它的一个在稳态附近的波动与恢复;在长的时间尺度上,在我们的生长发育以及衰老的过程当中,微生物组也是一个动态变化的过程。理解动态变化的过程,以及理解为什么微生物在这样一个过程当中存在不同的稳态,我想这是一个非常核心的问题。

另外一个,我想除了测序之外,其实大家经常会说“所见即所得”。那么测序,它的一个明显的优势就是非常高通量,但它的弊端就是它把样本中间的一些异质性给抹去了。
我们现在知道,在不同的生态环境下,其实环境是存在大量的异质性的。比如说,在我们的肠道的不同区域就有不同的生化、生理以及宿主的不同的微环境。那么通过成像的方式,我们可以最直接地看到微生物组在一个微米尺度上面的分布。
这里给大家展示的两个,是在肠道和人体口腔中的样本的微生物组的成像技术。目前的技术可以使我们看到数种到十几种这样的不同的微生物在原位的一个分布。
我们也期待在未来的研究当中,不断的技术的迭代,通过荧光杂交等等不同的技术,让我们能够非常完整和准确地看到微生物群落在原位的一个分布。
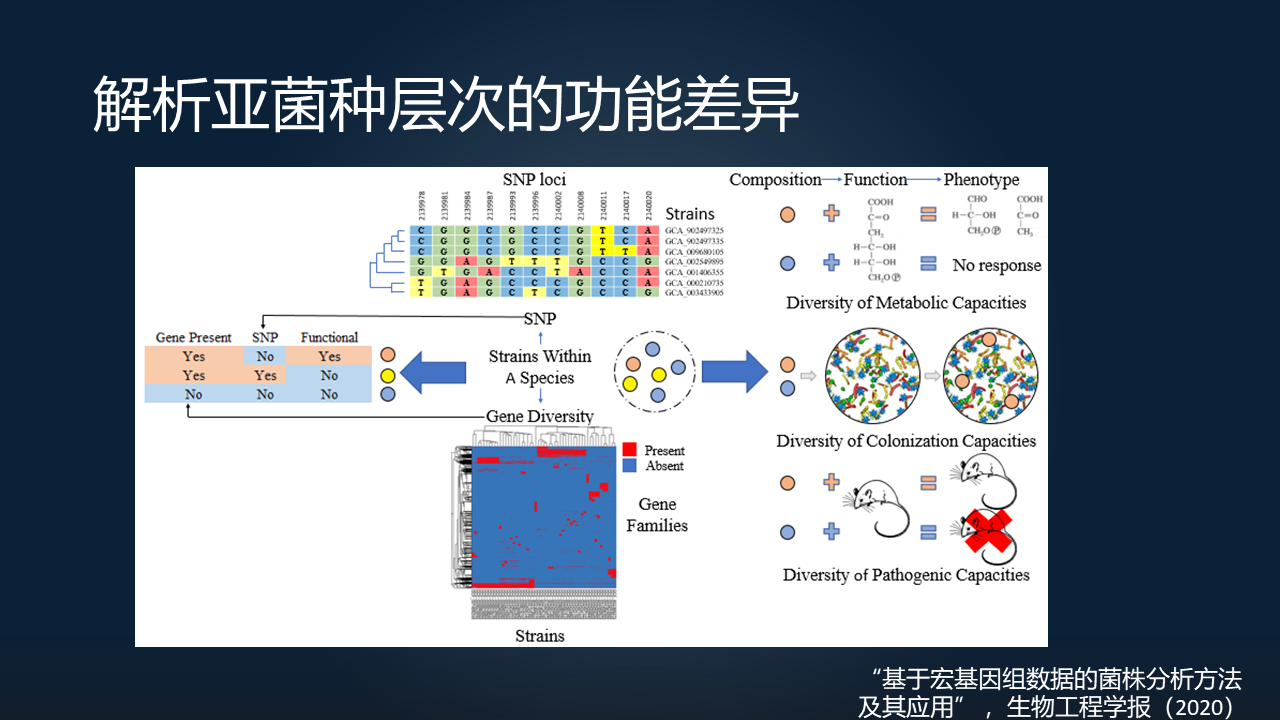
另外一个也是大家非常关注的一个领域,就是解析微生物组在亚菌种层次上的一个功能差异。
现在,随着培养组技术的不断发展,我们发现许多菌虽然是同一个种,但是可能有完全不一样的功能。
就以我们大家经常谈论的大肠杆菌为例的话,在实验室当中大家把它当作一个模式生物来研究,它的底盘菌株是完全无害的。但是也有一些大肠杆菌会造成腹泻,还有一些大肠杆菌有特定的毒力因子,会引发大肠癌。那么这些不同的菌株之间有什么区别呢?
在我们今年(2020 年)发表的一个综述上面,我们就详细地阐述了不同菌株之间的功能差异,以及我们目前可以研究的一些方法。
一类它们的差异是在基因层次上的,也就是说一些菌株有一些别的菌没有的基因;另外一类是在单碱基突变 SNP 上的差异。这些不同的差异都会引起这些菌株不同的表型,比如说它的代谢能力、它在宿主体内的定植能力以及它的致病性。
在亚菌种层次上更深入地研究,相信会对于未来将微生物组与人体健康的因果关系研究,是能够更加推进一步的。
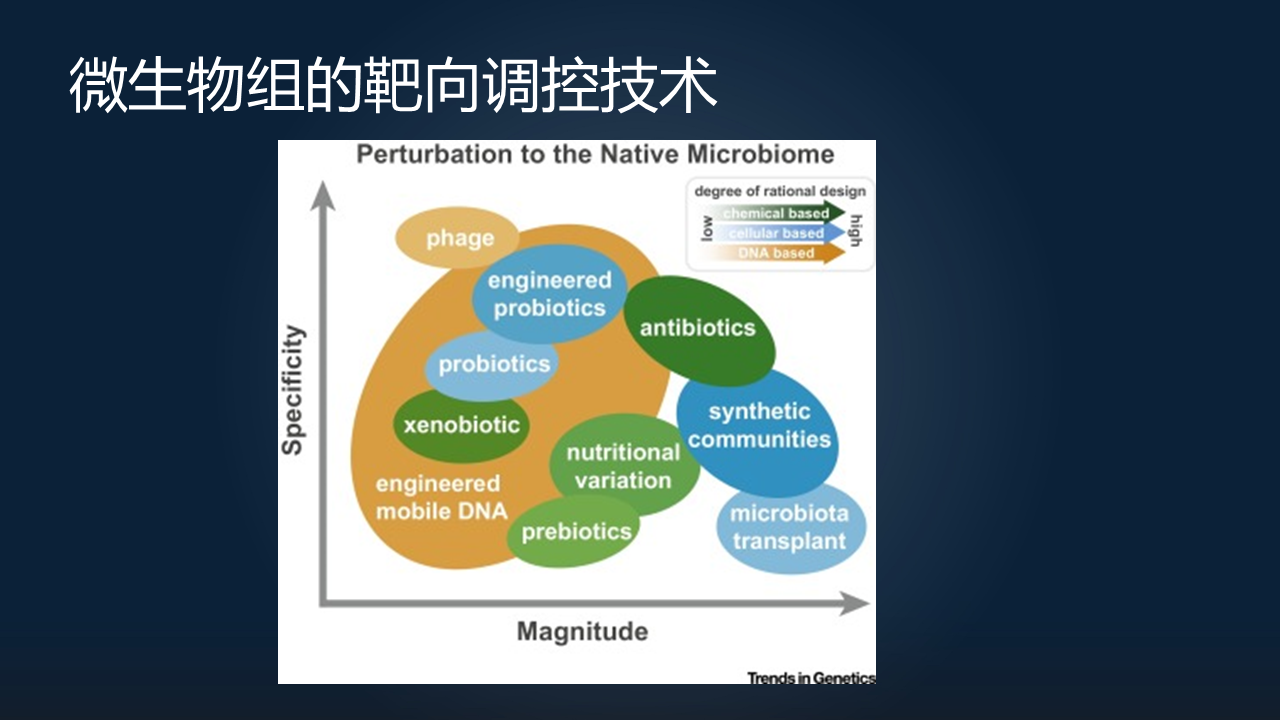
第二部分,我想跟大家分享一下微生物组的靶向调控技术。
这里我用的是美国哥伦比亚大学 Harris Wang 教授的一个综述。他也是在微生物组工程领域的一个先驱了。这里他用了两个不同的维度,来描述我们对于微生物组的调控或者说扰动。
在一个轴上,我们考虑的是扰动的大小;但另外一个轴上,我们考虑的是扰动的特异性。大家可以看到,越往上的这几个,也就是说它的靶向性是越强的。
这里面我就想跟大家重点分享一下其中几个:一个是 phage,噬菌体;另外一个是 engineered probiotics,就是工程化的益生菌;最后一个叫 engineered mobile DNA,就是一种我们称之为原位调控编辑的一种技术。当然它们通过调控的方式也是不一样的,有通过化学的,有通过细胞的,也有通过 DNA 的直接调控。
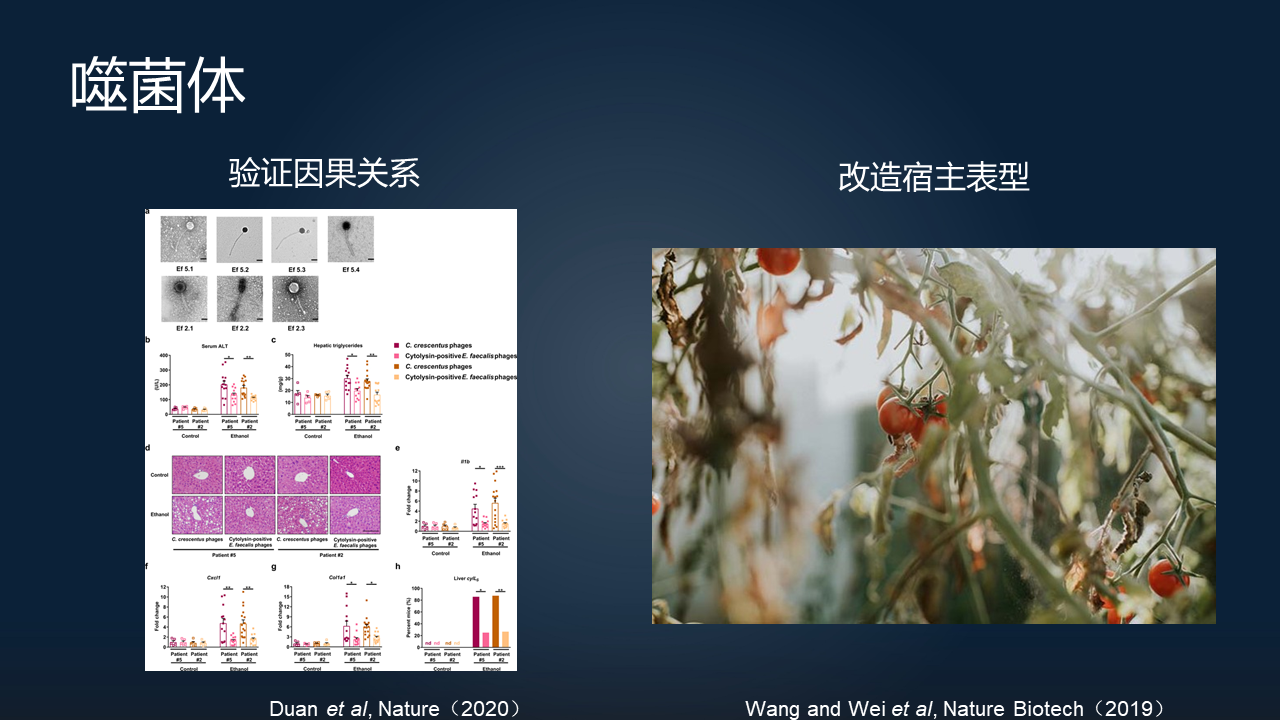
首先聊聊噬菌体。
相信很多关注肠道的朋友也对噬菌体不陌生了,噬菌体其实是针对细菌的病毒,它也是细菌的天敌。在肠道中,噬菌体也扮演着非常重要的一个角色。
那么基于噬菌体的这样一种靶向调控可以达到一个什么样的效果呢?
在左边的,就是 2019 年发表在 Nature 上的段屹博士的一个工作。他们通过分离了肠道中粪肠球菌的特异性的噬菌体,来研究这个菌和酒精性肝炎之间的一个关系。
他们发现,这个菌所带有的 cytolysin(溶细胞素)是和肝炎有直接的关系的。通过利用这样具有非常强的宿主特异性的噬菌体,来靶向地清除病原菌,可以直接地去验证病原菌和酒精性肝炎之间的一个因果关系。
我想这也是我们在肠道研究中必不可缺的一个利器。通过这样“做减法”的一种方式,可以让我们真正地了解,哪一些菌可能是跟疾病有直接的因果关系的。
另外一个就是在改造宿主表型方面。南京农业大学的团队发现,利用靶向于番茄青枯病病原菌的噬菌体,可以非常好地去调控整个植物微生物的群落,靶向地清除了病原菌,让植物也恢复了健康。
未来我想这样的技术会越来越多地应用到人体以及农业的微生物组的调控当中。
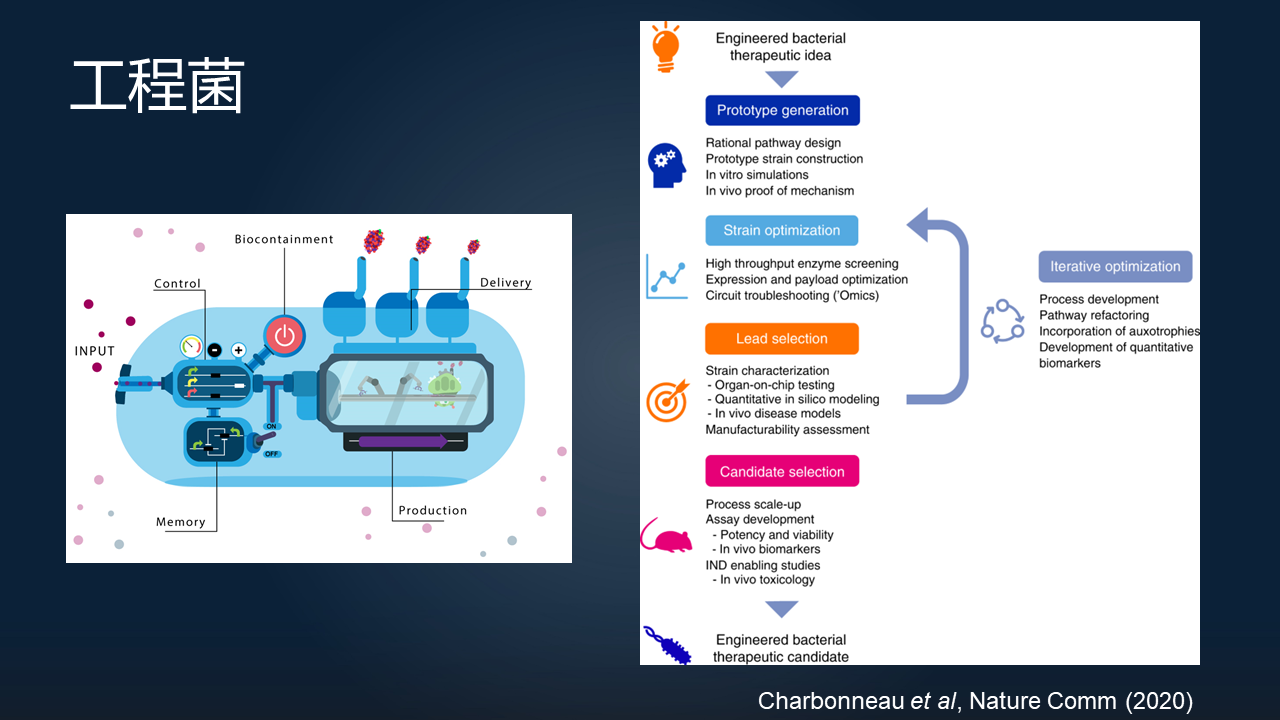
另一类呢,就是刚才提到的工程化的益生菌。
工程菌是什么呢?我们可以在细菌当中引入特定的基因线路,来实现细菌的一种非常精确的基因表达。
比如在肠道当中,我们可以定植一些益生菌,它们可以通过感应到特定的病原菌的存在,或者肠道的发炎或者出血,在特定的环境下诱导益生菌来表达一些蛋白,来杀掉我们的病原菌,或者是降低宿主的炎症和出血。
这一类的技术在美国也已经被推上了临床,作为工程菌的这样一个开发的管线,目前已经应用于多种疾病的治疗。
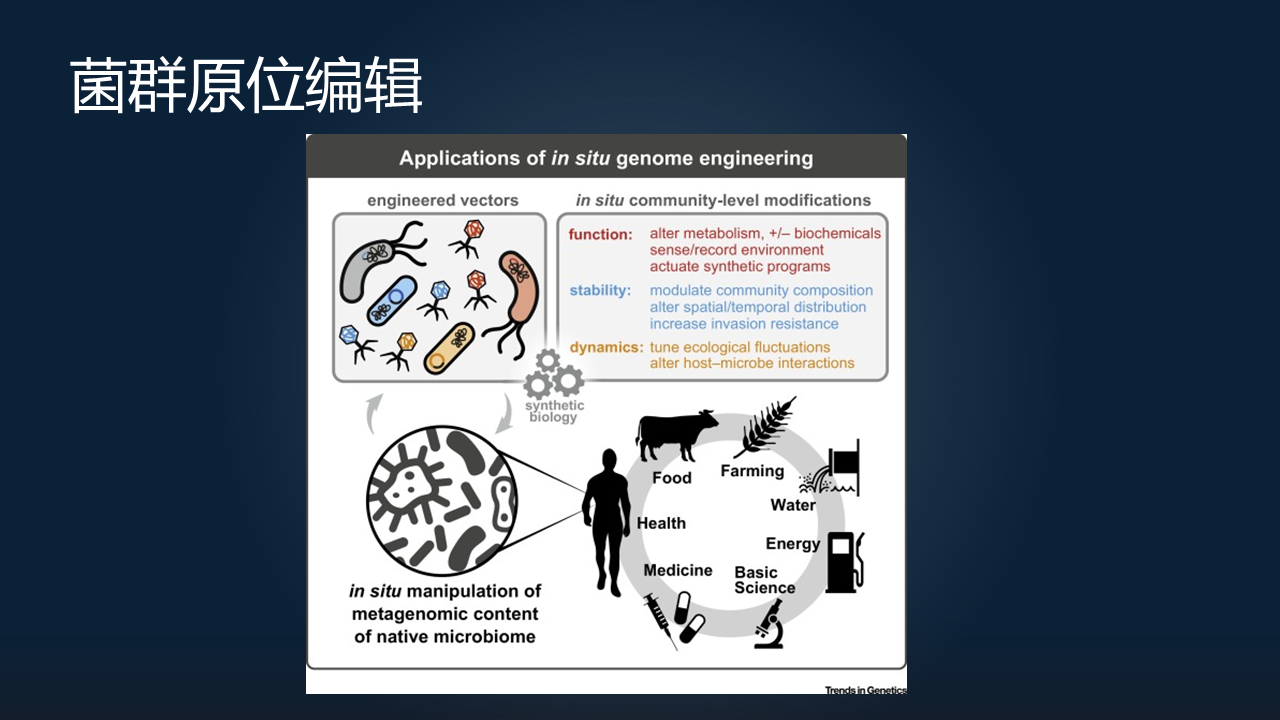
说完了我们的噬菌体“做减法”,以及工程菌这样一种“做加法”的方式,那么我们就想,我们是不是未来真的能够对微生物组这样一个非常复杂的生态环境做任意的加减法?那这个就太厉害了。
其实这个想法并不是天方夜谭。这种被称之为 in situ genome engineering 的一种方法,就是通过将外源的 mobile DNA 引入到微生物群落当中,来实现对菌群的原位编辑。基于现在已经有的类似于 CRISPR 等等这样的系统,我们可以把这些基因特定地插入到一些微生物当中,或者对一些微生物进行靶向地清除。
我相信,这样的一个原位编辑的技术,在未来是非常有可能颠覆我们对于微生物组的操控能力的。

最后一部分就是关于合成微生物组了。
其实刚才说了,合成基因组领域也是一个非常前沿、非常挑战的一个东西。我们除了对微生物组进行它的表征和调控之外,我们未来是不是有可能真的去从头合成一个复杂的微生物群落?我想这个是我们非常值得探索的一个前沿的领域。
这里我把它称为“建物致知”。我们经常说“格物致知”,对吧。那么有一个非常著名的物理学家费曼,他就说:“如果你不能够创造一样东西,那么就说明你还不够了解它”。
我想对于微生物组也是同样的。我们有没有可能在实验室、在比较简单的环境当中,真正地去构建一些合成的微生物群落?那么这个答案是肯定的。
这样的合成的微生物群落,通过研究它,可以让我们更好地去理解自然生态的微生物群落是怎么样运作、怎么样执行它们的功能的。它在数学模型的这种可控性和自然生态系统的复杂度之间,找到了一个非常好的平衡。其实,这样的研究方法,和系统生物学在过去 20 年当中所运用的方法和思路,是非常相似的。
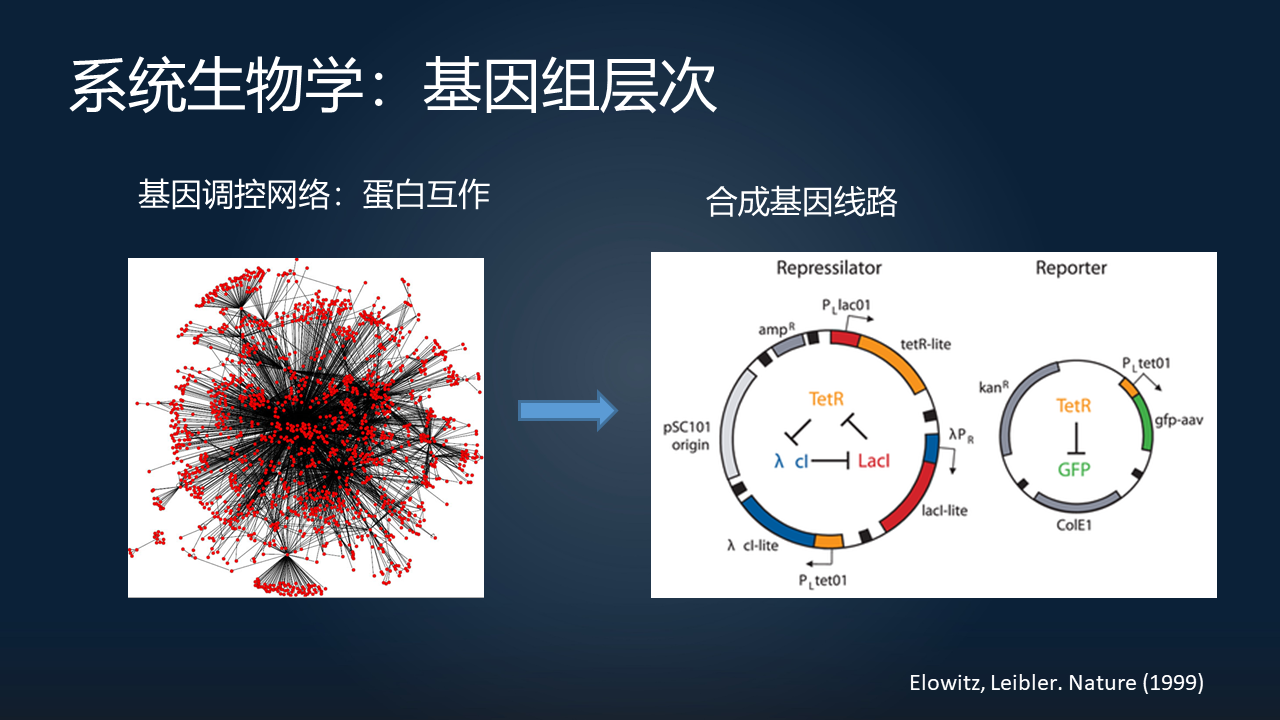
刚才提到了基因组测序完成之后,我们发现,其实有大量的基因之间存在互作,这样一个复杂的网络怎么去研究?
在 20 年前左右,当时合成生物学的一个开山之作,就是用了合成的基因线路。通过对于两个蛋白之间的互作形成的基因开关,或者三个蛋白之间的互作形成的一些震荡器,我们发现,其实用一些简单的基因线路和数学语言,我们是可以很好地去理解一个复杂网络中存在的一些 motif(网络模块)的。
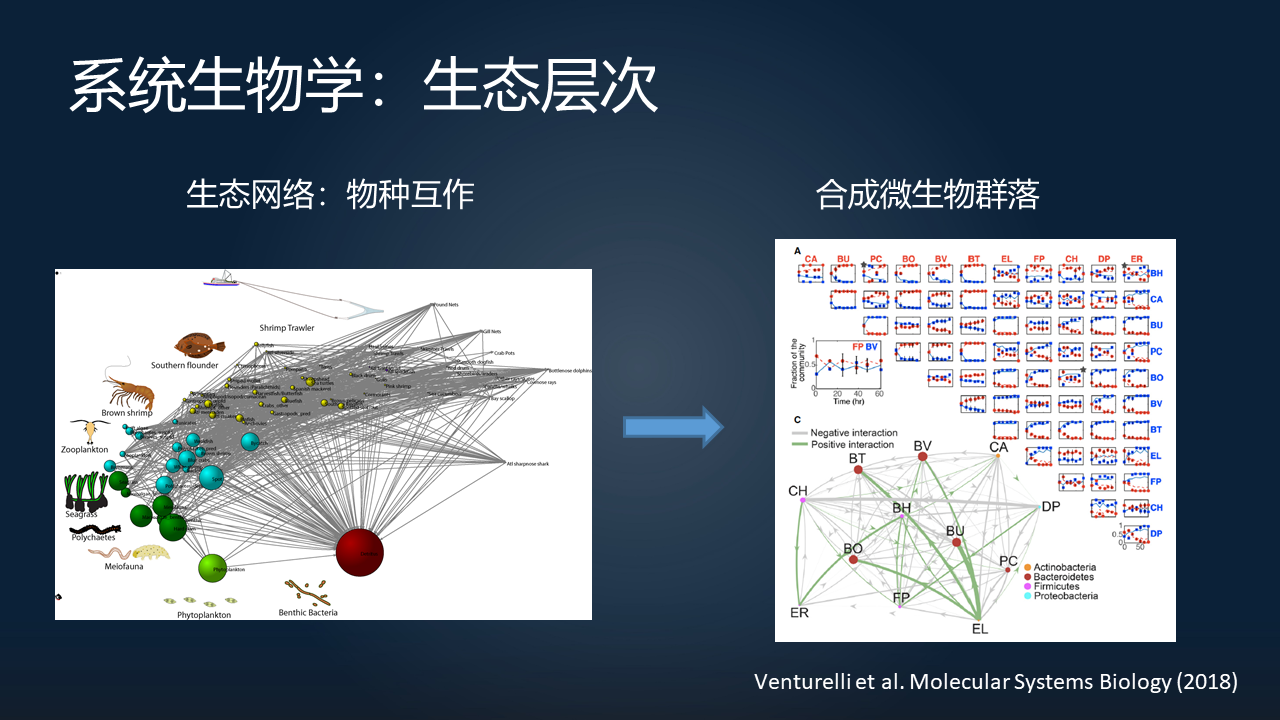
那么在生态的层次上,在微生物生态的领域当中,我们有没有可能用系统生物学的这种自下而上的角度去理解微生物组?
在左边这个,大家可以看到的是一个非常复杂的物种互作的食物链的网络。右边这个,是一个在 12 种不同的肠道微生物物种当中组成的合成微生物群落的网络。这里面的边就代表着不同物种之间的一个互作。
通过在实验室当中构建出来这样的互作的网络,我们可以找到其中哪一些物种可能是起到关键作用的,我们有没有可能通过数学模型来真正的去指导我们对于微生物群落的调控。
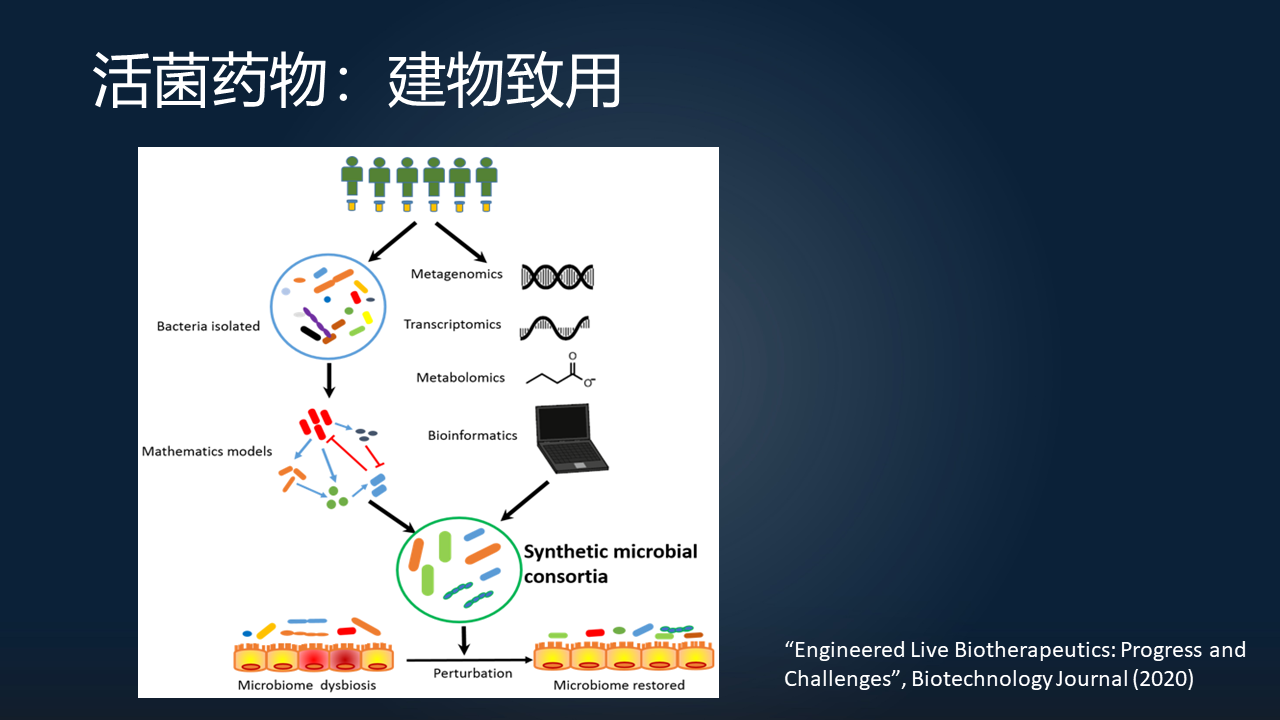
最后,在合成微生物群落方面,除了在科学研究方面或“致知”方面,其实也有许多的研究,包括公司,在开展“建物致用”方面的研究。
这里是我们今年(2020 年)在 Biotechnology Journal 上面,用一个综述来总结了一下,合成微生物群落运用于活菌制药领域的一些进展。
从人体的肠道当中分离出来的不同的物种,通过它们的多组学的功能的研究和它们生态网络的一个研究,可以指导我们去合成一些肠道的微生物群落,包括生态意义上的合成以及在基因组层次上的改造,来最终用于疾病的治疗。
其实在包括炎症性肠病、艰难梭菌感染以及增强肿瘤免疫治疗等等领域,目前合成微生物群落的进展是非常迅速的。
今天跟大家分享的关于微生物组工程的一些感想,那么其实我想微生物组工程的目标是为了开发我们微生物组研究的关键共性技术。
我相信,在未来的 10 年、20 年,会有越来越多的关于微生物组的精准解析、靶向调控以及合成微生物组的技术,不断地从实验室走向应用,让我们真正地能够实现对于微生物组的一个精准的靶向调控和理解,开启我们对于微生物组研究的下一个黄金的 10 年。

最后,我想感谢在深圳先进技术研究院戴磊实验室的所有成员。非常期待大家能够关注我们的微生物组工程方面的研究,欢迎与我联系。谢谢大家!



