本视频是第九期《肠·道》演讲 G30 企业专场演讲之一,录制于 2019 年 12 月 08 日,我们荣幸邀请到了广州承葛生物科技有限公司董事长肖传兴先生做了关于粪菌移植的精彩分享。近期我们特别安排了演讲视频和图文实录,以飨读者。

大家好,我是承葛生物的肖传兴。在这之前,我是一名消化科的医生,现在辞职,全职去做、全身心地去做菌群移植这一个事情。
我们团队在 2013 年的时候就已经开始做菌群移植的临床应用和临床研究,作为中国第一批开始从事菌群移植的团队,经过这六七年的一个探索,结合我们自己的一些心得,今天就跟大家一起来分享一下中国菌群移植产业的进程。

菌群移植作为调整菌群失衡的核心方法,它指的是将提取自经过严格筛选的供体中的肠道菌群制备成菌液或者胶囊,移植到那些肠道菌群失衡的患者体内,重建患者肠道菌群的一个平衡,来达到治疗疾病的一个目的。
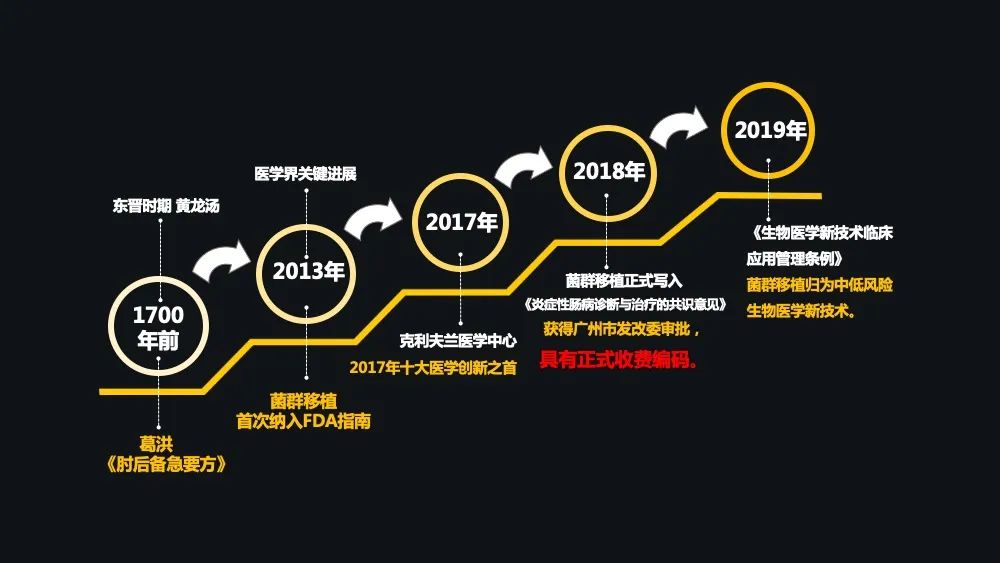
那么,菌群移植发展的历程最早是源于 1700 年前葛洪的《肘后备急方》。
到了 2013 年,菌群移植治疗复发性艰难梭状杆菌感染进入了美国 FDA 的治疗指南。
2017 年,微生物组被克利夫兰医学中心评为了十大医学创新之首。
到了 2018 年,广州市发改委的一个审批使菌群移植具有了正式的收费编码,这是中国在菌群移植这个行业中,将菌群移植定义为医疗新技术的一个里程碑事件,因为它同时具备了菌液制备以及菌群移植技术两条收费编码。
到 2019 年初,国家发布的《生物医学新技术临床应用管理条例》的征求意见稿中,将菌群移植归为中低风险的医学新技术。
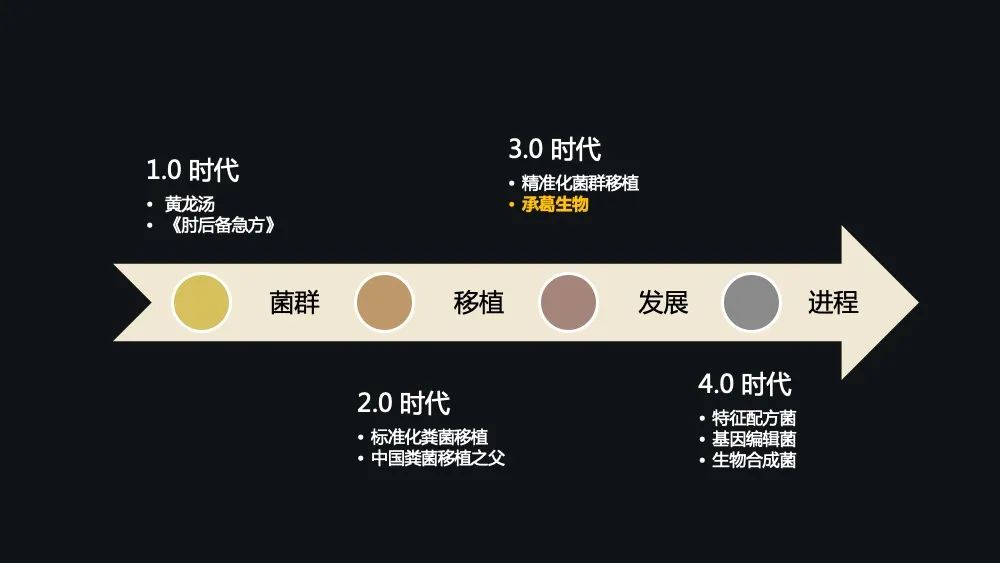
在中国整个菌群移植的发展进程中可以大致分为几个时代:
首先是 1.0 时代的黄龙汤。
接着是近代 2.0 时代标准化的粪菌移植,2.0 时代是以张教授发明的世界首台菌群分离提取仪作为一个标志。
而目前菌群移植已经进入了 3.0 时代,也就是精准化菌群移植时代,是以承葛生物研发的供受体配型作为标志。
这整个发展进程不断地在往前推进,即将进入到 4.0 的一个制药时代。比如特征配方菌时代、基因编辑菌时代、生物合成菌时代,这些时代要悄然地、渐渐地到来了。
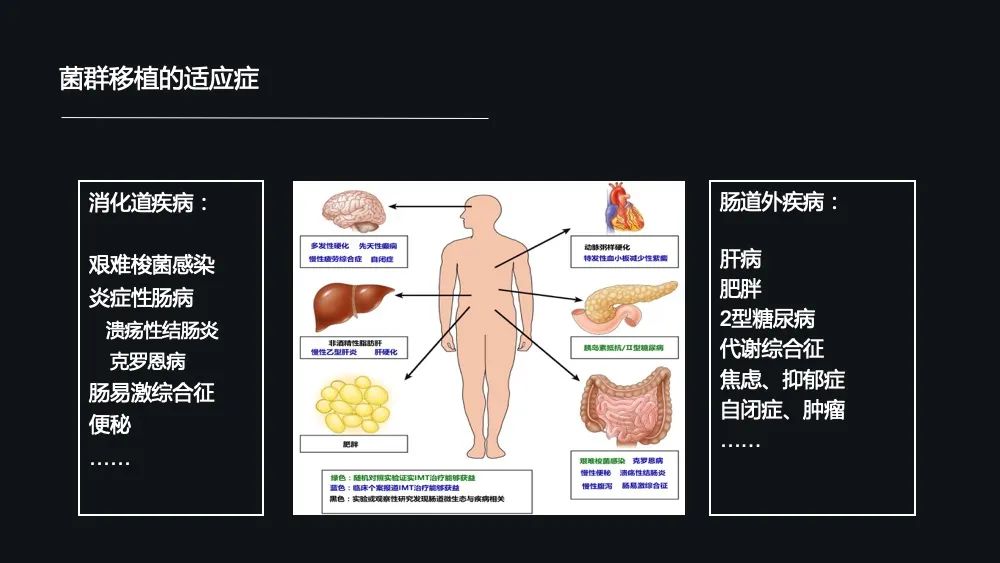
那菌群移植的适应症有哪些呢?
它包含了消化系统的疾病,比如目前最为成熟的像艰难梭状杆菌感染、炎症性肠病(包括溃疡性结肠炎和克罗恩病)以及肠易激综合征、便秘,还有包括目前正在探索的疾病——肠道外的一些疾病,如肥胖、2 型糖尿病、代谢综合征、自闭症、抑郁症、肿瘤等等。
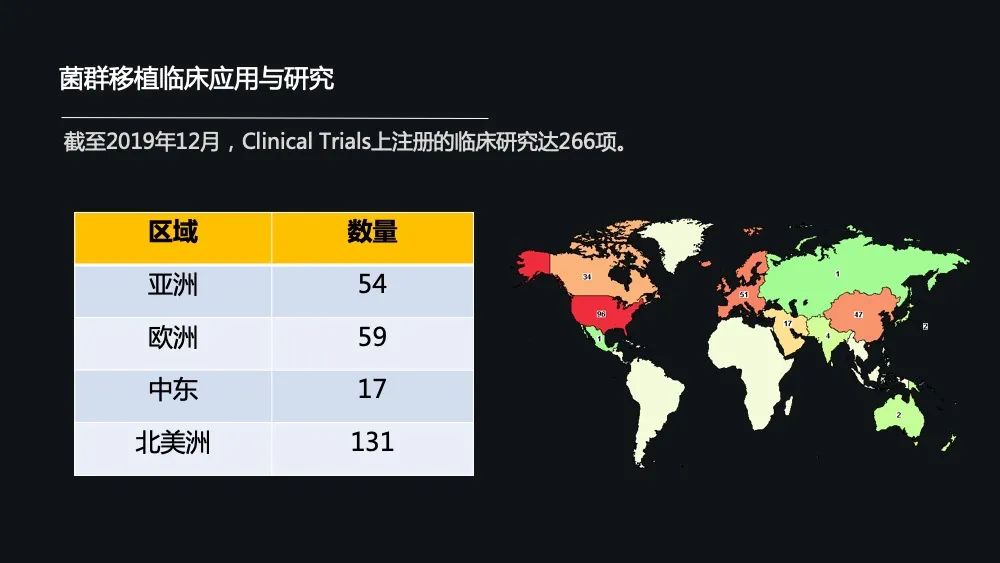
而菌群移植的适应症全球都在进行一个探索。
到 2019 年 12 月份的时候,Clinical Trials 注册的临床研究达到了 266 项,亚洲是 54 项(包含我们中国大陆的 37 项),欧洲是 59 项,中东是 17 项,北美洲是 130 项以上,占到全球的 1/2,其中美国有 96 项,占了全球的 1/3。
由此可见,菌群移植在美国是极其活跃的。
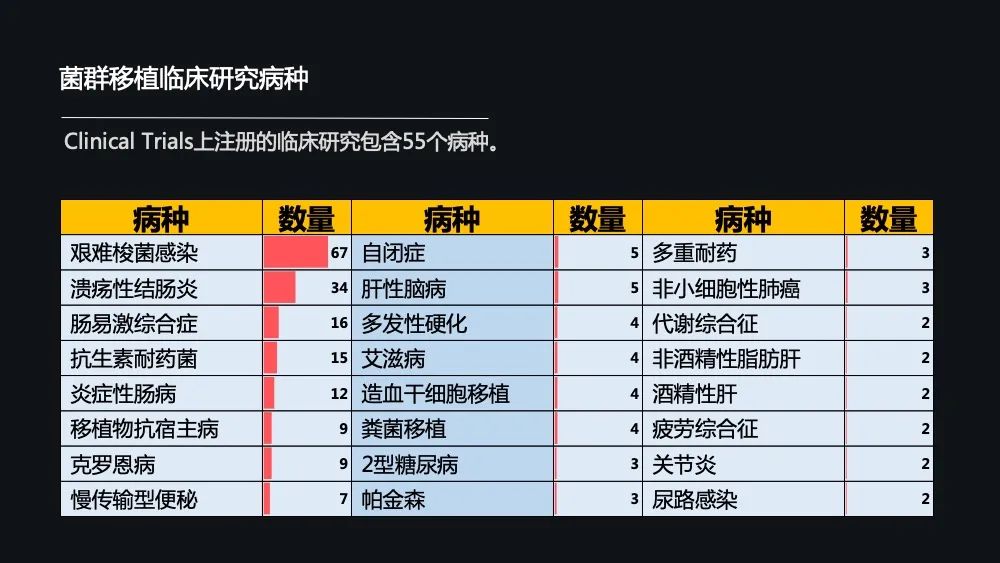
那在这 200 多项的一个临床研究中,包含了 55 个病种,最多的当然是艰难梭状杆菌感染,其次是溃疡性结肠炎和肠易激综合征。
以往菌群移植都集中在消化系统疾病,近两年,像抗生素的耐药以及移植物抗宿主病巨大地升高,明显增加的还有像肥胖、糖尿病以及肿瘤。此外,自闭症、帕金森等等精神神经系统的疾病也是明显增加的。
菌群移植的临床应用也好,它的临床研究也罢,都离不开菌群库,也就是粪菌库的一个建设。而在 2012 年,美国首家非营利性的菌库 OpenBiom 成立以后,全球掀起了建立菌群库的一个热潮。

据不完全统计,目前全球成立的规模性菌库已经达到了 20 家左右。这些全球性的菌库主要分布在美国,法国、荷兰、德国等欧洲国家,以及亚洲的韩国和我们的中国。
比如像美国的 OpenBiome、法国的圣安东尼奥医院菌群库、荷兰的莱顿大学医学中心的菌群库、英国的 Taymount 医疗中心的菌群库以及德国的科隆大学的医院的菌群库,还有中国的中华粪菌库。
当然还有商业性的菌库,比如像在香港的亚洲粪菌银行以及承葛生物的中华菌库联盟。

那既然菌群移植在国内外都如火如荼地开展,它的监管又如何呢?到底是按照技术来监管,还是按照药物来监管?我们先来看一下国外。

美国,美国 FDA 规定,菌群移植治疗复发性艰难梭状杆菌感染可由医院和医生自行裁定,也就是按照医学技术的方式进行一个监管。而对于除此以外的适应症,必须按照药物进行整体的一个申报,因此,它建立了一整套非常完善的菌群制药的一个申报流程和一个监管流程。
在加拿大卫生部,它是把菌群定义为一个新生物药物,要求任何的临床研究取得了临床试验的证明书才可以开展,为的是确保菌群移植符合一个品质和一个安全。

在欧盟,2017 年的时候就已经发布了菌群移植的一个专家共识,但是至今还没有明确的监管法律。
澳大利亚的菌群移植数量在全球是名列前茅的,但是目前也没有相关的监管法律。
那么在目前这一个监管体系跟市场情况下,国外的菌群移植以及微生态产业发展如何呢?
首先一点毋庸置疑的是国外非常重视、空前的重视肠道微生态的研究。
比如在 2007 年的时候美国启动了人类微生物组计划,紧接着欧盟、加拿大、法国、澳大利亚也分别启动国家微生物组计划。到 2016 年的时候,美国白宫再一次斥资数亿美元启动了国家微生物组计划。
在这些国家微生物计划的推动下,尤其是美国——在有一整套完整的菌群制药的申报流程跟监管体系之下,涌现出了一大批的创业公司和药企——就是菌群制药公司。
这些公司 90%以上是在肠道微生态这个领域的,同时,这些公司又有绝大部分是分布在美国。
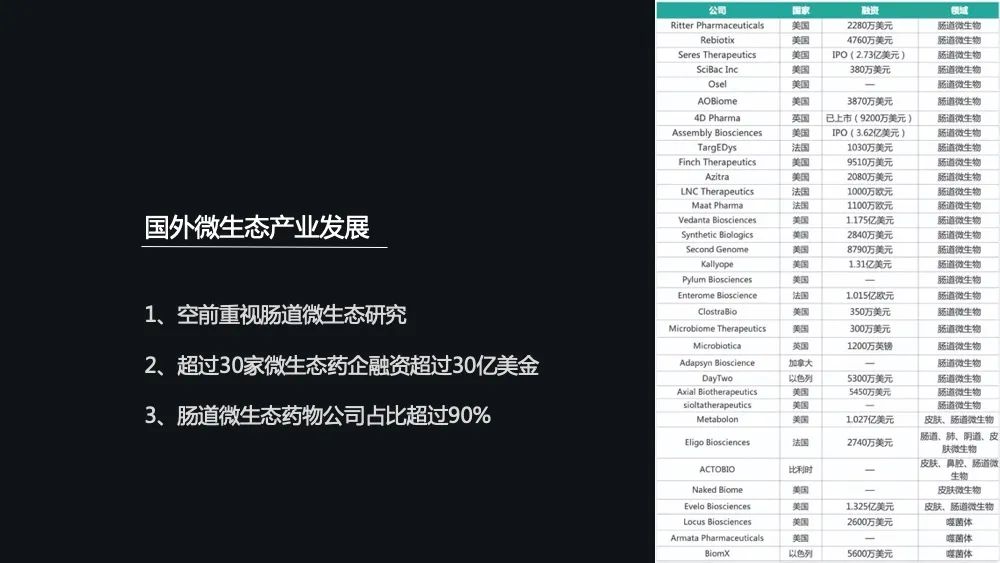
据不完全统计,这些菌群制药公司已经超过了 50 家,其中比较有名的 30 家融资额已经超过了 30 亿美金。
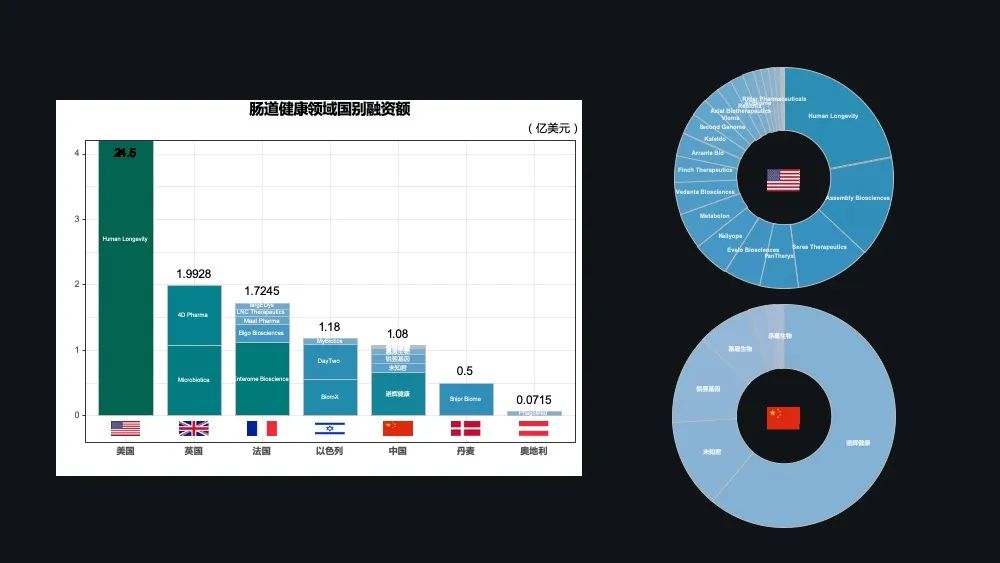
这些图中展示的是全球各个国家在微生态健康产业的一些融资的情况。美国以 24.5 亿美元居首,占了全球 80%的融资额度。

在国外的这些菌群制药公司中,他们的开发领域有一定的区别,大致可以分为三类:
第一类就是以消化系统跟感染性疾病为核心的,比如说它的方向是艰难梭状杆菌感染、溃疡性结肠炎、肠易激综合征等等;
第二类就是以肿瘤跟免疫为核心的,比如各类肿瘤的一些治疗或联合 PD-1一些治疗,联合这些细胞免疫学治疗,还有自身免疫性相关的一些疾病;
而第三类就是精神神经系统疾病,比如像自闭症、阿尔兹海默症等等这些精神神经系统疾病。

在这些适应症中,其中有一块适应症——就是肿瘤跟免疫疗法成为了全球各大药企巨头争夺的一个战场。
比如在 2016 年的时候,辉瑞和罗氏联合投资了 Second Genome,主要是在研发菌群所能介导的这一些靶点抑制剂的一个疗效。
到了 2017 年,强生投资 BiomX,它是开启了它的一个菌群与癌症之间治疗的一个领域。
到了 2018 年的时候,百时美施贵宝它又投资 Vedanta,共同来开发菌群,提高这些晚期癌症的患者的治疗的有效率。
到了 19 年的时候,阿斯利康也豪赠 2000 亿美金投资 Seres,共同去研究菌群提高肿瘤免疫疗法的一个疗效。
国外的这些公司有一部分是由巨头公司单独去开发的,而其它基本上是以创业公司为主。
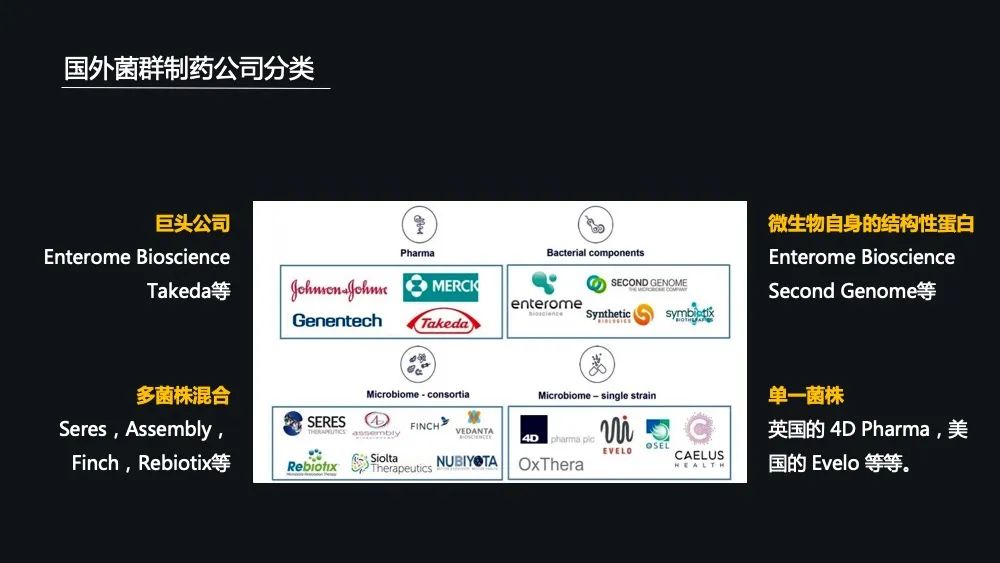
根据这些创业公司它的一个研究方向不同,可分为像微生物自身结构蛋白的,比如像 Second Genome,以及单菌株为研究方向的,像英国的 4D,还有多菌种混合为研究方向的比如像 Seres、Finch 跟 Rebiotix。
而像 Seres 和 Rebiotix 治疗艰难梭状杆菌感染的药物已经了进入临床 III 期。

前面都是国外一些公司发展的一个情况,那么在我们中国,菌群移植是怎么样一个方式进行监管的呢?
在中国,在 2016 年的时候就已经发布了儿童菌群移植的一个专家共识。
随后菌群移植治疗艰难梭状杆菌感染、炎症性肠病、肠易激综合征以及便秘等都已经进入了中华医学会的专家共识指南里面。但是,至今还没有很明确的法律法规进行监管,那么在这种情况下的菌群移植以什么样一个方式进行发展呢?
中国更倾向的是当它作为是一种医疗技术,而不是一个药物的方式,并且让它分类为一种中低风险的生物医学新技术进行一个推广。
全国已经有 6 个省市获得了卫健委、发改委和医保局的一个审批拥有了收费目录。明年 2020 年,可能有将近 20 个省市有正规的医疗收费目录了。

那么在这种整体的监管情况下,我们中国菌群移植的产业化有几个方向。
第一个勿容置疑,顺应形势的一个发展以及最好、最快能够实现落地产业化当然是按照医疗新技术的一个方式进行推广。它同时解决了两个问题:第一个解决了目前临床这些患者急需要治疗的一个刚需问题,第二个符合了目前各个省市拥有收费目录、已经具备一定法律法规的基础的一个方向跟政策的监管范围。
当然由于缺乏一个行业标准跟国家标准,菌群移植与医疗技术在推广的过程中也会存在各种各样的困难,比如供体筛选的标准、菌库建设的一个标准、菌液和胶囊制备的一个标准以及如何进行一个质控的一个标准,还有适应症该如何选择。
这些问题都是需要行业不断地发展之后,才能够更好地进行解决。
当然菌群移植还有另外一条康庄大道可以行走——就是菌群制药。随着菌群移植不断地向精准化方向的发展,越来越多的临床的数据积累以后,我们就能够越来越明确到底这个疾病有哪些菌起到核心的作用,到底是一种几种还是几十种菌起到了这些治疗作用,或者是这些菌跟这些代谢产物共同结合才起到了这些治疗作用。
这个时候就可以通过人工智能结合生物信息分析的方法,很快的就可以将精准化的一个菌群移植推向特征配方菌的制药之路。
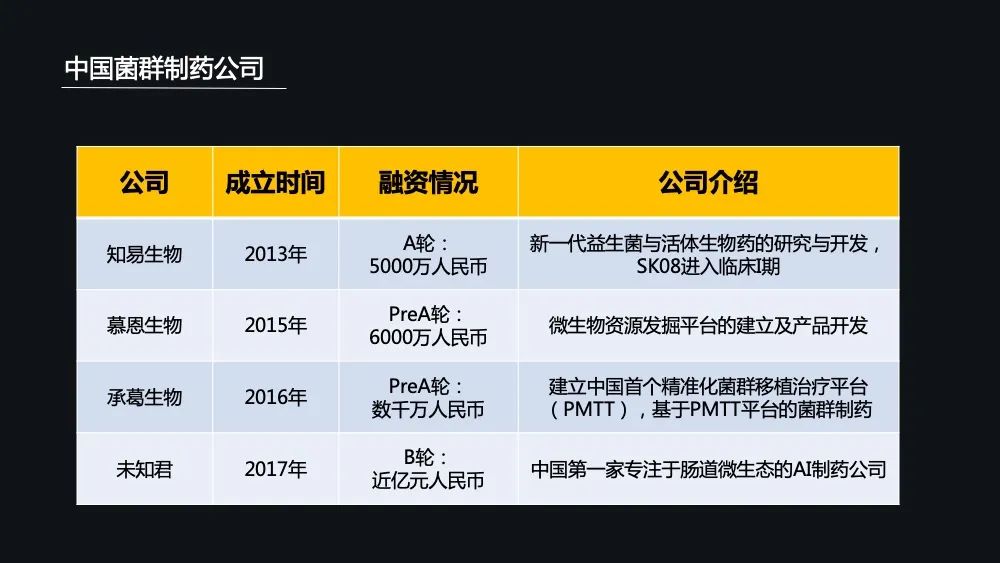
而中国菌群制药的公司极少,可以说目前菌群制药的企业仅仅处在刚刚起步的一个阶段,目前涉及到菌群制药的公司仅有 4 家。而这几家公司目前的融资额度都是超过了 5000 万元人民币。
最早成立的是知易生物,它是一家新一代益生菌与活菌生物药的临床研究与开发的公司。有特别的好的消息是在 2019 年 11 月份的时候,它的 SK08 获得了审批进入了临床 I 期。
慕恩生物是一个微生物资源发掘平台的建立跟产品药品开发的平台。
而承葛生物它是建立了中国首个精准化菌群移植治疗平台,它的产品涵盖了上游的仪器和耗材,中游的菌液跟胶囊,下游的供受体配型跟整体的菌群库建设的一个解决方案,并且基于 PMTT 平台,开启了微生态制药之路。
未知君是中国第一家专注于肠道微生态的AI制药公司。
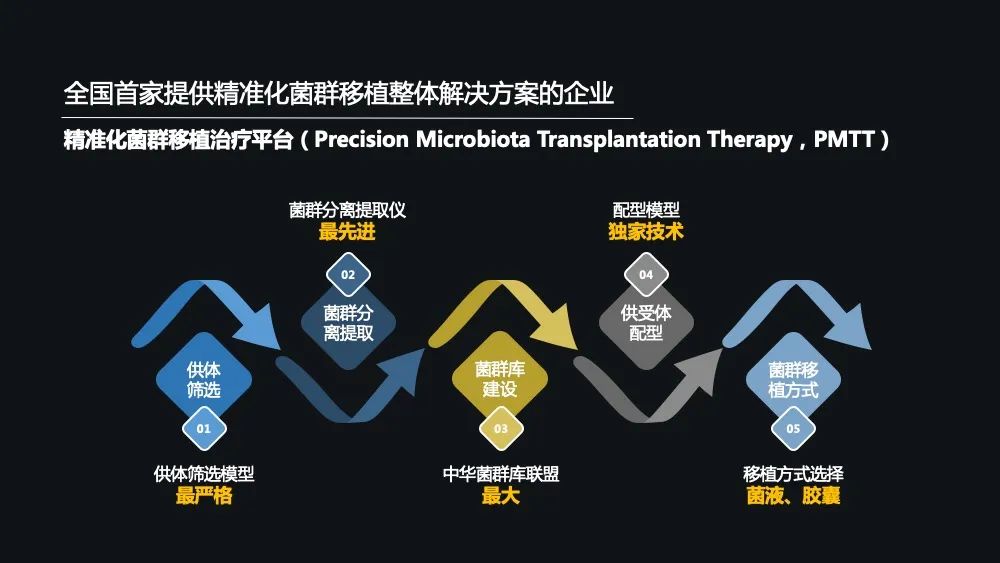
那下面最后就给大家介绍一下精准化菌群移植治疗平台,包括以下几个大类:
首先第一个就是供体的筛选,这是一个最为关键的步骤,因为它决定了菌群移植的有效性跟安全性。
第 1 步进行问卷调查。如果第 1 步合格了,你可以进入第 2 步——就是临床体检。
第 2 步如果筛查也合格了就能进入第 3 步,目前在全球范围之内,所有的这些菌群移植的单位也好,企业也好,也就做了前面两步。但是作为承葛生物,还要进入第 3 步的筛查,也就是肠道菌群宏基因组的测序,只有通过测序完之后才能够保证最优质的菌群。
所以,经过这严格的筛选,我们供体的合格率只有 2~3%。
接着往下进入了第二步菌群的分离跟提取,我们研发了最先进的菌群分离提取仪,并且我们的菌群提取,都是在万级的 GMP 的一个生产条件下,无菌的快速提取保证了菌群的一个活性。
第三步就是菌库的一个建设。菌群库它储存的不仅是菌液和胶囊,更重要的是它储存了菌群基因数据库以及各种患者的一些临床方面的信息,这就是供受体配型的一个前期基础跟研发的根源。
因此,在第四步就是说供受体的一个配型,那问题来了,为什么要配型?有必要吗?
我们在临床的过程中发现,一个患者用 A 供体的时候,有时候出现无效的效果,但一旦换成 B 供体了,它的效果又明显地显示出来了。
在这样不断的临床实践过程中,我们发现一个特点,一些患者总有一些适合他的供体,就好比男生也好,女生也好,总有适合他的那一个。
所以,我们就利用我们这个已经在临床中实践了几千个移植的数据,建立了一个供受体配型的模型,经过这种供受体的一个配型,我们菌群移植的有效率比原来传统的这种方式提高了 20%以上。
最后一步就是菌群移植方式的一个指导。
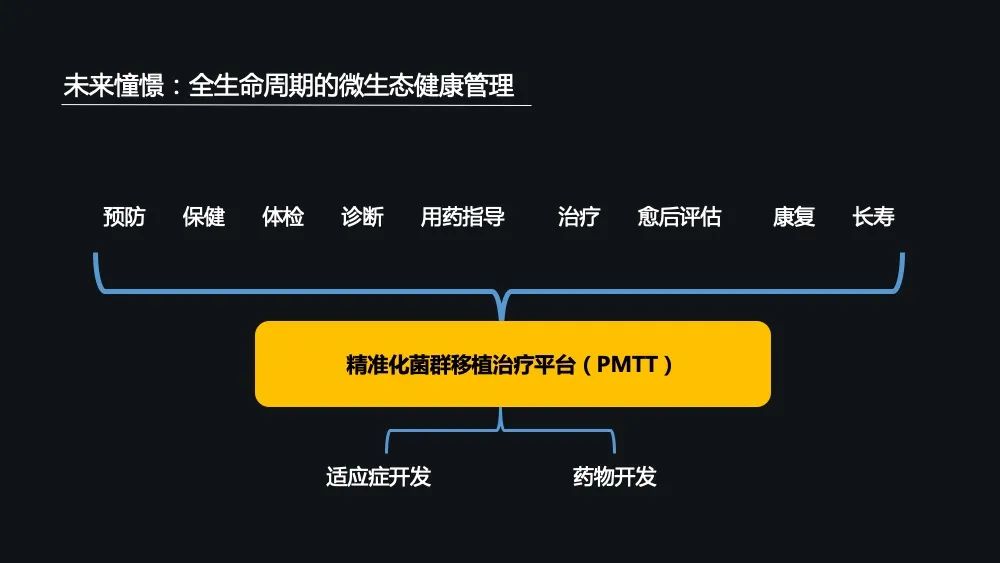
未来,我们希望利用我们精准化菌群移植治疗平台储存的大量的多组学的一个数据,一方面不断地进行菌群移植适应症的的一个开发,另外一方面进行菌群制药的一个开发,实现两条腿走路,才能走得更稳、更远。
最终我们期望能够实现的是疾病的预防、保健、诊断、用药、治疗、愈后评估、康复、长寿为一体的全生命周期的微生态健康管理。

谢谢大家!
实录 | 热心肠小伙伴们
审校 | 617


