2021年5月,国际益生菌和益生元科学协会(ISAPP)发布后生元共识声明。三年来有关后生元的定义的讨论不断。我们特别编译ISAPP针对19个后生元定义常见问题给出的解答,希望本文能够为相关的产业人士和诸位读者带来一些启发与帮助。
2021年,国际益生菌和益生元科学协会(ISAPP)针对“后生元(postbiotic)”一词给出了如下定义:对宿主健康有益的无生命微生物和/或其成分的制剂[1]。
这个定义由ISAPP召集的共识小组提出,该小组由来自于10个国家的11名专家组成,这些专家的背景涵盖了胃肠病学、儿科、代谢组学、微生物学、免疫学、功能基因组学、益生菌和宿主相互作用以及监管等多个领域。由此产生的关于后生元定义的出版物[1]已经被研究人员与公众广泛查阅和引用。
一项已发表的、针对该定义的批评提出了该定义与先前定义存在冲突等问题 [2],ISAPP共识小组对此也进行了答复[3]。上述由ISAPP提出的“后生元”定义已在各种论坛上得到了进一步讨论,包括学术会议的专题讨论、社交媒体评论和个人交流。
本文对该定义的常见问题(FAQ)进行了回应,这些问题主要集中在定义的理论基础、范围、措辞、组成,以及后生元的安全性、功效、定量和作用机制等方面。我们希望通过探讨这些常见问题,进一步明确定义及范围,并促进对“后生元”概念的共同理解。
Q1:为什么要针对“后生元”给出共识性定义呢?
随着对利用无生命微生物、微生物代谢物靶向干预人类和动物健康的兴趣不断增长,学界认为在这一领域内采用共同的术语将具有实质性价值。若在定义和术语的使用上缺乏共识,可能面临在科研、消费和监管领域引起混淆的风险,从而妨碍这个新兴且令人兴奋的领域发展。
我们注意到,此前已经有6个关于“后生元”的定义,但小组讨论后得出的结论是,这些定义在个体、集体层面上都存在着一些限制乃至矛盾。这些问题已在此前发表的研究中得到了详细讨论[3-4]。为后生元提供一个更为准确的定义,将有助于该领域的进一步发展。
Q2:ISAPP的定义因何侧重“无生命的细胞或细胞成分”而非“代谢物”?
“后生元(postbiotics)”一词源自希腊语,前缀“post”意为“之后”,“biotic”意为“生命体”,表明后生元应该是曾经具有生命的,但现在已经是“死亡后的”或者说是“无生命的”。关于“无生命的”术语的详细讨论,请参考Q7。
微生物代谢物,例如维生素或短链脂肪酸并非活的生物,它们没有活过,因此也不可能会是“死亡后的”。因此,仅由代谢物组成的混合物,被排除在后生元的概念之外。
对于简单的代谢物,如丁酸盐,可以使用现有的命名法;对于不包含无生命微生物或微生物细胞成分的复杂制剂,可以采用“无细胞滤液”等命名。采取这样的命名方式可以避免一种尴尬情景:不慎使用“后生元”这一术语来描述由微生物产生的代谢物或代谢物混合物,相同的化学合成制剂却不能被称为“后生元”。
一些作者提议使用术语“metabiotics”作为统称,来指代能够提供健康益处的代谢物[5,6]。然而,我们认为在引入新术语及其定义之前,应进行仔细而深入的专家辩论,以确切地区分任何新术语与现有定义的差异。
益生菌包含一系列细胞结构,这些结构有助于健康益处的发挥,研究人员还发现许多细胞结构在细胞死亡后仍能保持生物活性[7]。对活性微生物进行灭活并制成后生元产品的过程,也可能产生具有潜在功能的多种结构的混合物(图1)。
从这一角度来看,上述的一些细胞成分已被证明对宿主生理可产生直接影响,例如磷壁酸可在免疫调节中发挥作用[8]。而细胞生物质成分只能来自活的细胞,因此可以是“死亡后的”,所以归为“后生元”是合适的。
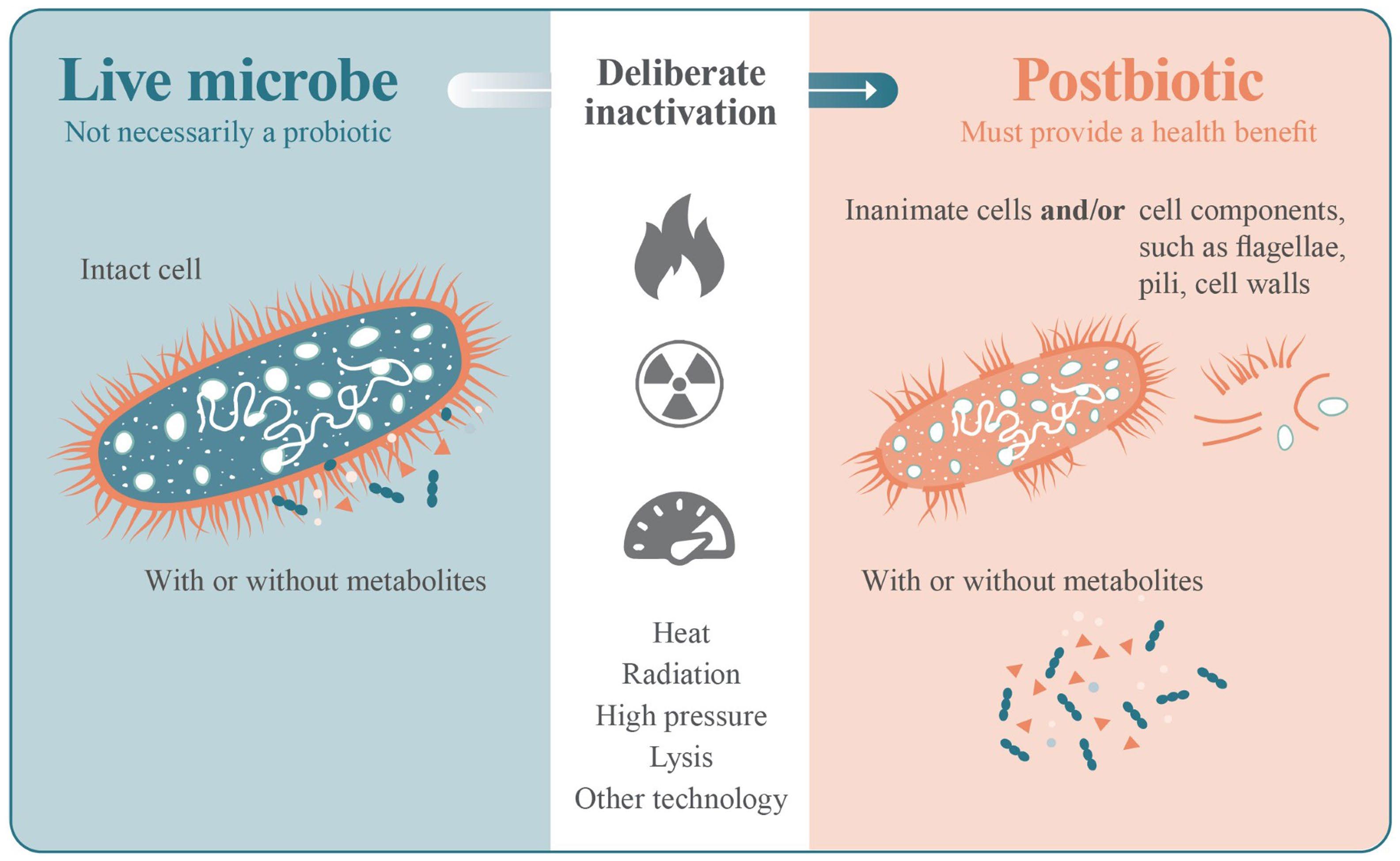
图1 后生元制备过程
在这一过程中需要对活性微生物采取有意的灭活处理,如热处理、辐射、高压或裂解。相关灭活步骤可能产生无生命的完整细胞、细胞成分的混合物,而前体微生物并不一定是益生菌。
Q3:代谢物能否成为后生元的一部分?
答案是肯定的。
代谢物确实可以成为后生元制剂的一部分,但它们不是后生元产品的必需组成部分。除非无生命微生物细胞或微生物的生物质经过彻底清洗和浓缩,但彻底清洗和浓缩并不是工业生产中的常见做法,否则所得制剂将不可避免地包含一些代谢物。同样地,一些益生菌产品也可能含有代谢物(图2),这些代谢物可能发挥健康益处。
如果灭活细胞的代谢物经过纯化或处理,去除一切细胞生物质或细胞成分,那么无论是否存在健康益处,它们都不再被视为后生元。这或许在语言上显得微妙,但是若要发挥作用,定义必须明确规定边界,而ISAPP共识基于前述原因认为,在没有生物质的情况下,代谢物不可以算作后生元。
定义明确指出,细菌代谢物或代谢物的混合物不符合后生元的定义。此外,这一方法避免了一种不可接受的情况:提取自微生物的一种或多种纯化代谢物的制剂,若有足够证据表明具有健康益处,可称之为后生元;与之化学结构相同但非微生物来源的制剂,则不能被归类为后生元。
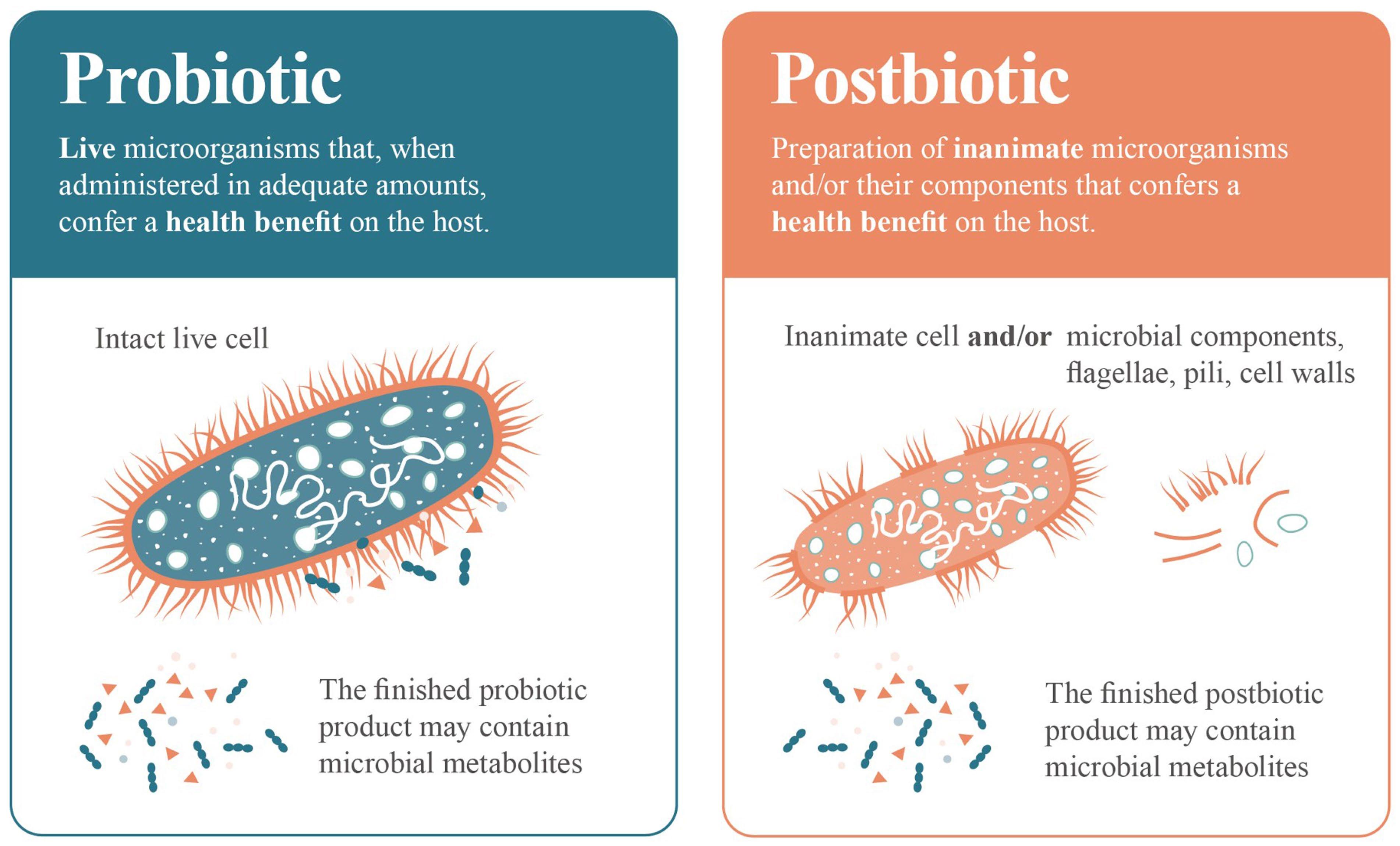
图2 益生菌与后生元特征对比
益生菌由活的微生物细胞组成,可提供健康益处。后生元则由活的微生物细胞经灭活产生的生物活性成分组成,生物活性成分即生物质,如死细胞、细胞壁、表面结构、被膜等。两者均可能包含或不包含代谢物。
Q4:定义中的“成分”具体指什么?
术语“成分”(components)指的是以细胞碎片或破裂的细胞形式存在的细胞生物质。使用该词是为了表明微生物由各种大分子结构和亚结构组成,例如微生物细胞壁化合物、细胞膜脂质、肽聚糖和磷壁酸。其中的许多细胞成分已知具有免疫原性作用,并可能在提供健康益处方面发挥重要作用。
微生物代谢物(metabolites)是由微生物产生的物质,可能存在于细胞内,也可能被排出而存在于细胞外。“代谢物”一词用于描述诸如短链脂肪酸、维生素或细菌素等化合物。
Q5:培养基或其他原料能否存在于后生元制剂?
在实际的生产过程中,细胞被收获和灭活后,后生元制剂中可能会残留培养基成分。这在益生菌、合生制剂和后生元产品中都很常见。这也是为什么生产过程需要得到足够控制,以确保后生元制剂在不同批次之间具有可重复性的原因之一。
Q6:为什么选择“后生元”而不是其他术语?
在ISAPP给出“后生元”定义之前,已经有一些术语被用于描述已灭活但能提供某种益处的微生物,比如热杀的益生菌(heat-killed probiotics)、热处理的益生菌(heat-treated probiotics)、热灭活的益生菌(heat-inactivated probiotics)、间歇灭活的益生菌(tyndallized probiotics)、幽灵益生菌(ghost probiotics)、副益生菌(paraprobiotics)等。
对以上术语的一大担忧是其中包含了“益生菌”一词,意味着这些灭活的微生物或制剂必须由符合益生菌标准的前体菌株加工而来,而益生菌的要求是微生物在活的时候就要具有健康益处。此外,在灭活后还需要实施进一步的研究来证明这种无生命的微生物也具有健康益处。
这对于创新来说,是一个不必要的负担。此外,可能存在这样的情况:某一菌株在活体状态下不能提供健康益处(因此不符合益生菌的标准),但在无生命状态下却能够带来健康益处。
细胞碎片、细胞裂解物或细胞生物质等其他术语被用于描述细胞成分,并且不符合后生元所需的固有健康益处的要求。
Q7:定义中的“制剂”是在强调什么?
后生元产品的生物活性基本上取决于前体菌株的身份,也可能受到灭活手段的影响。共识小组预测,灭活细胞的工艺过程(例如热处理、高压、辐射、裂解等)可能对产品的功能产生重要影响[9]。
相比之下,2011年给出的“副益生菌(paraprobiotics)”的定义指出:一旦健康益处得到证明,该产品是否能够被划分为副益生菌(paraprobiotics)类别,不应受到微生物细胞灭活方法的影响[10]。
此外,过滤和分离技术的应用,也将会影响特定后生元的组成。术语“制剂”(preparation)强调了这些生产过程对后生元的身份和功能的重要影响,同时保留了广泛的范围,以涵盖制备方法和成分方面的各种创新。
Q8: 为什么选择使用“无生命”这一术语?
根据牛津词源词典的解释,“无生命(inanimate)”意味着“没有生命力,或者已经失去生命”,被认为这是一个合适而精确的、用于描述后生元的术语。
虽然“无生命”并不是一个常见的术语,但截至2023年8月,在PubMed可检索到44个关于“非活微生物(non-viable microbes)”的条目,29个关于“无生命微生物(inanimate microbes)”的条目,都适用于指代不再具有生命的微生物。
在定义中,术语“无生命(inanimate)”被用来区分无活性(inactive)、不曾具有生命(without life)两个概念。由于后生元具有提供健康益处的“活性”,因此“无活性(inactive)”可能产生误导。出于实用的目的,“非活的(non-viable)”可以作为“inanimate”的同义词来使用。
Q9:后生元定义是否包括宿主微生物组受后生元影响而产生的物质?
有学者认为后生元是肠道有益菌代谢益生元或益生成分后产生的代谢物[11],另有学者则指出后生元是微生物组产生的代谢物[12]。这种将后生元概念描述为宿主微生物组生理过程的视角,与“biotics” 家族中其他物质的概念定义并不一致。将后生元定义为一种施用的物质,才与biotics家族先前定义的益生菌[13]、益生元[14]、合生制剂[15]的性质相一致。使用上述任何一种都是特殊的干预手段,目的是为了获得定义包含的以及研究过的健康益处。
所有后生元必须直接或间接地对宿主产生影响,从而带来健康益处。这种影响可能是由宿主微生物组产生的物质引起的,但是后生元本身依然被定义为施用的物质,而非其导致的宿主微生物组所产生的代谢物。
Q10:哪些微生物可以被用作后生元的前体菌株?
任何微生物都可以被用来制备后生元,只要能够明确它们的菌株水平,充分描述制备方法,并且在目标宿主中进行了适当的试验,证明了该制剂的安全性和有效性。甚至那些在活体状态下被认为是病原体的微生物也可以用于开发后生元,比如一种混合病原体的裂解物可用作呼吸道免疫增强剂[16]。
益生菌的定义亦是如此,只要证明了安全性和有效性,任何微生物种类都可以用于制备益生菌制剂。
Q11: 后生元可以是包含多种微生物的混合物吗?
后生元可以由经过适当鉴定和表征的多种分类学不同的菌株混合制备而成。
Q12:如何理解可能包含无生命的细胞、细胞碎片和代谢物的复杂后生元产品的作用机制?
关于后生元的潜在作用机制已在共识论文中进行了探讨[1]。其中许多假定、已确认的机制与益生菌和发酵产品的机制类似,最终的健康益处可能是由无生命的微生物或微生物成分,以及任何存在的代谢物与宿主之间复杂相互作用的结合所致。
然而,与所有干预手段(包括益生菌和药物)一样,后生元的作用机制并不一定是已知的,也无需区分后生元的每个成分对健康益处的相对贡献。
在益生菌发酵乳的例子中,我们对活细胞、死细胞以及发酵产生的代谢物每个成分的健康益处的相对贡献也知之甚少。后生元的定义并不要求了解每个成分的相对贡献,就像即使不了解多菌株益生菌产品中每个菌株的相对贡献,我们也可以称之为益生菌。
如果有兴趣区分后生元产品中各成分对健康益处的相对贡献,可以采用精密的实验设计,对所有成分单独评估,并对所有可能的组合再评估,也可以作为任何复杂生物衍生制剂的研究方法。
Q13:灭活的过程是否是有意为之?
后生元定义包含了一个特意设置的步骤,用于灭活产品中的活性微生物(图1),然后再对这个经过灭活产生的制剂进行功效研究。
例如,两歧双歧杆菌MIMBb75被证明以活性微生物形式给药能缓解肠易激综合征[17]。在制备为后生元后,研究人员针对该制剂进行了第二个临床试验,结果显示经过热灭活后对相同的疾病同样有效[18]。
尽管有这些发现,但依然不能保证两歧双歧杆菌MIMBb75产品在过期后、细胞自然死亡时会成为后生元。有意、受控且可重复应用的热灭活处理,不同于在长时间的货架期发生的细胞死亡,因此也不能假设它们产生的生物活性物质是相同的。
有意进行受控和可重复的灭活步骤,应该是后生元产品制备过程的一部分,与鉴定菌株的身份、纯度、功效和其他所有生产质量控制方面一样。
Q14:后生元产品可以包含活细胞吗?
后生元制备的灭活步骤后可能残留一些活细胞,通常远低于(数个数量级)无生命细胞的数量。
有趣的是,益生菌产品会面临与之相反的挑战。在制造和储存过程中,益生菌可能会发生细胞死亡,导致益生菌产品残留大量无生命细胞[19]。
事实上,冷冻干燥后的益生菌产品,无生命细胞的数量可能与活细胞的数量相当[19],甚至在过期后由于货架期内益生菌的死亡,无生命细胞的数量可能会超过活细胞数量1~2个数量级[20]。
Q15: 如何测量或量化后生元?
流式细胞术能够区分活细胞、死细胞和受损细胞,因此无生命的完整微生物可以通过流式细胞术进行测量。测量大分子量的细胞成分较为困难,可能需要使用一个可以代替的指标,如总生物质。代谢物可以通过高效液相色谱法(HPLC)或质谱技术等多种技术进行量化。
ISAPP认为提供有关后生元表征和量化方面的技术指南非常必要,并计划在2024年召集专家组来更全面地讨论这个问题。
Q16:是否需要表征、定量代谢物和无生命细胞?
应对后生元制剂进行适当表征,以确保各批次的可重复性,保障产品质量。如果后生元含有代谢物,制造商可以决定定量其中一个或多个代谢物以及无生命细胞和细胞成分。
为了达到后生元的最低标准,必须清楚地鉴定前体微生物,并充分描述后生元的制备过程,使其可重复。最终产品本身并不需要详细、定量表征所有成分和代谢物。
这类似于益生菌产品,可能包含了发酵过程残留的无生命细胞和代谢物[20],但使用菌落形成单位(CFU)定量益生菌即可。因此,明确无生命细胞的身份、数量、生产方法,足以充分表征后生元。
Q17:是否需要对无生命的微生物进行安全性证明?
尽管原则上与能够穿越免疫缺陷患者肠壁的活菌相比,无生命微生物可能引起的安全问题较少,但根据定义,它们并非惰性物质,同样可能构成潜在安全风险。
充分的安全评估是后生元开发过程的重要步骤,应当收集适当的临床前和临床安全性数据,同时对前体微生物和后生元制剂进行毒素表征和筛查。
Q18: 宣称后生元产品的健康益处需要哪些证据?
对于biotics家族的成员来说,包括益生菌、益生元和合生制剂,想要声称任何健康益处都必须得到一个设计良好的干预试验的支持,通常是双盲、随机、安慰剂对照试验,必须以适当的剂量在目标宿主进行。
Q19:市场上是否有符合ISAPP定义的后生元产品?
目前市场上已有一些符合ISAPP定义的后生元产品,它们提供了无生命微生物,含或不含细胞成分和代谢物,获临床试验证明对改善肠道健康、皮肤健康或呼吸道健康的有效性。它们包括但不限于:
参考文献
(滑动查看下文)
[1]Salminen, S., Collado, M. C., Endo, A., Hill, C., Lebeer, S., Quigley, E. M. M., et al. (2021a). The international scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics. Nat. Rev. Gastroenterol. Hepatol. 18, 649–667. doi: 10.1038/s41575-021-00440-6
[2]Aguilar-Toalá, J. E., Arioli, S., Behare, P., Belzer, C., Berni Canani, R., Chatel, J. M., et al. (2021). Postbiotics – when simplification fails to clarify. Nat. Rev. Gastroenterol. Hepatol. 18, 825–826. doi: 10.1038/s41575-021-00521-6
[3]Salminen, S., Collado, M. C., Endo, A., Hill, C., Lebeer, S., Quigley, E. M. M., et al. (2021b). Reply to: postbiotics – when simplification fails to clarify. Nat. Rev. Gastroenterol. Hepatol. 18, 827–828. doi: 10.1038/s41575-021-00522-5
[4]Vinderola, G., Sanders, M. E., and Salminen, S. (2022). The concept of postbiotics. Foods. 11:1077. doi: 10.3390/foods11081077
[5]Sadeghi, A., Ebrahimi, M., Kharazmi, M. S., and Jafari, S. M. (2023). Effects of microbial-derived biotics (meta/pharma/post-biotics) on the modulation of gut microbiome and metabolome; general aspects and emerging trends. Food Chem. 411:135478. doi: 10.1016/j.foodchem.2023.135478
[6]Tenea, G. N. (2023). Metabiotics signature through genome sequencing and in vitro inhibitory assessment of a novel Lactococcus lactis strain UTNCys6-1 isolated from Amazonian Camu-Camu fruits. Int. J. Mol. Sc. 24:6127. doi: 10.3390/ijms24076127
[7]Adams, C. (2010). The probiotic paradox: live and dead cells are biological response modifiers. Nut. Res. Rev. 23, 37–46. doi: 10.1017/S0954422410000090
[8]Shiraishi, T., Yokota, S., Fukiya, S., and Yokota, A. (2016). Structural diversity and biological significance of lipoteichoic acid in gram-positive bacteria: focusing on beneficial probiotic lactic acid bacteria. Biosci. Microbiota Food Health. 35, 147–161. doi: 10.12938/bmfh.2016-006
[9]Wong, C., and Ustunol, Z. (2006). Mode of inactivation of probiotic bacteria affects interleukin 6 and interleukin 8 production in human intestinal epithelial-like Caco-2 cells. J. Food Prot. 69, 2285–2288. doi: 10.4315/0362-028X-69.9.2285
[10]Thorakkattu, P., Khanashyam, A. C., Shah, K., Babu, K. S., Mundanat, A. S., Deliephan, A., et al. (2022). Postbiotics: current trends in food and pharmaceutical industry. Foods. 11:3094. doi: 10.3390/foods11193094
[11]Park, M., Joung, M., Park, J. H., Ha, S. K., and Park, H. Y. (2022). Role of postbiotics in dietinduced metabolic disorders. Nutrients 14:3701. doi: 10.3390/nu14183701
[12]Thorakkattu, P., Khanashyam, A. C., Shah, K., Babu, K. S., Mundanat, A. S., Deliephan, A., et al. (2022). Postbiotics: current trends in food and pharmaceutical industry. Foods. 11:3094. doi: 10.3390/foods11193094
[13]Hill, C., Guarner, F., Reid, G., Gibson, G. R., Merenstein, D. J., Pot, B., et al. (2014). Expert consensus document. The international scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 11, 506–514. doi: 10.1038/nrgastro.2014.66
[14]Gibson, G. R., Hutkins, R., Sanders, M. E., Prescott, S. L., Reimer, R. A., Salminen, S. J., et al. (2017). Expert consensus document: the international scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 14, 491–502. doi: 10.1038/nrgastro.2017.75
[15]Swanson, K. S., Gibson, G. R., Hutkins, R., Reimer, R. A., Reid, G., Verbeke, K., et al. (2020). The international scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics. Nat. Rev. Gastroenterol. Hepatol. 17, 687–701. doi: 10.1038/s41575-020-0344-2
[16]Kaczynska, A., Klosinska, M., Janeczek, K., Zarobkiewicz, M., and Emeryk, A. (2022). Promising immunomodulatory effects of bacterial lysates in allergic diseases. Front. Immunol. 13:907149. doi: 10.3389/fimmu.2022.907149
[17]Guglielmetti, S., Mora, D., Gschwender, M., and Popp, K. (2011). Randomised clinical trial: Bifidobacterium bifidum MIMBb75 significantly alleviates irritable bowel syndrome and improves quality of life--a double-blind, placebo-controlled study. Aliment. Pharmacol. Ther. 33, 1123–1132. doi: 10.1111/j.1365-2036.2011.04633.x
[18]Andresen, V., Gschossmann, J., and Layer, P. (2020). Heat-inactivated Bifidobacterium bifidum MIMBb75 (SYN-HI-001) in the treatment of irritable bowel syndrome: a multicentre, randomised, double-blind, placebo-controlled clinical trial. Lancet Gastroenterol. Hepatol. 5, 658–666. doi: 10.1016/S2468-1253(20)30056-X
[19]Raymond, Y., and Champagne, C. P. (2015). The use of flow cytometry to accurately ascertain total and viable counts of Lactobacillus rhamnosus in chocolate. Food Microbiol 46, 176–183. doi: 10.1016/j.fm.2014.07.002
[20]Fiore, W., Arioli, S., and Guglielmetti, S. (2020). The neglected microbial components of commercial probiotic formulations. Microorganisms 8:1177. doi: 10.3390/microorganisms8081177
[21]Szajewska, H., Kołodziej, M., Skórka, A., and Pieścik-Lech, M. (2022). Infant formulas with postbiotics: an updated systematic review. J. Pediatr. Gastroenterol. Nutr. 74, 823–829. doi: 10.1097/MPG.0000000000003441
[22]Malagón-Rojas, J. N., Mantziari, A., Salminen, S., and Szajewska, H. (2020). Postbiotics for preventing and treating common infectious diseases in children: a systematic review. Nutrients 12:389. doi: 10.3390/nu12020389
[23]Ríus, A. G., Kaufman, J. D., Li, M. M., Hanigan, M. D., and Ipharraguerre, I. R. (2022). Physiological responses of Holstein calves to heat stress and dietary supplementation with a postbiotic from Aspergillus oryzae. Sci. Rep. 12:1587. doi: 10.1038/s41598-022-05505-3
[24]Pinheiro, I., Robinson, L., Verhelst, A., Marzorati, M., Winkens, B., den Abbeele, P. V., et al. (2017). A yeast fermentate improves gastrointestinal discomfort and constipation by modulation of the gut microbiome: results from a randomized double-blind placebocontrolled pilot trial. BMC Complement. Altern. Med. 17:441. doi: 10.1186/s12906-017-1948-0
[25]Maehata, H., Arai, S., Iwabuchi, N., and Abe, F. (2021). Immuno-modulation by heat-killed Lacticaseibacillus paracasei MCC1849 and its application to food products. Int. J. Immunopathol. Pharmacol. 35:20587384211008291. doi: 10.1177/20587384211008291
[26]Rather, I. A., Kim, B. C., Lew, L. C., Cha, S. K., Lee, J. H., Nam, G. J., et al. (2021). Oral administration of live and dead cells of Lactobacillus sakei proBio65 alleviated atopic dermatitis in children and adolescents: a randomized, double-blind, and placebo-controlled study. Probiotics Antimicrob. Proteins 13, 315–326. doi: 10.1007/s12602-020-09654-7
[27]Depommier, C., Everard, A., Druart, C., Plovier, H., Van Hul, M., Vieira-Silva, S., et al. (2019). Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nat. Med. 25, 1096–1103. doi: 10.1038/s41591-019-0495-2
[28]Gueniche, A., Liboutet, M., Cheilian, S., Fagot, D., Juchaux, F., and Breton, L. (2021). Vitreoscilla filiformis extract for topical skin care: a review. Front. Cell. Infect. Microbiol. 11:747663. doi: 10.3389/fcimb.2021


