编者按
白色念珠菌是一种重要的条件致病性真菌,也是一种人体共生菌,存在于胃肠道、口腔和阴道中。该真菌的过度生长与多种疾病相关,包括鹅口疮、阴道念珠菌病等。近年来的研究还发现该菌与炎症性肠病、胃肠道癌息息相关。
今天,共同关注白色念珠菌。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
白色念珠菌(Candida albicans)是一种机会性致病真菌,也是人类肠道菌群的成员之一。
通常,人类宿主的营养免疫作用会限制病原微生物获得关键的微量营养素(如锌和铁)。为了克服这一挑战,白色念珠菌主要通过两种途径获取环境中的锌:
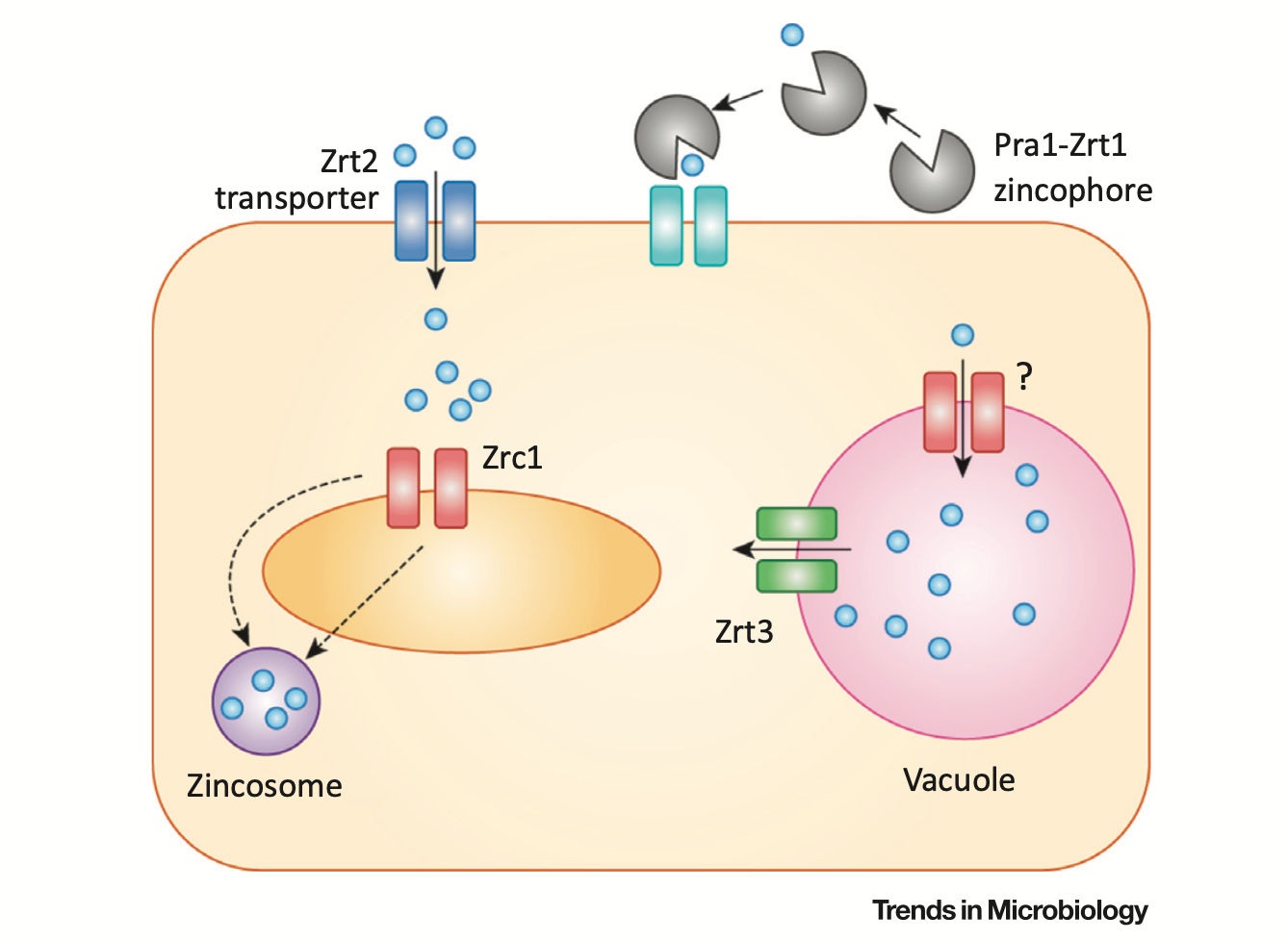
1. 第一种途径依赖质膜转运体 Zrt2。在酸性环境中,Zrt2对微生物的生长和锌吸收至关重要。当环境pH中和到7时,会严重降低 Zn2+的溶解度。
2. 第二种途径依赖于锌载体(zincophore)。pH 值的升高会触发第二种锌捕获系统的表达——锌载体。这种真菌特有的锌捕获系统需要分泌型锌结合蛋白 Pra1 来捕获锌,并通过 Zrt1 将锌输送到细胞内部。
如果细胞内存在过量的锌,则通过依赖 Zrc1 的机制解毒。在白色念珠菌中,Zrc1 对锌体(zincosomes)的生成发挥了重要作用。在小鼠感染模型中,白色念珠菌在肾脏和肝脏的定植分别需要 Zrt2 和 Zrc1 的参与。因此,实际上,该真菌在宿主体内会既会面临低锌瓶颈,也会面临高锌挑战。
1. 白色念珠菌是人类胃肠道菌群的成员。
2. 白色念珠菌一种多形态真菌——它能够以单细胞酵母、丝状菌丝或假菌丝的形式生长,并可形成厚垣孢子 (chlamydospores)和 Goliath 细胞;它还会经历表型变化,比如从白色转换成不透明色。
3. 该真菌依靠菌丝入侵组织,因此菌丝的形成十分重要。关键毒力因子的表达与菌丝的形成是协同调控的。
4. 该真菌可表达一系列的粘附素、入侵素、分泌型水解酶,以及一种名为念珠菌素的细胞溶解毒素。
5. 该真菌需要高效的营养捕获、稳定的代谢活动和环境压力反应来激发致病性。
1. 在念珠菌属(Candida)中,白色念珠菌是念珠菌病最常见的致病因子。
2. 该真菌可导致表层感染,如常见的口腔念珠菌病(鹅口疮)和阴道念珠菌病。在美国,鹅口疮每年会影响大约 7500 万名妇女。
3. 保守估计,美国每年大约有 25 万例侵袭性念珠菌病,其中至少有 5 万人死亡。

1. 炎症性肠病患者的肠道菌群中白色念珠菌的丰度显著升高。最新研究表明,人肠道白色念珠菌的菌株多样性高,且对免疫细胞的破坏力和促炎能力具有菌株特异性。
2. 白色念珠菌或与多种癌症相关,如结肠癌、胃癌。有研究表明白色念珠菌会介导巨噬细胞糖酵解途径上调,从而上调 IL-7 的表达和分泌,进而通过 AhR 和 STAT3 途径诱导 3 型固有淋巴细胞(ILC3)表达高水平的 IL22,加重结肠癌进展。
3. 多种来源的黏液黏蛋白均能减弱白色念珠菌的毒力。最新的研究表明,黏蛋白O-聚糖可通过转录因子 Nrg1 抑制白色念珠菌菌丝及感染相关表型。
4. 处于代谢活跃和增殖时期的鼠李糖乳杆菌可以通过消耗对白色念珠菌有利的碳、氮和磷来源,影响其代谢和转录,迫使白色念珠菌进入不利的生长环境,降低其致病性。
5. 鼠李糖乳杆菌分泌的1-乙酰基-β-咔啉(1-ABC)可以通过抑制真菌的 DYRK1 家族激酶,阻断白色念珠菌向菌丝态转变和生物膜形成,从而抑制其致病性。
6. 2022 年 4 月 26 日,美国FDA批准了 Mycovia Pharmaceuticals 公司研发的口服抗真菌药物 Vivjoa(Oteseconazole),用于降低有复发性外阴阴道念珠菌病(RVVC)病史且无生殖潜力的女性 RVVC 的发病率。这是 FDA 批准的第一个也是唯一一个针对 RVVC 的药物。
参考文献:
(滑动查看全部)
1. Crawford, A.C. et al. (2018) Biphasic zinc compartmentalisation in a human fungal pathogen. PLoS Pathog. 14, e1007013.
2. Łoboda,D.andRowinska-Zyrek,M. (2017) Zinc binding sites in Pra1,a zincophore from Candida albicans. DaltonTrans.46,13695–13703.
3. Citiulo, F. et al. (2012) Candida albicans scavenges host zinc via Pra1 during endothelial invasion. PLoS Pathog. 8, e1002777.
4. Crawford, A. and Wilson, D. (2015) Essential metals at the host–pathogen interface: nutritional immunity and micronutrient assimilation by human fungal pathogens. FEMS Yeast Res. 15, fov071.
5. Mayer, F.L. et al. (2013) Candida albicans pathogenicity mechanisms. Virulence 4, 119–128.
6. Brown, G.D. et al. (2012) Hidden killers: human fungal infections. Sci. Transl. Med. 4 (165), rv113.
7. Kullberg, B.J. and Arendrup, M.C. (2015) Invasive candidiasis. N. Engl. J. Med. 373, 1445–1456.
8. Zhu Y, Shi T, Lu X, et al. Fungal‐induced glycolysis in macrophages promotes colon cancer by enhancing innate lymphoid cell secretion of IL‐22[J]. The EMBO journal, 2021, 40(11): e105320.
9. Li X V, Leonardi I, Putzel G G, et al. Immune regulation by fungal strain diversity in inflammatory bowel disease[J]. Nature, 2022, 603(7902): 672-678.
10. Alonso-Roman R, Last A, Mirhakkak M H, et al. Lactobacillus rhamnosus colonisation antagonizes Candida albicans by forcing metabolic adaptations that compromise pathogenicity[J]. Nature Communications, 2022, 13(1): 1-15.
11. Zhong M, Xiong Y, Zhao J, et al. Candida albicans disorder is associated with gastric carcinogenesis[J]. Theranostics, 2021, 11(10): 4945.
12. Takagi J, Aoki K, Turner B S, et al. Mucin O-glycans are natural inhibitors of Candida albicans pathogenicity[J]. Nature Chemical Biology, 2022: 1-12.
13. MacAlpine J, Daniel-Ivad M, Liu Z, et al. A small molecule produced by Lactobacillus species blocks Candida albicans filamentation by inhibiting a DYRK1-family kinase[J]. Nature communications, 2021, 12(1): 1-16.
原文链接:
https://doi.org/10.1016/j.tim.2018.10.010
作者|Duncan Wilson
编译|wx
审校|617
编辑|豫小鱼


