编者按
2022年5月28日,第十八个“世界肠道健康日”前夕,热心肠奖正式揭晓“2022年度科学家”“2022年度产品经理”获奖名单。这是热心肠研究院致力打造中国肠道领域“奥斯卡奖”为目标的国际化、专业化、市场化行业奖项。
本次特别整理发布“热心肠奖·2022年度科学家获得者”,热心肠智库专家、荷兰格罗宁根大学医学中心系统医学教授傅静远的演讲视频及图文实录,以飨读者。

今天,我演讲的题目是“肠道菌群的特异性及功能”。

我也希望借此机会,一方面来回顾2021-2022年之间我们取得的一些研究成果,另一方面也希望跟大家分享一下,我们未来一年中的工作重点,特别是我们如何致力于发展个性化器官芯片,用于肠道菌群与宿主相互作用的研究。
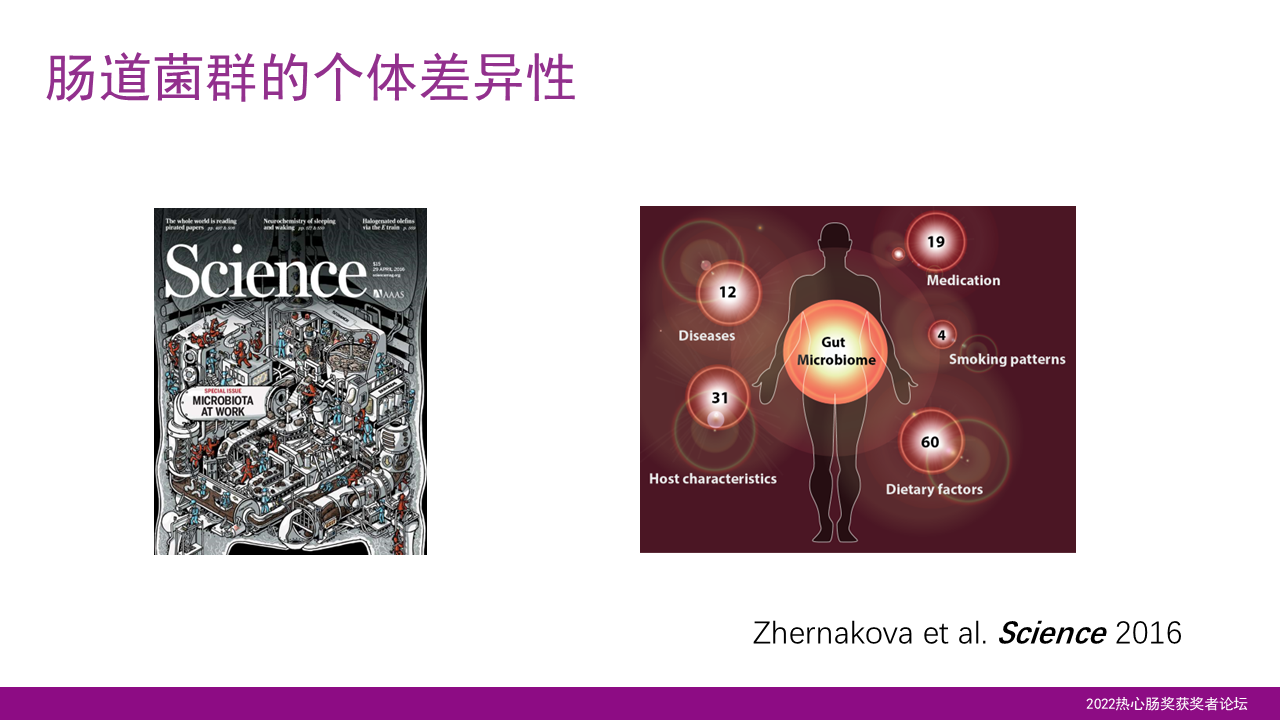
首先回顾到2016年,我们首次发表在《科学》杂志上的文章已经揭示了肠道菌群存在着巨大的个体差异性,暗示着肠道菌群在个体化的研究中会发挥至关重要的作用。

因此肠道菌群也被称之为“人类的第二基因组”,但是如果把人类基因组比喻成一本你出生前就已经写好了的密码本,那么我们的肠道菌群的基因组,就可以比喻成一个图书馆,它富含着成千上万的细菌基因组群。
而这个基因组群大部分是在你出生以后才获得的,并且是在3岁的时候基本构建成熟。在你的一生当中,随着年龄的增长,环境和健康的变化,而不断地发生变化。
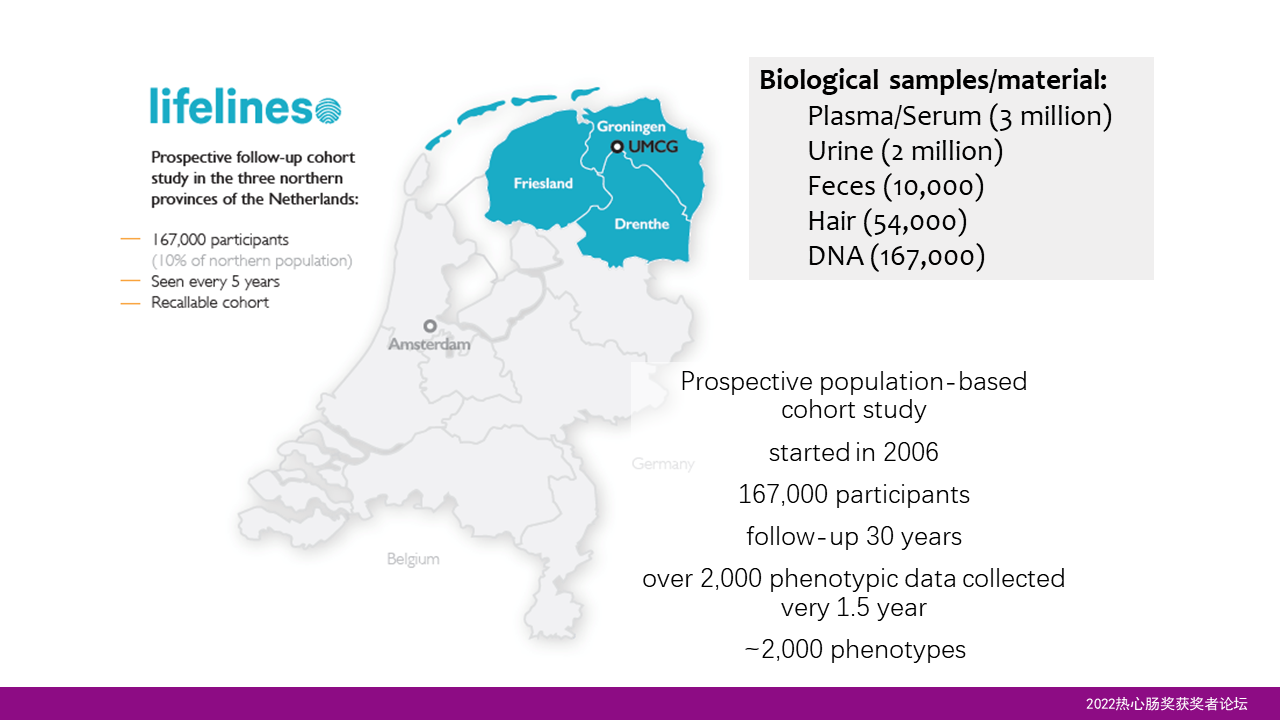
目前肠道菌群与人类健康的关联性研究,大多数只是基于横断面的一个研究。因此想进一步地了解菌群与我们健康的关系,我们需要一个多时间点、前瞻性的追踪调查。
我们的lifelines队列就是这样子的一个队列,这个队列构建于2006年,对荷兰北部三省近17万人的生活习惯、健康和疾病进行了为期30年的跟踪调查。每隔一年半的时间进行一次问卷调查,而每隔5年进行一次生物样本的收集。
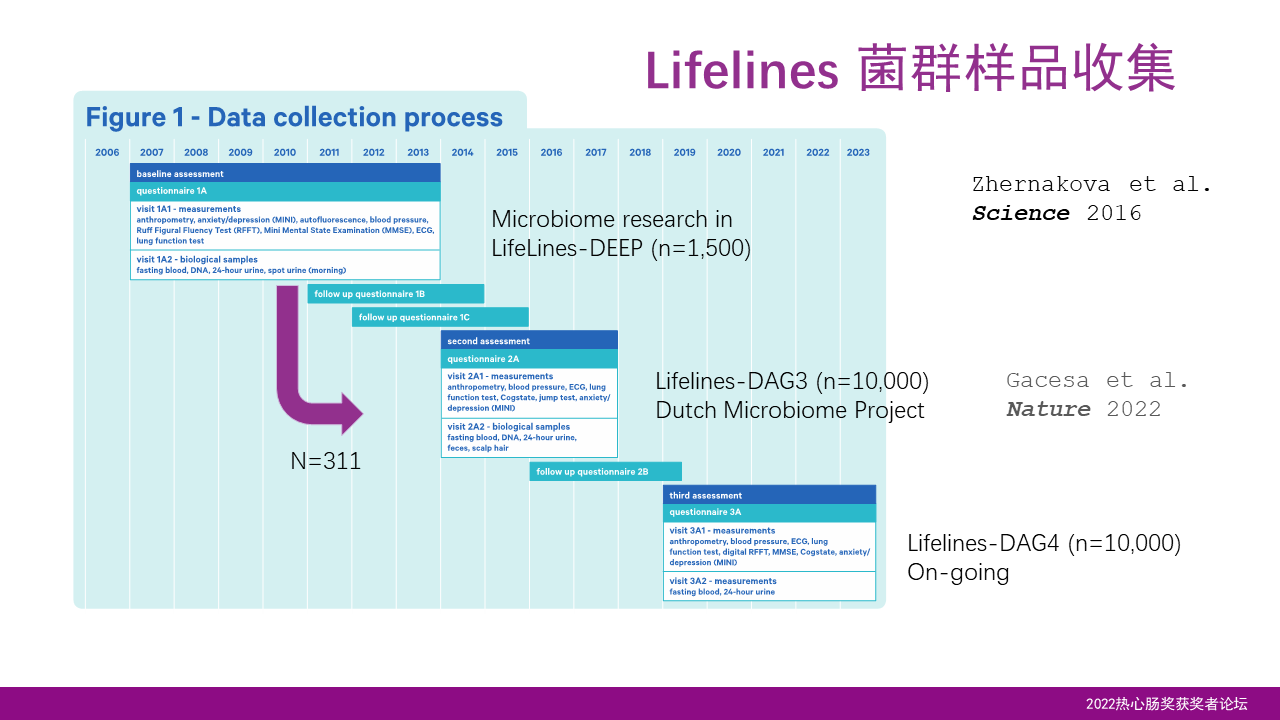
粪便的收集用于菌群研究,首先开始于2012年左右,我们完成了对1500个人第一个时间段的收集;而第二次粪便的收集发生在2015-2017年的年间,共完成了近1万人的样本收集;第三次的样本收集正在如火如荼地进行,计划同样实现1万人的收集。
其中300多个人参与了第一次和第二次的收集,平均时间间隔为4年,这为我们了解肠道菌群的稳定性和变化性提供了一个宝贵的资源。

比较两个时间点的菌群构成,我们可以观察到不少的变化,但是这个变化的幅度也是有限的。有一些菌株,特别是它们的基因图谱,保持着长期的个体特异性和稳定性。
我们甚至可以利用个体的特异性和稳定性,来构建了菌群的指纹图谱,它们可以达到了99%的特异性和88%以上的稳定性。间隔时间越短,这个时间内的菌群稳定性和特异性就会越高。

但是又是什么样的因素来决定我们菌群的稳定性和特异性呢?
首先,可能与我们宿主的基因型相关。因此我们进行了全基因组的相关性研究,发现了多个人体基因的基因位点与我们的菌群相关,特别是LCT和ABO的这两个位点。

同时我们发现,遗传的作用相对比较小。在菌群的遗传学研究中,还面临着很多的挑战,大家可以参考一下我们近期对此以及其未来方向的一些思考。除了宿主基因的作用,环境对菌群的作用也是非常显著的。
通过对大量环境因素的研究,环境对菌群的影响甚至可以追溯到我们的初生期、儿童期,环境暴露的作用包括出生的方式、喂养的方式、儿童期的一些宠物或者说其他的一些环境暴露的作用。
那么菌群到底是通过一个什么样的机制对人类健康产生影响的呢?目前研究当然是主要集中在两个方面:一方面是代谢,另一方面当然就是免疫。
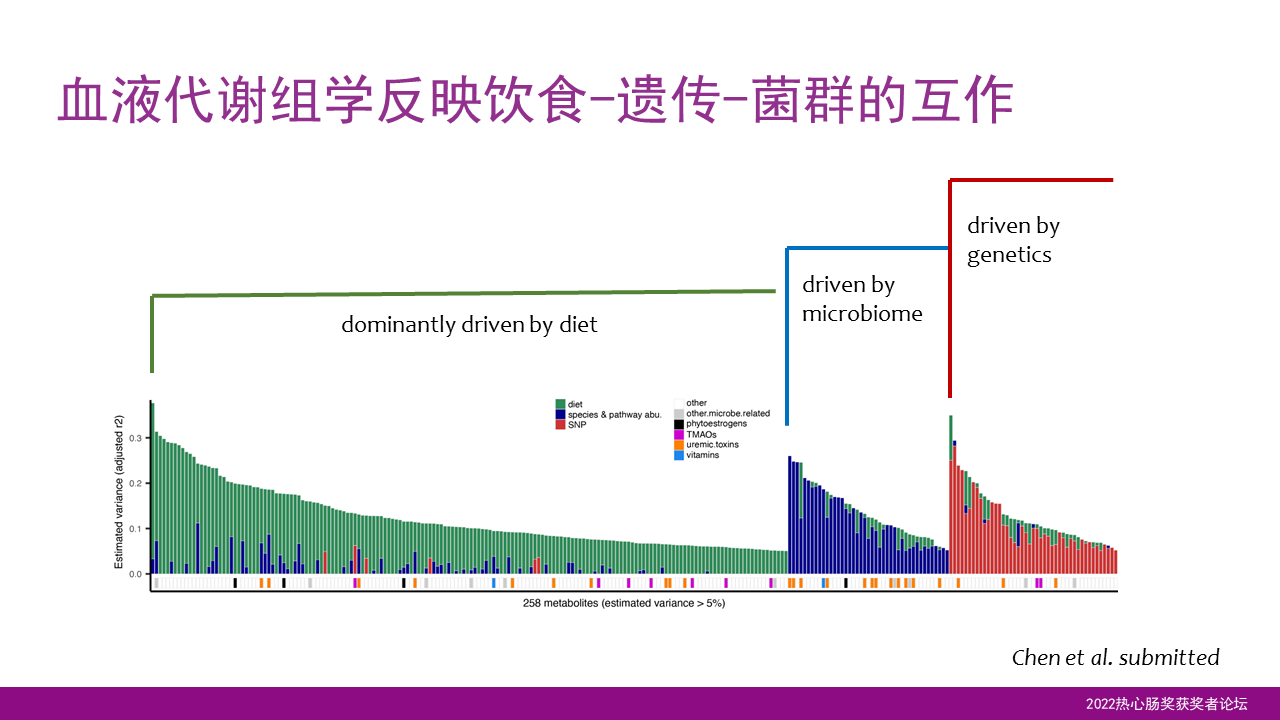
首先关于代谢,我们通过系统性的血液代谢组学研究,发现了血液的代谢物反映了我们饮食、遗传和菌群的相互作用。
我们发现一些代谢物主要是由你的饮食决定,你吃什么直接影响到代谢物的水平。另外一些代谢物的水平则取决于我们的肠道菌群,或者取决于我们的遗传基因。
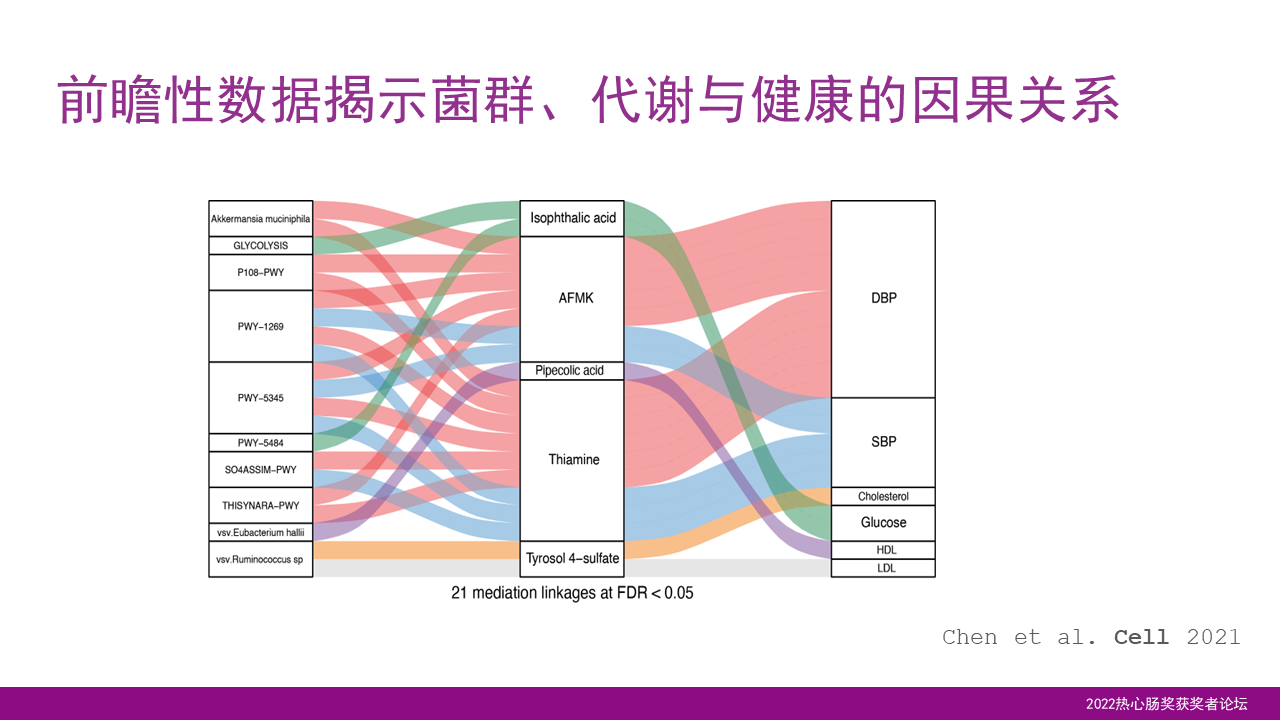
利用了前瞻性的数据,我们可以进一步地揭示菌群、代谢和健康的一个因果关系。也就是说利用数据模型的方式,我们可以揭示,菌群发生的变化会引起血液中一些代谢物的水平发生变化,从而影响了人体的血压、血脂和血糖的水平。
我们还可以进一步利用菌群基因组学的一些结构变异,解释一些基因的片段通过缺失或者说是存在着不同的复制。结合化学信息学的一些方法,可以发现肠道菌群中参加人体代谢的一些潜在的新的代谢酶,比方说我们研究确认一些新型的脂肪酸代谢酶。

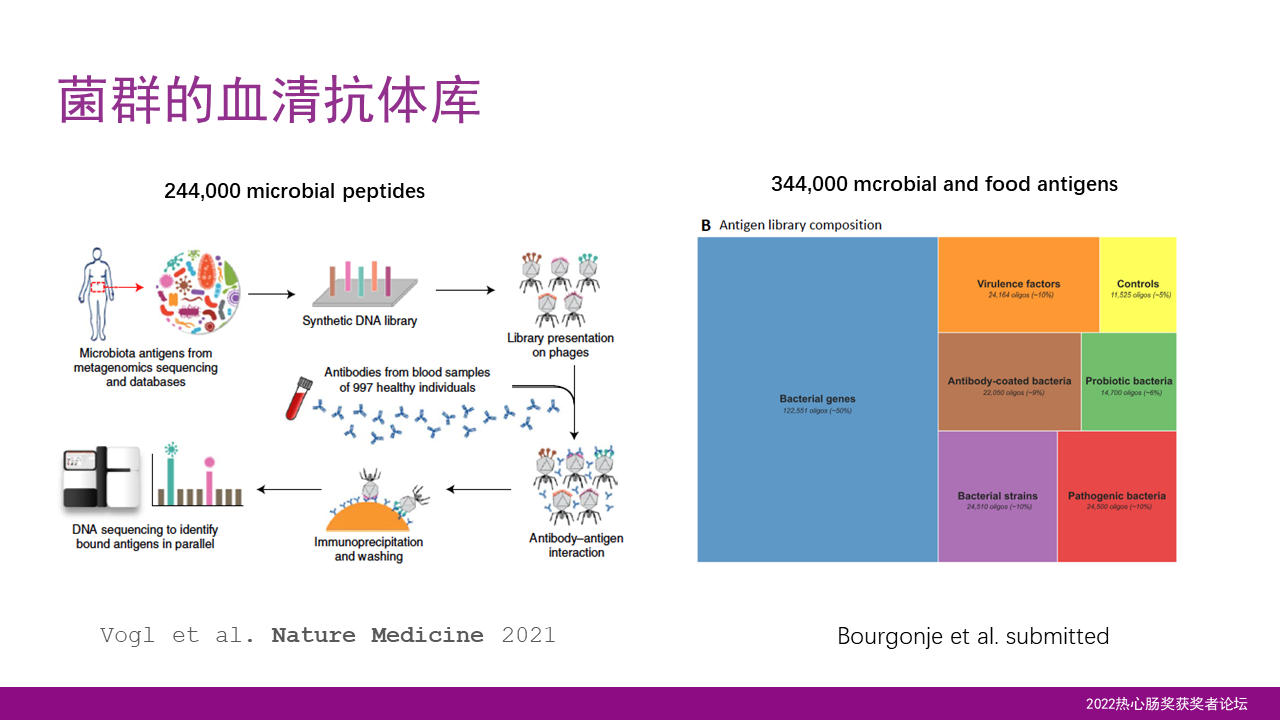
除了代谢物,肠道菌群也会产生一种各种各样的蛋白链,从而引起了宿主的免疫反应。以色列Eran Segal的团队近期构建了一个含24万多种的菌群产生的多肽抗原的合成库,利用噬菌体免疫沉淀反应的测序方法,可以系统性地分析人体对菌群的血清反应、抗体反应。
前期我们与Eran Segal的合作,已经揭示了血清抗体的群体多样性和稳定性。近期这个抗原库又扩充到了34万多种的多肽,不光包含了来自于细菌、病毒的多肽,也包含了很多来自于食物的多肽,可以让我们研究对食物的一些免疫反应。
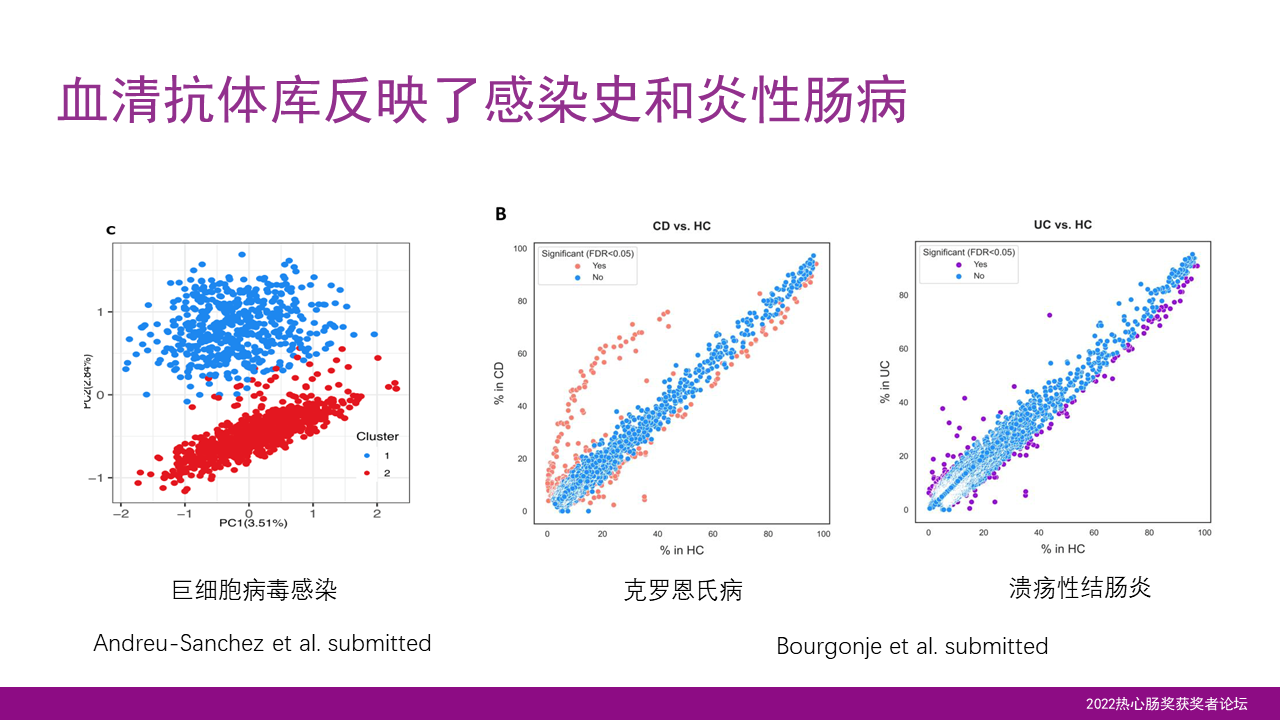
我们可以发现,血清的抗体库可以反映我们以往的一些感染史。比如说我们发现大概50%的荷兰人曾经感染过巨细胞病毒,在中国人群中,这个感染率可能甚至会更高。
通过抗体库,我们也可以发现一些疾病特异性的抗体。比方说我们发现一些抗体是克罗恩病特有性的,而在溃疡性的肠病中却比较少见。

另外,当然免疫反应离不开我们宿主基因型的作用。通过遗传分析,我们也可以发现多个遗传位点可以影响菌群与免疫的相互作用,包括发挥重要免疫功能的HLA的位点。
通过队列、大数据、多组学的一些研究,我们对菌群的可能作用机制有了一定的设想,这些设想当然还需要进一步的实验验证。但是动物模型存在着很多的局限性,因此我们迫切需要一个能够反映人体生理机制的体外模型,这也是为什么近些年器官芯片技术开始蓬勃发展。
我们也希望结合这一技术,可以了解人类基因组、宏基因组的关联性和相互作用,从而了解菌群对人体健康的一些作用。因此,我们利用了来自于美国Emulate公司的芯片。
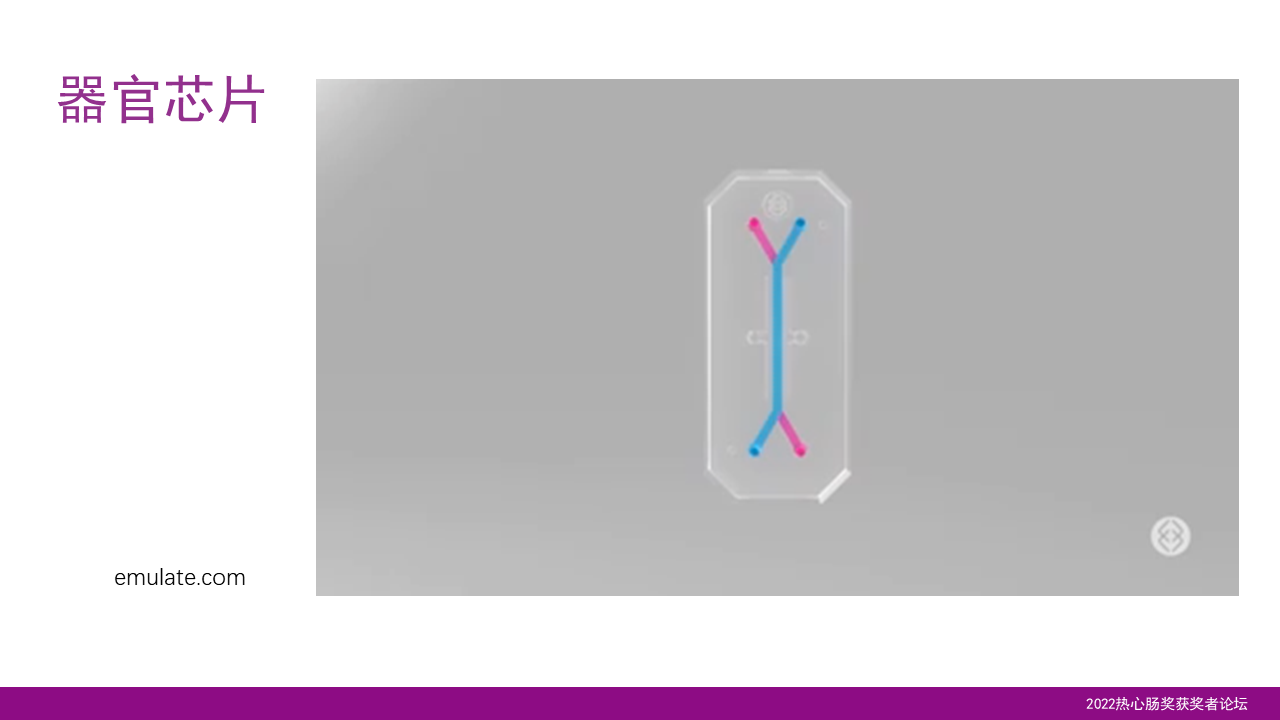
很多人可能还不太了解这一芯片技术,由于我的研究目前侧重于代谢方面,所以我以肝芯片为例来介绍一下。
Emulate的芯片大概分为上下两个通道,中间以一个可以拉伸的聚合物横膜来进行分离。而膜的上方可以覆盖肝脏芯片,膜的下方则覆盖肝脏特有的内皮细胞,同时肝巨噬细胞、星状细胞可以分布在膜的上下层,这样就可以模拟肝脏的多细胞结构。
上下的通道有微流量,上通道就传递营养和细胞培养液,而下通道就模拟了一个血液的环境。这样的一个芯片就模拟了一个肝脏的结构,可以用于药物、营养和各种肝病的研究。
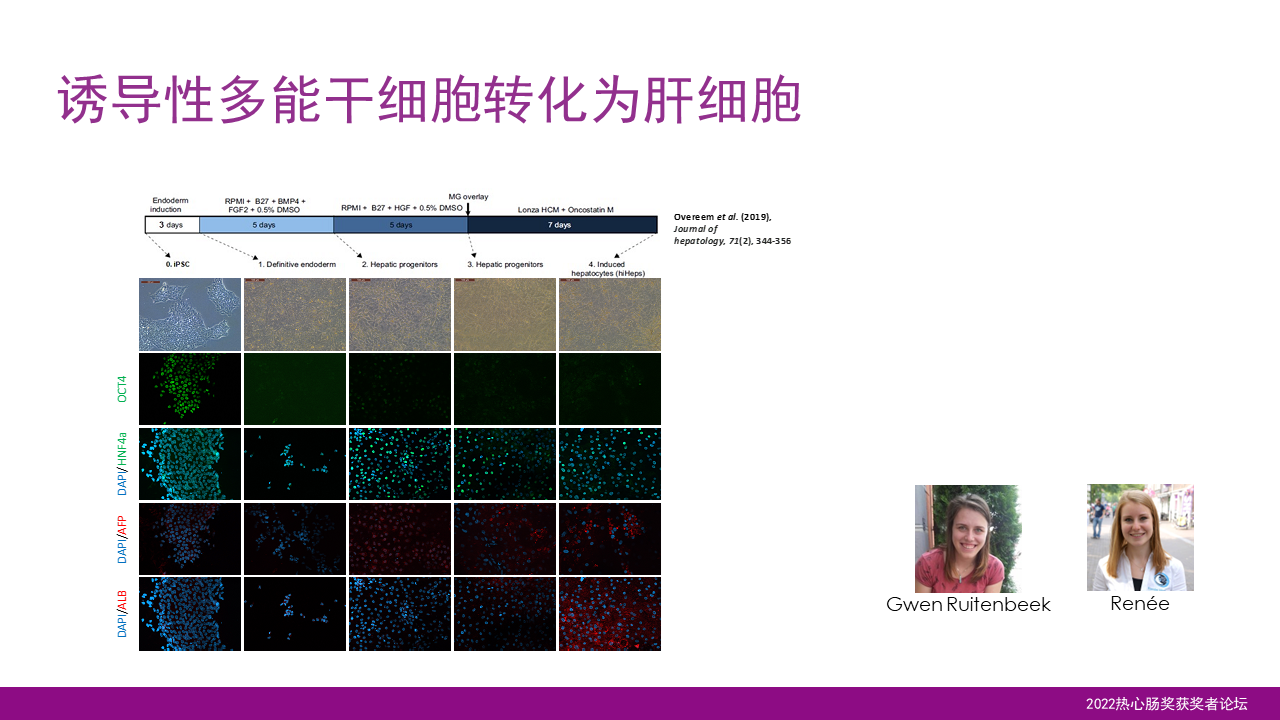
由于我们希望能够用于个体化的医疗研究,因此希望构建一个个体化的私人定制的芯片,特别是希望能够反映每个人的基因型。因此在我们的研究当中,我们将诱导性多能干细胞与芯片技术相结合。
首先,我们实现了诱导性多能干细胞对肝细胞的一个转化。你可以发现随着转化的过程,干细胞的特征逐渐消失,而肝细胞的一些特色逐渐变得明显起来,包括HNF4α的表达以及白蛋白的产生。

实现了这一技术了以后,我们也进一步地将这一转换在芯片的环境上进行实施。这样的话,我们就可以得到诱导性干细胞形成的肝细胞在芯片的上层通道定植,同时也可以发现肝细胞特有性的HNF4α的表达以及白蛋白的产生,都主要体现在芯片的上层通道。
另外我们系的Withoff博士领导的研究小组,也完成了基于诱导性干细胞的肠芯片的构建。这个视频从上到下展现了肠的上皮细胞在芯片上形成了一个肠凸结构,完全模拟了一个肠的三维结构。
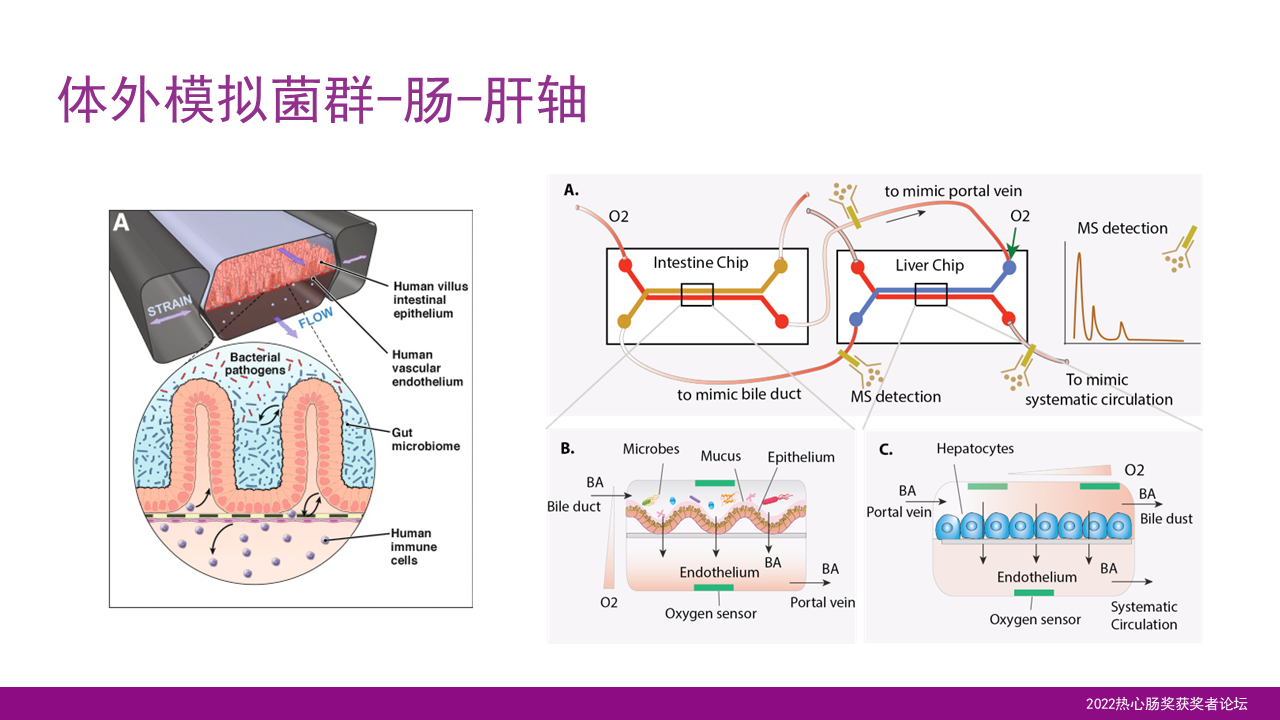
最后,我们希望在肠芯片上形成菌群的共同培养,并且与肝芯片相结合,从而模拟菌群-肠-肝轴。

最后我要感谢热心肠研究院、各位老师朋友和同仁们的支持,也感谢Groningen研究团队和各基金会研究机构对我们研究工作的支持,希望有机会与大家多多合作、共同进步。
感谢聆听!


