尽管细菌是单细胞生物,但是它们早已学会通过合作来获得更大的生存优势。然而,细菌中也会出现一些摸鱼者,试图不劳而获。那么如何抑制摸鱼者规模的扩大,维持合作呢?
今天,我们共同关注细菌之间的合作。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
人们通过观察研究复杂生物体(如昆虫、非人类灵长类动物和人类)了解社交行为。但多伦多大学的生态和进化生物学家Megan Frederickson对一个与众不同的微观社会群落感兴趣,它就是细菌。
她说:“合作无处不在。细胞在多细胞生物体内部相互合作,个体在集体社会内部相互合作,甚至不同的物种之间也存在合作。那么为什么(你会认为)细菌之间就不存在合作呢?”
早在20多年前,研究者就已经知道细菌会参与集体活动,比如形成生物膜以及从环境中获取营养等。但这并不意味着每一个细菌都会遵守规则,参与合作。偶尔也会出现一些浑水摸鱼的细菌(这类细菌被称为“cheaters”,在本文中译作摸鱼者)。
Frederickson说,“摸鱼”发生的条件是必须产生一种适应性策略。“摸鱼者需要从不合作的状态或者不像其他个体间那样合作的状态中获得适应性优势。”另外,摸鱼者也必须从合作状态的祖先细胞中演变而来。她说,“我们应该保留‘cheating’这一词汇,用其指代合作状态的破裂。”
摸鱼者通过消耗可共享的资源来利用其他细菌的工作成果,这些资源对细菌个体来说生产成本很高,但对整个群体来说是有益的1。在细菌群体中这些公共资源有很多种形式,包括形成生物被膜的胞外多糖、降解抗生素的酶或者应对匮乏环境的营养清除分子(nutrient scavenging molecules)2。
但是细菌是如何成为摸鱼者的呢?与人类不同,细菌并非故意摸鱼。苏黎世大学的进化生物学家Rolf Kümmerli说:“这些个体丢失了某个基因或者某个蛋白不再正常发挥功能,这也是它们停止生产社会性资源成为摸鱼者的原因。” Kümmerli致力于研究细菌如何分享代谢物,如酶和铁营养清除分子的研究。
在掌握这些知识后,研究人员可以操纵细菌的遗传物质以更好地了解“摸鱼”行为。比如,他们可以敲除生产共享代谢物的基因,以在实验室中创造进行摸鱼行为的突变体。然后他们可以将生产者和摸鱼者一起共培养,测量它们的相对适应性,即两个菌株的生长速率比。如果某种资源是生长所必需的,那么在共培养的培养基内,摸鱼者应该超过生产者,因为它们消耗了共享资源,却没有支付生产资源所需的代谢成本。
这种细菌之间的军备竞赛出现在很多共享化合物中。比如,通过使用机会致病菌铜绿假单胞菌,科学家们发现摸鱼者可以利用铁营养清除分子铁载体3,以及消化营养物质的蛋白酶4,5。
另外一个可利用的成分是降解抗生素的酶。研究人员用大肠杆菌进行了实验,大肠杆菌通过产生β-内酰胺酶来抵抗β-内酰胺类抗生素。不产生这些酶的突变体在与酶的生产者共存于一个生物膜时,能容忍更高剂量的氨苄西林(β-内酰胺类抗生素的一种)更长时间6。
对很多科学家来说,一个让他们很感兴趣的问题是,当摸鱼者存在于自然或疾病环境中时2,是什么使细菌继续合作?Frederickson说:“这真的很有趣,为什么我们没有频繁地观察到产生更多的摸鱼者。我们看了很多细菌合作例子,大多数时候,它们之间的合作并不会因摸鱼者的出现被破坏。”

细菌群落中的摸鱼者从合作者中获益。
一个能部分解释这种合作现象的思路是频率依赖性选择。根据这一观点,当群落中存在较多合作者且很少有摸鱼者时,就会出现摸鱼者基因型。如果摸鱼者的基因型变得更加频繁,那么生产者的比例可能会减少,以至于摸鱼者不再是一种适应性策略,从而导致这种基因型被筛选掉。
此外,合作者使用不同的策略来优化公共资源的使用,并减少摸鱼者对它们的获取。
其中一种方法是空间结构化,即细菌群落的三维排列。乔治亚理工学院研究微生物互作和社会行为的分子微生物学家Steve Diggle说:“空间结构是摸鱼者无法到处乱跑的最简答案。”
在现实世界中,细菌往往被组织成密集的生物膜,这是一种紧密的多细胞结构,有利于合作。生物膜帮助合作者彼此靠近,并通过其粘性成分限制共享资源的扩散。
Kümmerli的研究小组在实验室条件下复现了一个生物膜环境,以证实这一概念。通过在粘稠的生长培养基中培养铜绿假单胞菌的生产者和非生产者突变体,研究人员发现铁载体的有限扩散导致生产者群体的适应性增加7。
空间结构也有助于细菌保持它们的亲缘关系,而亲缘关系则有利于合作。都柏林三一学院的进化生态学家Siobhán O'Brien说:“关联性显然是社会互动的一个真正的关键驱动因素。因此,一般来说,互动伙伴之间的亲缘关系越亲,就会选择更多的合作,因为这些合作基因是在合作者和接受者之间共享的。”
这个观点被称为亲缘选择,解释了为什么一个不直接有利于个体的特征在一个细菌群体中可能会受到青睐,在这个群体中,一个细菌很可能被具有类似遗传背景的细菌所包围。通过帮助一个邻近的细菌,细菌可以确保它的基因能传给下一代。
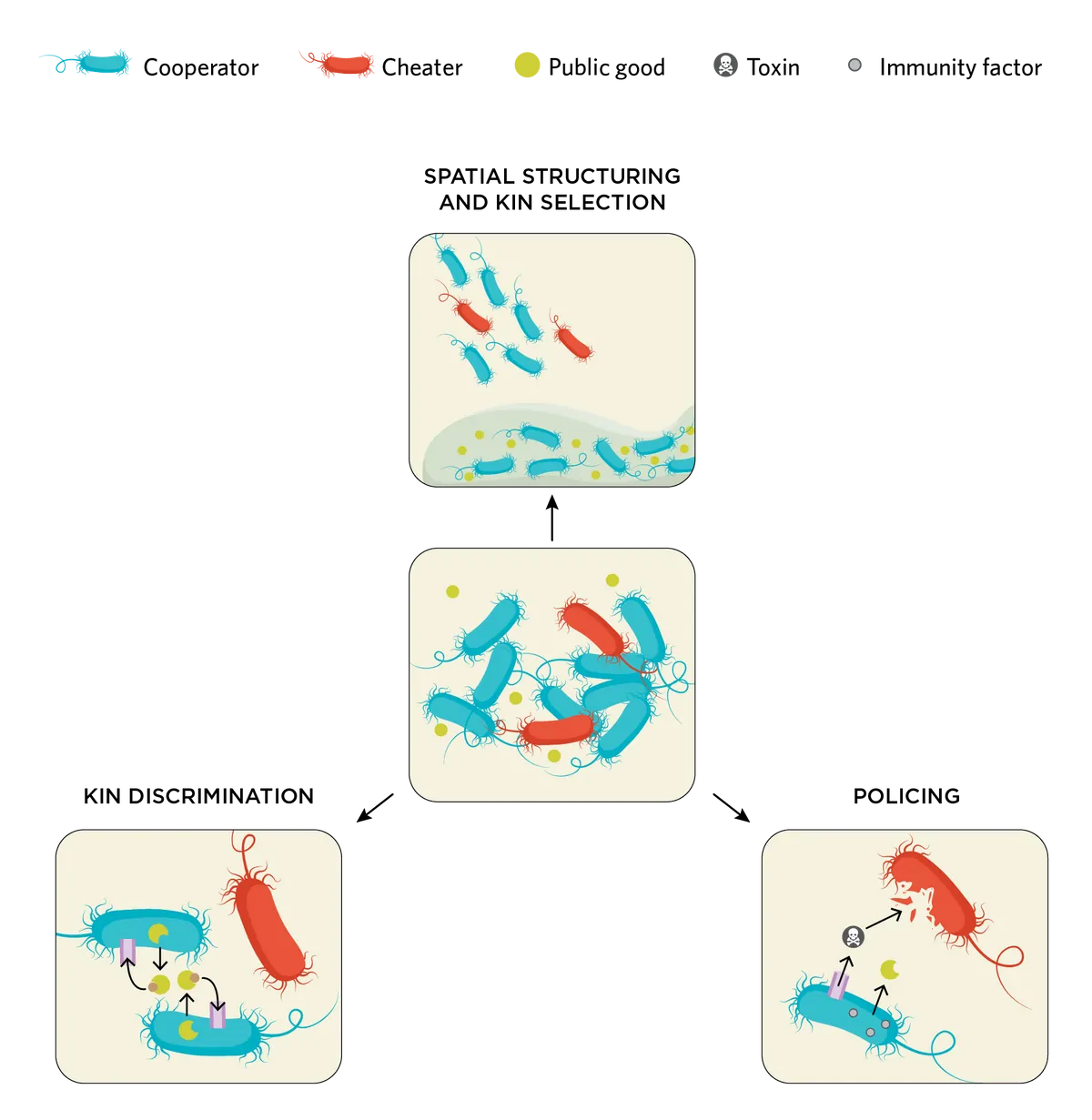
合作者用于抑制细菌群落中摸鱼者数量的策略。
合作者为尽量减少摸鱼者数量采取的另一种方法是将公共资源只提供给它们的亲缘细菌。O'Brien说:“某些共享资源非常特殊,它们只能被拥有正确受体的细菌所吸收,而这通常意味着它们具有菌株特异性。如果同时存在一种进化关系较远的同种不同菌株,它们就不会表达正确的受体以吸收共享资源。”
铁载体pyoverdine就是一个特别好的例子,在自然群落中,研究者证明了某些pyoverdine生产者会分泌无法共享的pyoverdine,非生产者不能使用,这表明这些摸鱼者缺乏接受这些分子所需的受体8。
区分亲缘细菌和非亲缘细菌也使合作者能够通过监督摸鱼者来直接制裁摸鱼行为。为了监管细菌群体,合作者可以生产一种能量消耗成本高的化合物,通常是一种毒素,以控制群体内摸鱼者的数量。例如,铜绿假单胞菌产生一种可共享的蛋白酶和一种毒素——氰化物。合作者可产生一种免疫因子以保护其免受氰化物的伤害,从而有选择地杀死作弊者。
作为社会性生物,细菌执行各种集体行为,使它们能够在不同的环境中茁壮成长。像其他社会性动物一样,它们也必须处理那些不合作但仍想从其他个体生产的资源中分一杯羹的个体。尽管摸鱼者会威胁到细菌的合作,但它们并没有破坏合作,因为合作者和自然选择都会控制它们的扩张。
Frederickson说:“对微生物的社会生活感兴趣是因为它们为我们探索合作如何在更大的系统中运作提供了一个很好的实验系统。”
此外,Frederickson补充说,更好地了解细菌的社会动态可能有助于我们提出新的疗法或提供用于生物控制的新思路。“我们往往认为(细菌)是简单的生物体,但它们不是。它们在这个星球上已经进化了非常非常长的时间。而且它们有能力做一些非常复杂的事情。我认为我们对它们缺乏信任。”
参考文献
(滑动下文查看)
1.West SA, Griffin AS, Gardner A, Diggle SP. Social evolution theory for microorganisms. Nat Rev Microbiol. 2006;4(8):597-607. doi:10.1038/nrmicro1461
2.Smith P, Schuster M. Public goods and cheating in microbes. Curr Biol. 2019;29(11):R442-R447. doi:10.1016/j.cub.2019.03.001
3.Griffin AS, West SA, Buckling A. Cooperation and competition in pathogenic bacteria. Nature. 2004;430(7003):1024-1027. doi:10.1038/nature02744
4.Diggle SP, Griffin AS, Campbell GS, West SA. Cooperation and conflict in quorum-sensing bacterial populations. Nature. 2007;450(7168):411-414. doi:10.1038/nature06279
5.Sandoz KM, Mitzimberg SM, Schuster M. Social cheating in Pseudomonas aeruginosa quorum sensing. Proc Natl Acad Sci U S A. 2007;104(40):15876-15881. doi:10.1073/pnas.0705653104
6.Amanatidou E, Matthews AC, Kuhlicke U, Neu TR, McEvoy JP, Raymond B. Biofilms facilitate cheating and social exploitation of β-lactam resistance in Escherichia coli. NPJ Biofilms Microbiomes. 2019;5(1):36. Published 2019 Nov 29. doi:10.1038/s41522-019-0109-2
7.Kümmerli R, Griffin AS, West SA, Buckling A, Harrison F. Viscous medium promotes cooperation in the pathogenic bacterium Pseudomonas aeruginosa. Proc Biol Sci. 2009;276(1672):3531-3538. doi:10.1098/rspb.2009.0861
8.Butaitė E, Baumgartner M, Wyder S, Kümmerli R. Siderophore cheating and cheating resistance shape competition for iron in soil and freshwater Pseudomonas communities. Nat Commun. 2017;8(1):414. Published 2017 Sep 4. doi:10.1038/s41467-017-00509-4
9.Wang M, Schaefer AL, Dandekar AA, Greenberg EP. Quorum sensing and policing of Pseudomonas aeruginosa social cheaters. Proc Natl Acad Sci U S A. 2015;112(7):2187-2191. doi:10.1073/pnas.1500704112


