随着生活水平的不断提高,人们对健康的认知越来越全面。然而,特殊食品仍然处于不少消费者的认知盲区,尤其是特殊医学用途配方食品(简称特医食品)。特医食品因其作用人群特殊,起步较晚,深受社会各界广泛关注。那么究竟什么是特医食品?其特殊在哪?
今天,我们特别关注特医食品。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
特殊医学用途配方食品(foods for special medical purpose, FSMP),简称特医食品,属于特殊膳食用食品。根据国际食品法典委员会(CAC),特医食品是指“为病人进行膳食管理并仅能在医生监督下使用的,经特殊加工或配制的用于特殊膳食的一类食品。这种食品是为那些对普通食品或其中的某些营养素在进食、消化、吸收或代谢方面受限或有障碍的病人,或因病情有其他特殊的营养需求的人,或者其膳食不能仅通过改善正常膳食而必须使用特殊膳食或与两者结合而进行管理的人提供的一类食品”。
根据我国《食品安全国家标准 特殊医学用途配方食品通则》,特医食品是指“为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品” 。
特医食品的标签和说明书不得涉及疾病预防、治疗作用,不得宣称保健功能。该类产品必须在医生或临床营养师的指导下,单独食用或配合其他食品食用。特医食品不能作为药品使用,不能代替药物进行治疗。在临床营养治疗中,特医食品可作为口服营养补充剂(ONS),在患者无法通过普通食品获得足够的营养素及能量的时候,进行快速补充。部分特医食品也可作为肠内营养制剂,通过管饲的方式,为患者补充营养。
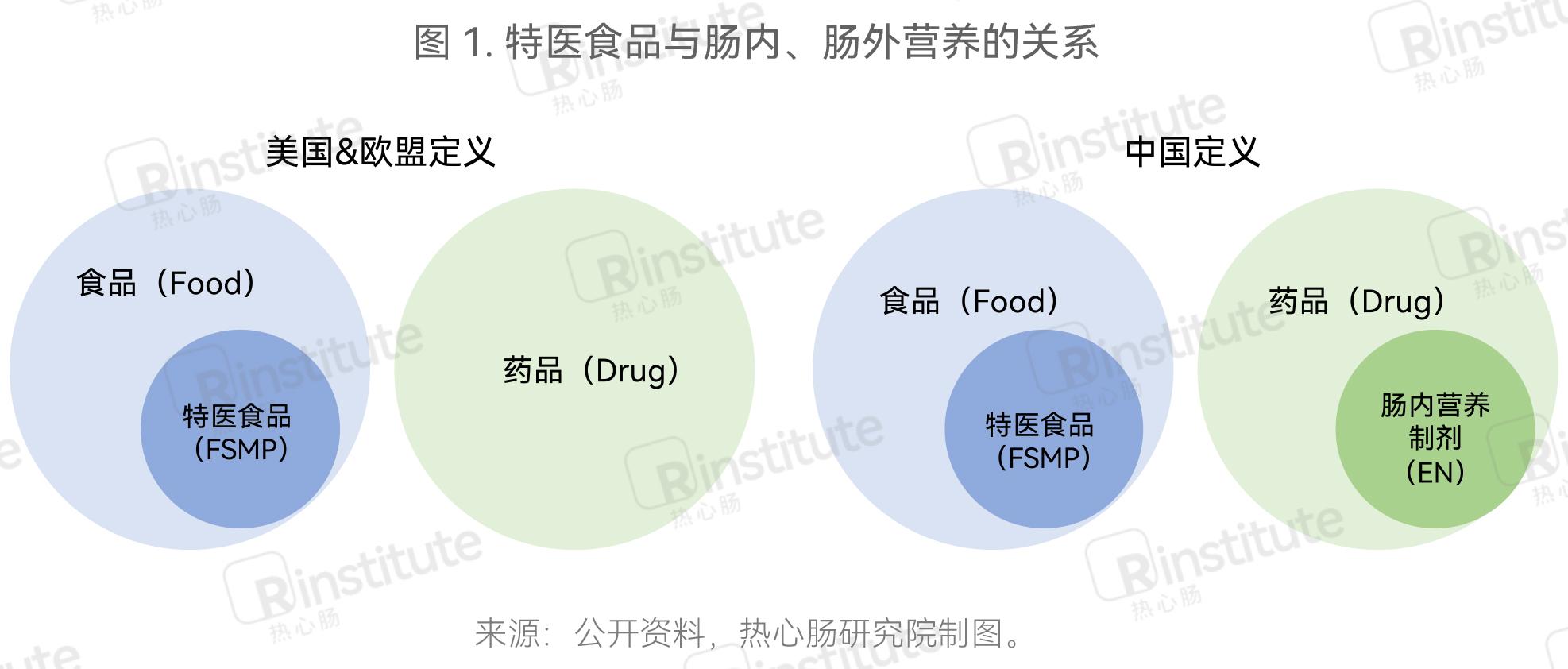
特医食品不属于普通食品、保健食品或药品,它们在定义、用途、标签标识法规、原料特点、形态、用法用量及管理方式上都有着区别(表1)。

肠内营养制剂指所有通过肠内营养的方式对患者进行营养支持的制剂统称,其作为为患者提供临床营养支持的药品在国内市场中流通近40年。在20世纪80年代末,市场上对于特医食品的临床需求已经出现,但中国临床营养相关的医疗体系还未完善。因此,当时特医食品以肠内营养制剂的形式进入了中国,并按照化学药品进行监管,经药品注册批准后方可上市销售。目前,我国肠内营养制剂目前依旧作为药品流通。
因此,在欧美仅有包含肠内营养制剂的特医食品,而我国特医食品产业则是由以特殊食品身份流通的特医食品和以药品身份流通的肠内营养制剂共同构成。
按照人群划分,特医食品分为适用于0月龄-12月龄的特殊医学用途婴儿配方食品(婴儿特医食品),以及适用于1岁以上人群的特医食品(非婴儿特医食品)。
适用于0月龄-12月龄的特殊医学用途婴儿配方食指针对患有特殊紊乱、疾病或医疗状况等特殊医学状况婴儿的营养需求而设计制成的粉状或液态配方食品。根据需要,还可细分为:
适用于1岁以上人群的特医食品是指为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品。根据需要可分为全营养配方食品、特定全营养配方食品,以及非全营养配方食品三个大类。

特医食品最早的发展始于50年代的美国,也就是宇航员的太空食品,包括压缩饼干、要素膳等。直到20世纪八九十年代,特医食品的概念才被引入我国,此时国外已在临床上普遍使用该类产品。
我国特医食品的发展史从二十世纪八九十年代开始,大致可以分为以下三个阶段:
1. 起步期(2010年前)
二十世纪八九十年代,由于当时我国并无特医食品相关法律,因此特医食品首先作为药品进入中国。直到2010年,我国才发布了第一部关于特医食品法规政策——《特殊医学用途婴儿配方食品通则》(GB25596-2010),确认了婴儿特医食品的定义和分类,并于2012年1月1日起正式实施。自此,我国打开了特医食品产业大门。
2. 破冰期(2010-2016年)
海外特医食品的引入和经营最终催生了国内特医行业的苏醒,2013年,我国国家卫生计生委发布了有关特医食品的3项食品安全国家标准,分别是《特殊医学用途配方食品通则》(GB29922-2013)、《特殊医学用途配方食品良好生产规范》(GB29923-2013)以及《预包装特殊膳食食用食品标签》(GB13432-2013),上述标准进一步明确了特医食品的概念、分类、研发、生产等规范要求,标志着特医食品行业步入正轨。
2015年10月1日起正式实施的新修订《中华人民共和国食品安全法》将保健食品、特殊医学用途配方食品和婴幼儿配方食品三类食品均纳入“特殊食品”,实行严格监督管理,明确了特医食品的法律地位。同时还明确由国务院食品药品监督管理部门对特医食品进行注册制管理,注册时需要提交产品配方、生产工艺、标签、说明书以及表明产品安全性、营养充足性和特殊医学用途临床效果的材料。
3. 发展期(2016 年-至今)
2016年3月10日,国家食品药品监督管理总局正式公布了《特殊医学用途配方食品注册管理方法》,并从2016年7月1日起实施。自此,特医食品的生产及应用步入了发展期,产业迎来发展新机。目前,我国采取的是最严格的特医食品注册审批办法。2019年7月1日后,特医食品都需要经过注册审批才能进入市场。除了肠外营养支持和静脉注射类产品,以往通过药品途径注册的产品均需要重新注册为特医食品,同时会失去药品和医保身份。2022年,我国市场监管总局出台《特殊医学用途配方食品指南》,并推出了“小蓝花”标识(图3)。

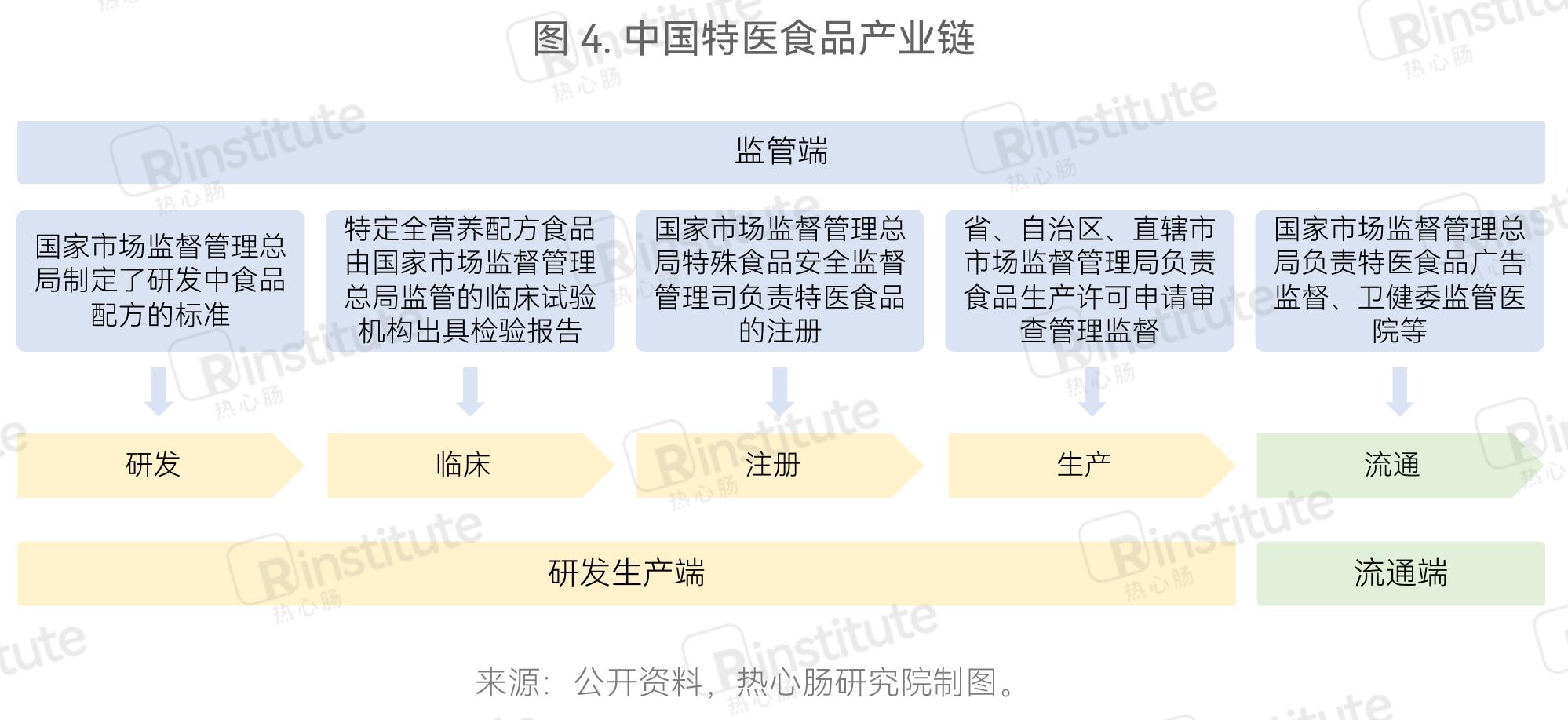
特医食品的研发生产端和流通端组成了特医食品的产业链。一款特医食品的产生需经过研发生产端的研发、临床试验、注册审批、批量生产这几个步骤后,才会流通到市场中售卖,交到消费者的手中。这每一步都有相应的机构进行监管(图4)。
1. 研发
国家市场监督管理总局制定了研发中食品配方的标准:《食品国家安全标准 特殊医学用途配方食品》(2010年)和《食品国家安全标准 特殊医学婴儿用途配方食品》(2013年)中明确规定了研发过程中的食物添加剂与营养强化剂标准,其中包括必要的13种维生素和12种矿物质的研发标准。
2. 临床
研发出的产品需经过临床验证其安全性和有效性,《特殊医学用途配方食品通则》(2013年)规定“特定全营养配方食品需要进行临床试验,由申请人委托符合要求的临床试验机构出具临床试验报告。临床试验报告应当包括完整的统计分析报告和数据。”另外,国家市场监督管理总局组织起草的《特殊医学用途配方食品临床试验质量管理规范(征求意见稿)》指出临床试验应当按照特殊医学用途配方食品临床试验质量管理规范开展。
3. 注册
国家市场监督管理总局特殊食品安全监督管理司负责特医食品的注册。材料补全期为6个月,一款特医食品研发后的产品申报注册流程一般为一年,注册流程、申请条件比食品/保健食品严格。对于特定全营养配方食品,需要提交临床试验报告,预计时间最长达到3年。
4. 生产
国家市场监督管理总局为规范特医食品的生产,在2016年出台了《特殊医学用途配方食品生产许可审查细则》,其中规范了特医食品企业的生产场所、设备设施、设备布局和工艺流程、人员管理及管理制度。
5. 流通
最后,中国特医食品通过院内和院外两条线流通:在院内,企业通过经销商将产品销往医院,经采购科购入营养科室后通过医生处方到达患者。院外则分为线上和线下两部分,其中线下包括药店、超市和母婴店等;线上,特医食品则通过第三方平台或自建渠道最终到达患者手中。
在监管方面,国家市场监督管理总局负责特医食品广告监管、卫健委监管医院等销售情况。《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法》(2019年)规定“特殊医学用途配方食品广告应当显著标明适用人群”“不适用于非目标人群使用”“请在医生或者临床营养师指导下使用”“特定全营养配方食品广告只能在国务院卫生行政部门和国务院药品监督管理部门共同指定的医学、药学专业刊物上发布”。《网络食品安全违法行为查处办法》(2017年)中第十九条规定了“特殊医学用途特定全营养配方食品不得进行网络销售”。
由此也可看出,我国对特医食品采取的监管力度较强,监管贯穿全周期。
通过特医食品对患者进行营养支持的理念不仅被医学界所接受,而且已经成为救治各种危重患者的重要措施之一。而随着人口老龄化,我国慢性疾病患者人数不断增长,特医食品的需求日益攀升。《中国食品药品监管》显示,我国至少还有50%以上的特医食品需求没有得到满足。
近年来,我国特医食品产业快速发展,平均年增速超过30%,正处于一个蓬勃兴起的时刻。随着对特医食品监管标准的不断完善,评审监管程序的不断优化,产业基础的日益夯实,我国特医食品行业有望迎来新局面。



