
大家好,感谢《肠·道》节目的邀请,让我有机会和大家分享我们关于胞外谷氨酸调控仔猪肠道健康的最新研究进展。
我的报告包括以下几个部分。
首先,来看研究背景。
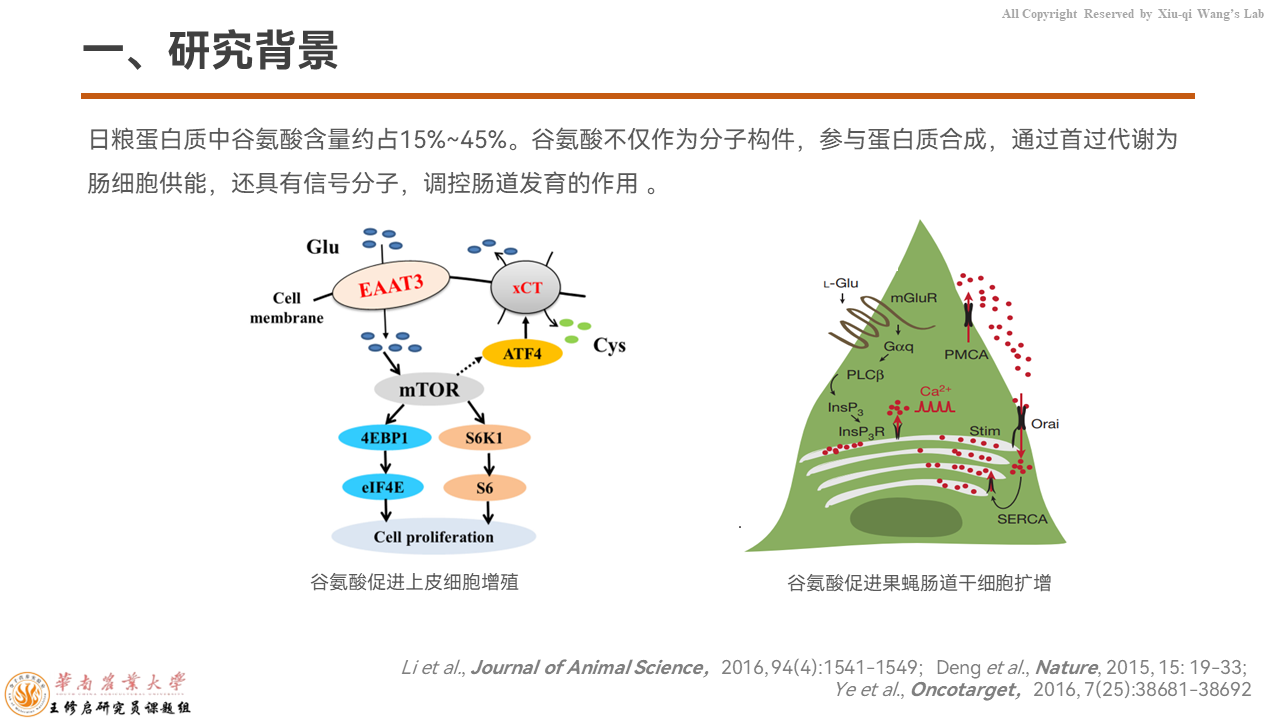
日粮中含有丰富的谷氨酸,一般我们认为,谷氨酸作为蛋白质合成的原料来合成机体蛋白质。其实在肠道,通过首过代谢为肠上皮细胞提供能量的最主要的是谷氨酸,而不是葡萄糖。
除此之外,谷氨酸还具有作为神经递质的功能。谷氨酸的功能不仅仅局限于此,它还具有作为信号分子调控肠道发育的作用,但具体的机制并不是十分清楚。
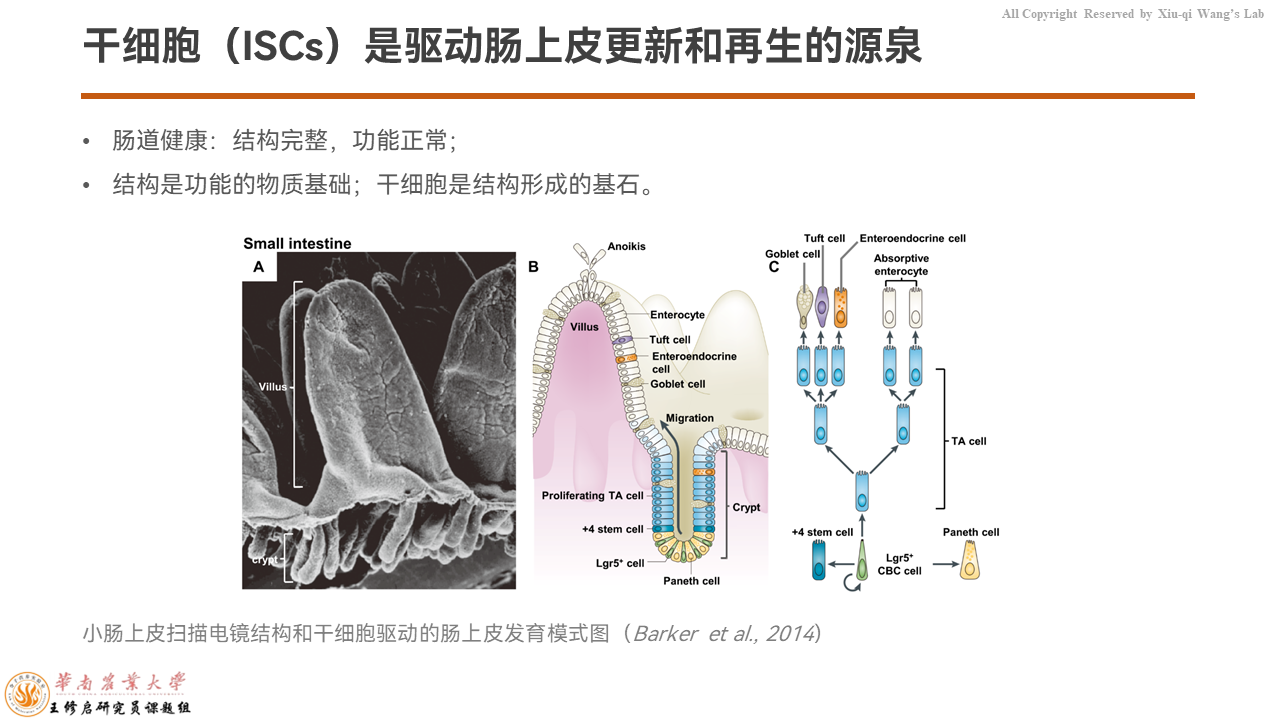
干细胞是驱动上皮更新和再生的源泉。大家都在讲肠道健康,但不同的科学家给肠道健康的定义不一样。
我认为,“结构完整、功能正常”八个字就能很好地涵盖肠道健康的概念。其中结构是功能的物质基础,干细胞是结构形成的基石。
自从2007年荷兰的Hans Clevers实验室发现位于隐窝基底部的Lgr5+干细胞之后,整个肠道干细胞的研究方兴未艾。位于基底的干细胞沿隐窝-绒毛轴不断向上迁移、增殖,分化成各种功能细胞单位,包括吸收细胞、杯状细胞、内分泌细胞、塔夫细胞(Tuft cells)等等。

基于干细胞体外培养的类器官是肠道健康研究的新兴平台。
这张图是我们分别以小鼠、猪和鸡为模型分离肠道干细胞,在体外通过三维立体培养建立起来的类器官模型,用于实验的研究工作。
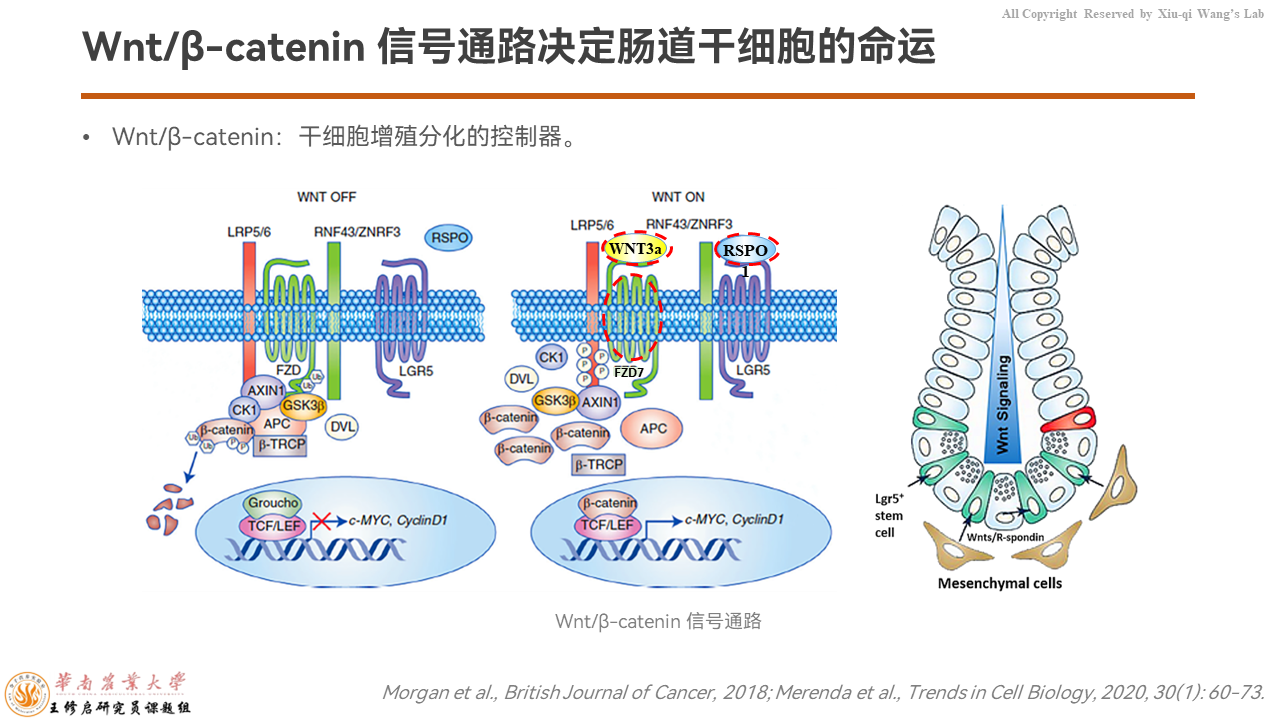
Wnt/β-catenin信号通路是决定肠道干细胞命运的控制器,包括配体Wnt3a、增强子R-spondin-1(RSPO1)以及膜受体卷曲蛋白7(FZD7),还有细胞内的GSK3β、AXIN1、β-catenin等信号组,共同调控转录因子β-catenin入核,调节肠道干细胞的活性。
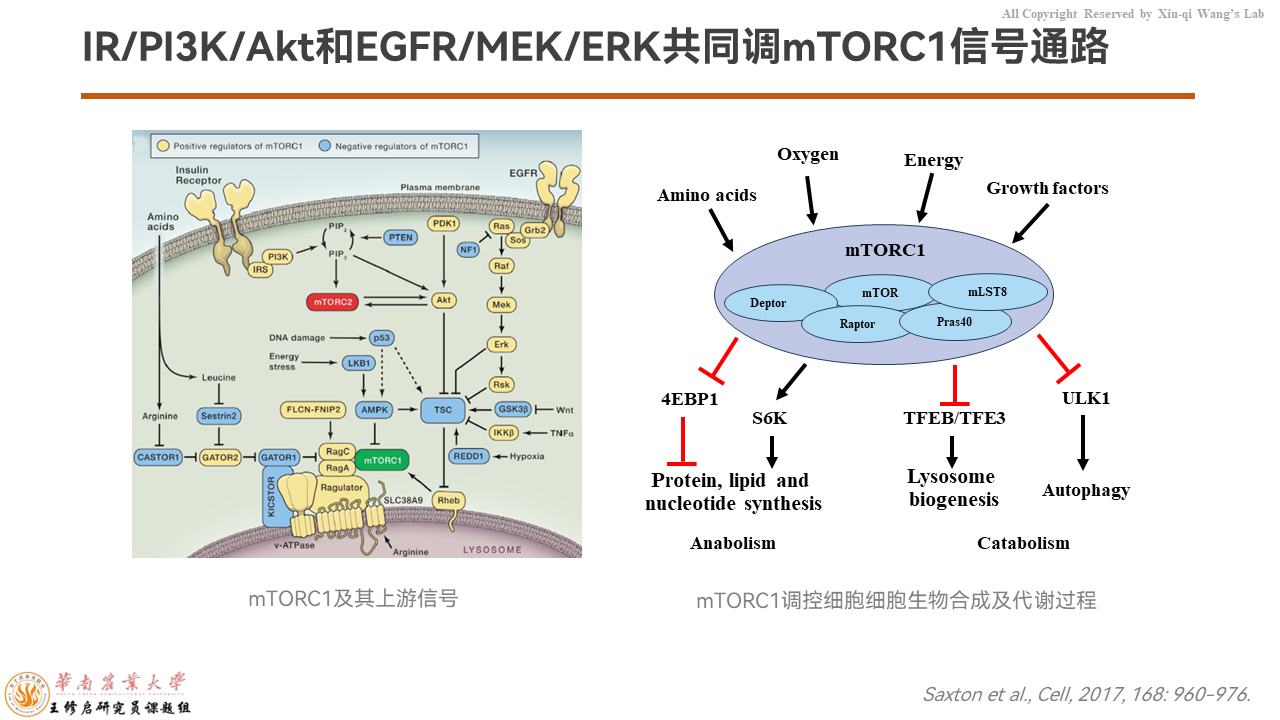
IR/PI3K/Akr和EGFR/MEK/ERK作为上游信号通路感应胞外信号分子,共同调控mTORC1信号的活性,来调控蛋白质合成、溶酶体生成、细胞自噬等等各种代谢过程。
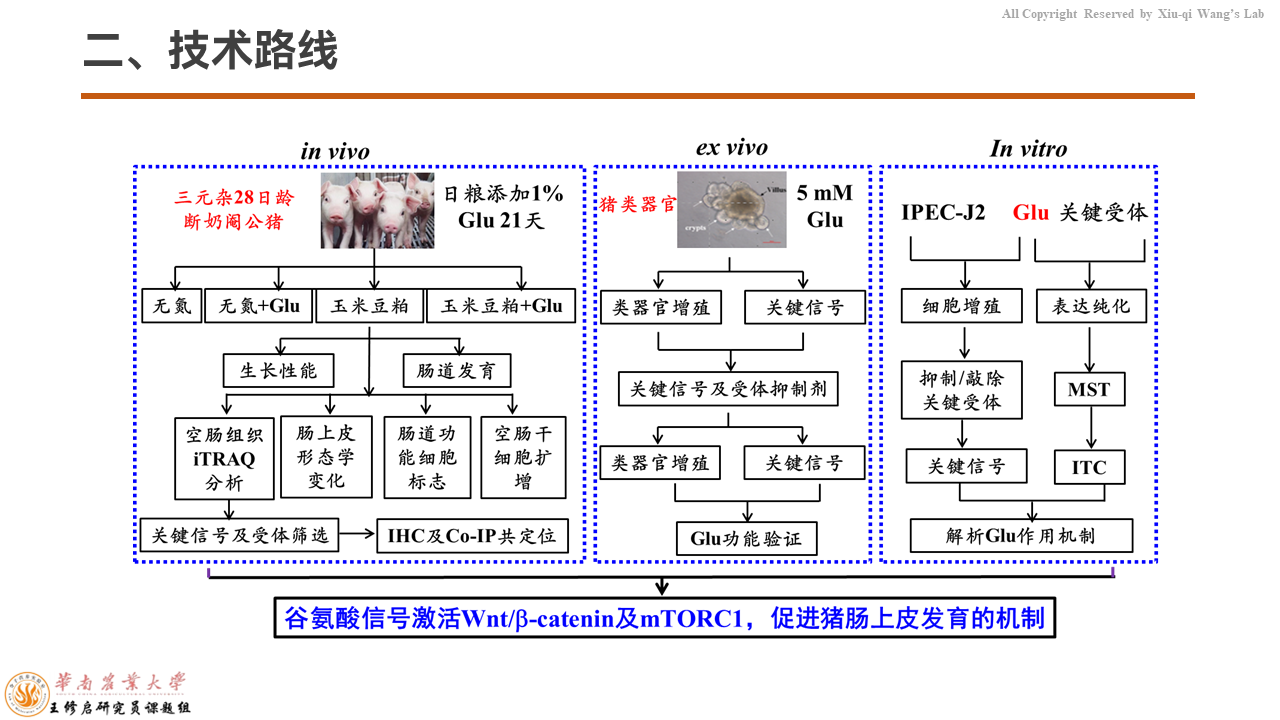
为了研究胞外谷氨酸是如何调控仔猪肠道发育,我们以断奶仔猪猪肠道类器官和IPEC-J2细胞系为材料。从体内(in vivo)、离体(ex vivo)、体外(in vitro)三个层面来研究谷氨酸信号如何激活Wnt/β-catenin和mTORC1,促进仔猪肠道上皮发育,把它的机制进行进一步的解析。

研究结果是,谷氨酸可以增加单位空肠的重量和黏膜重量。
我们可以看到,断奶仔猪,无论是无氮日粮还是玉米豆粕日粮,添加谷氨酸都可以显著增加单位长度空肠的重量以及空肠黏膜的重量。这说明谷氨酸可以促进仔猪肠道发育。
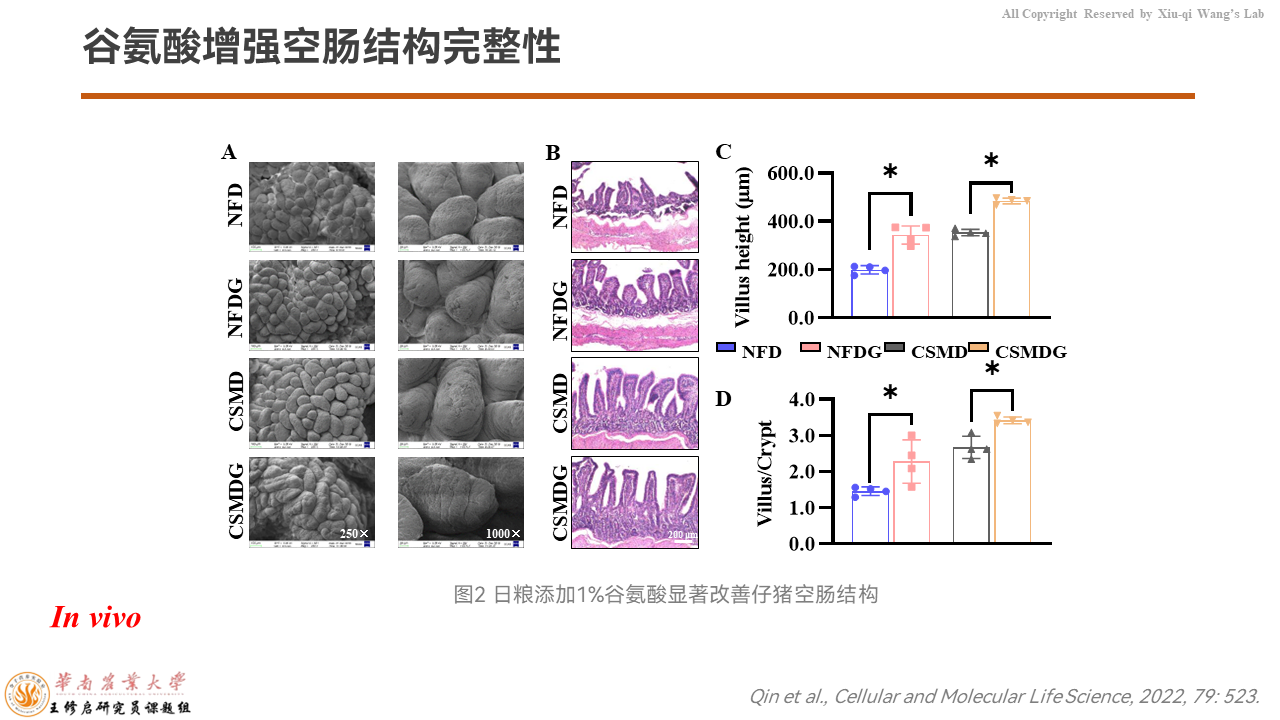
我们通过扫描电镜和HE染色发现,空肠的结构、致密性,添加谷氨酸的时候都被显著地增强,而绒毛高度以及绒毛与隐窝深度的比值也被谷氨酸提高了。
这意味着在日粮里添加谷氨酸可以显著改善仔猪的空肠结构。
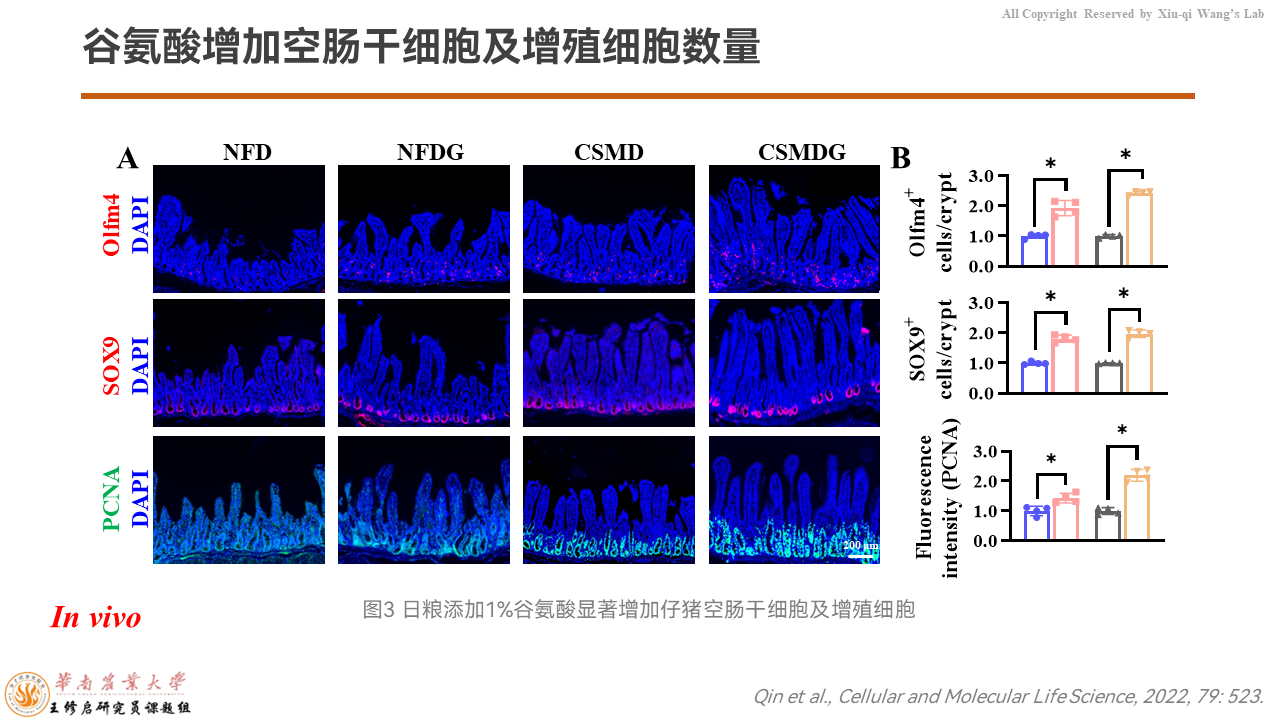
那么改善结构是由于什么引起的呢?
我们看看隐窝底部的干细胞以及增殖细胞都是怎么变化的。无论是无氮日粮还是玉米豆粕日粮,添加谷氨酸都可以显著增强干细胞的标志Olfm4、分泌型祖细胞的标志SOX9、增殖细胞PCNA的荧光信号强度。
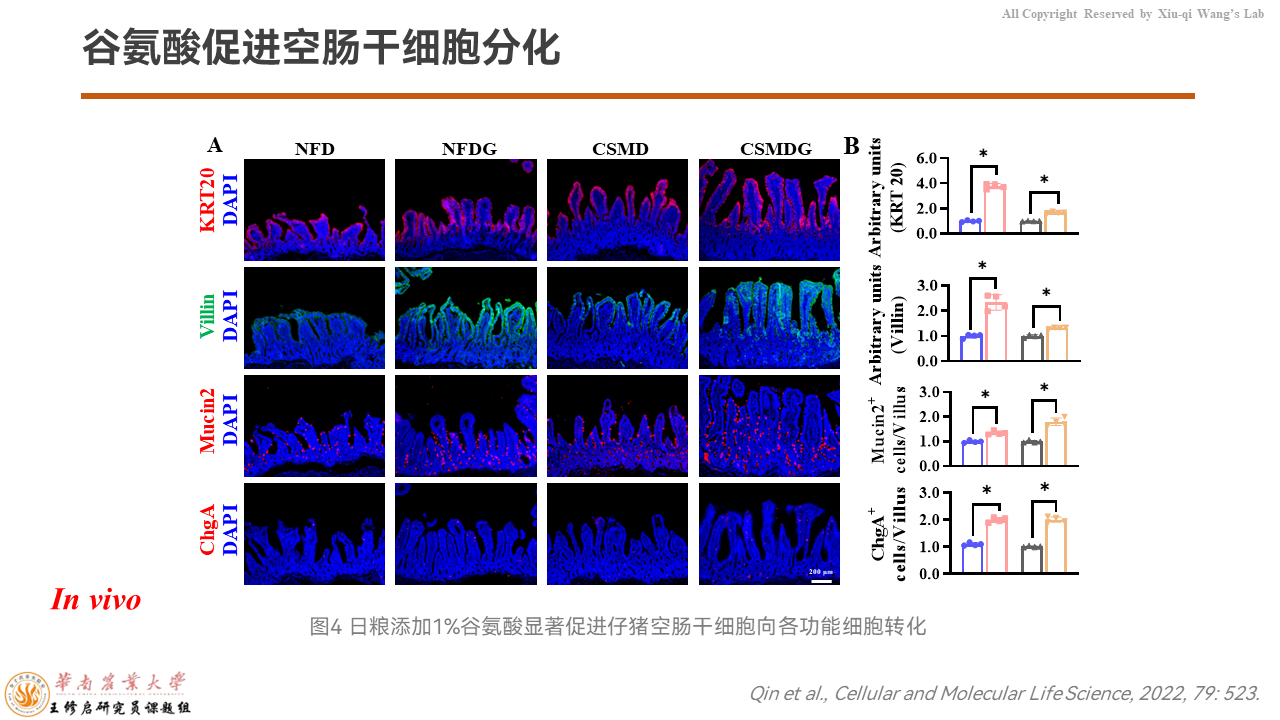
除此之外,添加谷氨酸可以增加分化细胞的标志物KRT20的荧光信号,可以增加功能细胞单位,比如吸收细胞Villin、杯状细胞Mucin2、内分泌细胞嗜铬蛋白A的表达量,促进了干细胞向各种功能细胞单位的分化。
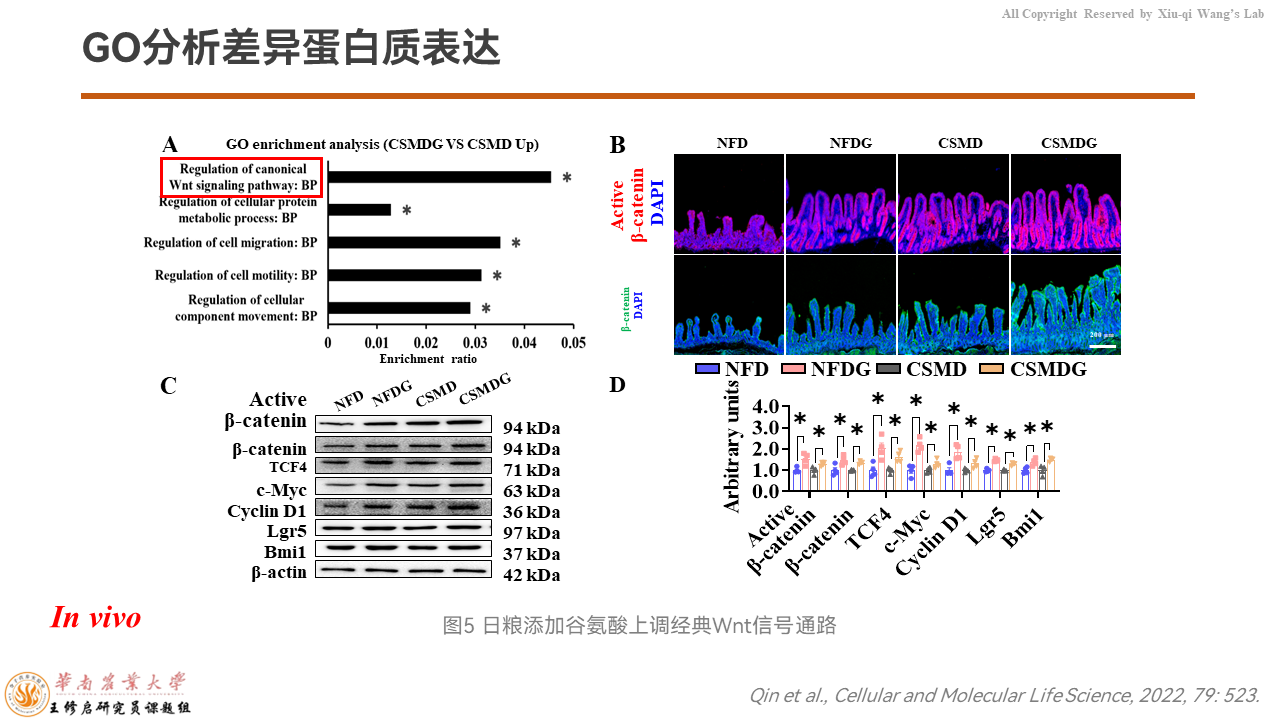
我们以iTRAQ高通量分析发现,玉米豆粕日粮添加谷氨酸可以显著上调Wnt/β-catenin信号通路。通过Western检测肠道组织的蛋白质表达量,无论在玉米豆粕日粮还是无氮日粮里边,添加谷氨酸都能够上调β-catenin及其下游Cyclin D1、Lgr5等。
IHC的结果显示,谷氨酸能够显著上调激活的β-catenin及其表达量。
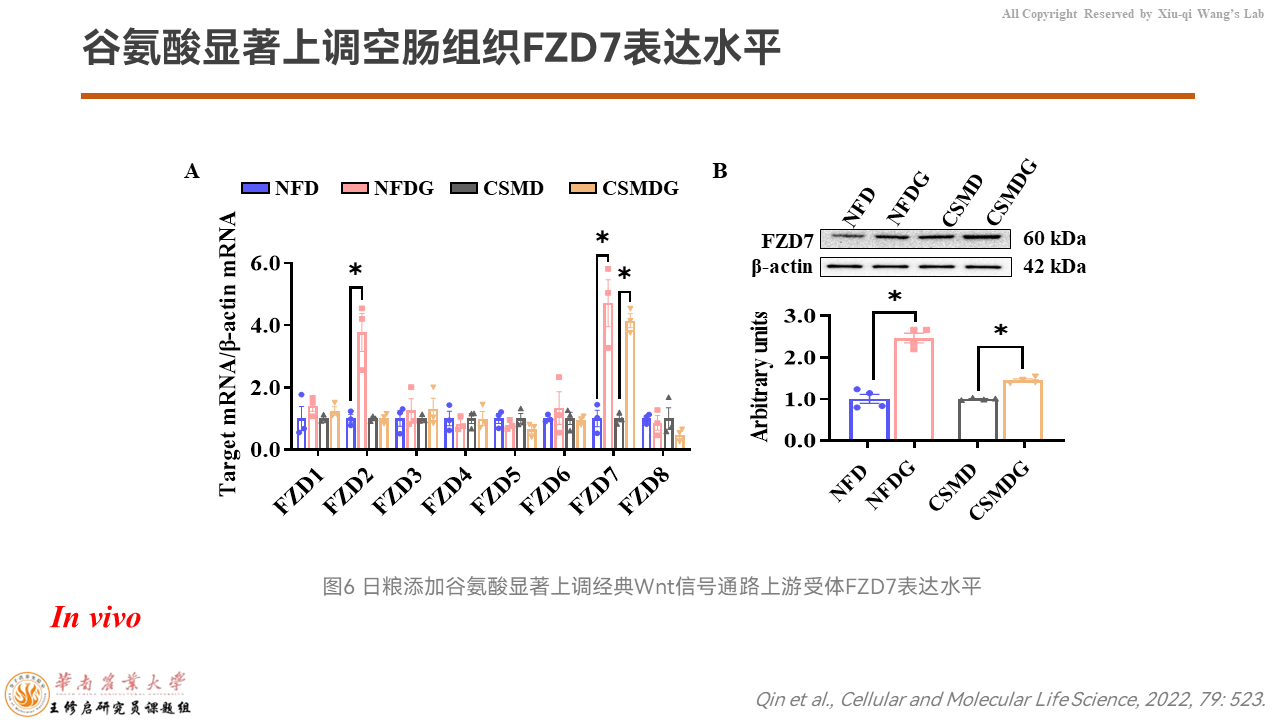
为了验证到底谷氨酸是如何激活β-catenin的信号通路,我们把细胞膜上Frizzled家族的FZD1-8这八个受体都做了mRNA丰度检测,发现只有FZD7是在无氮日粮和玉米豆粕质量里边都显著被谷氨酸上调的。
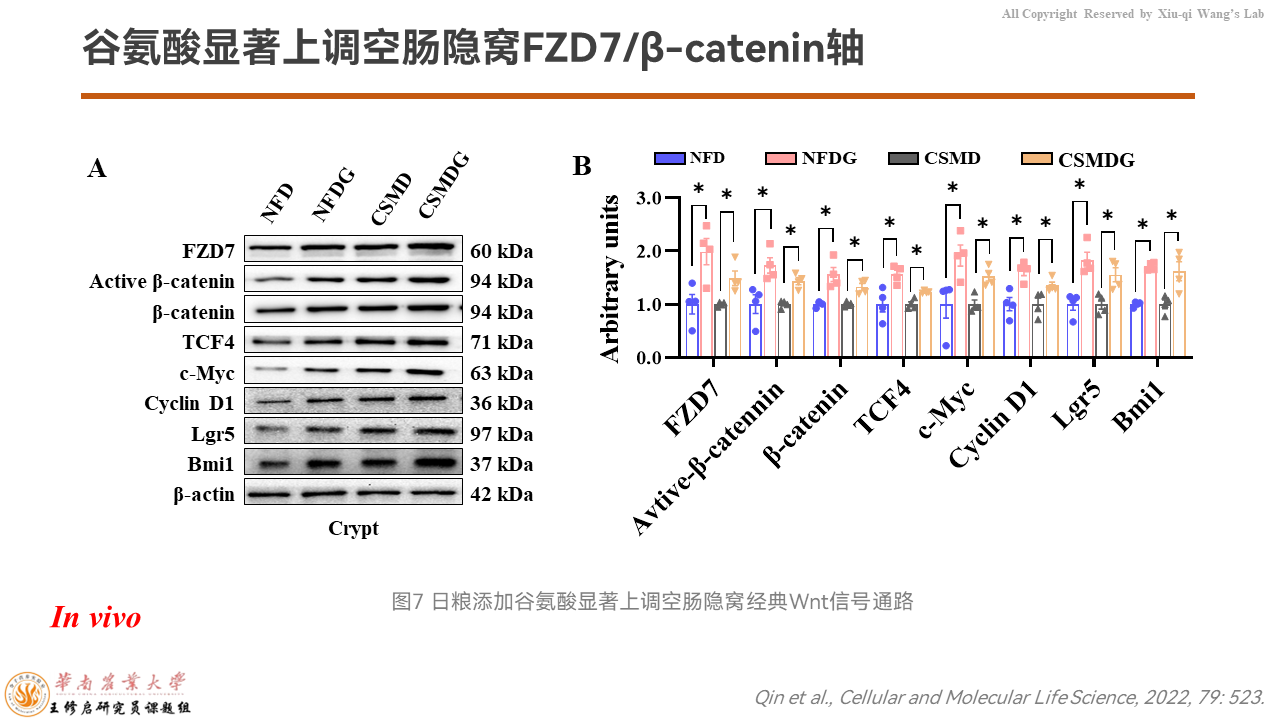
Western的结果进一步验证了,我们筛到的FZD7可能是潜在的膜受体,介导了谷氨酸的作用。
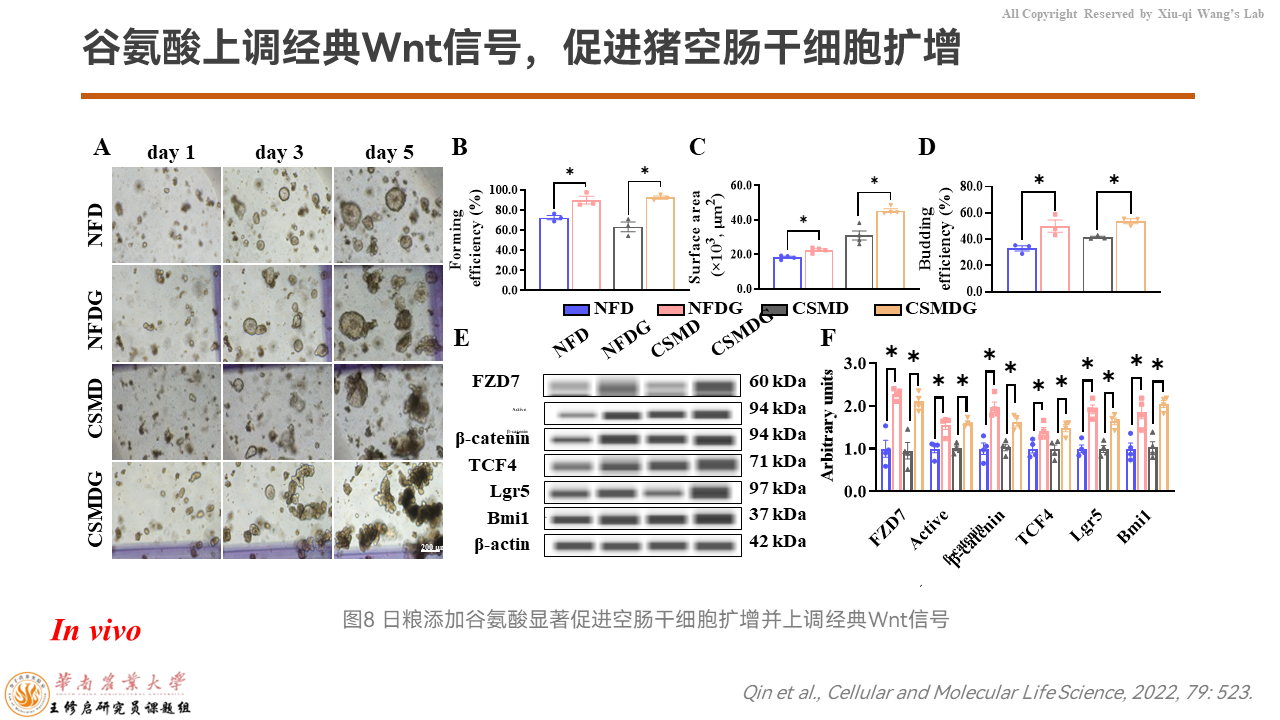
然后我们以隐窝组织为样品,Western检测发现整个FZD7/β-catenin信号通路的蛋白质表达都被谷氨酸上调了。
之后我们分离仔猪隐窝的肠道干细胞进行体外培养,发现无论是无氮日粮还是玉米豆粕日粮,类器官的生成效率、出芽效率和类器官的大小,以及通过Wes全自动蛋白质定量表达检测系统检测发现,FZD7/β-catenin信号通路都被显著的上调。
这说明谷氨酸可以促进空肠干细胞的扩增,而极有可能是通过FZD7/β-catenin信号通路的上调而实现的。
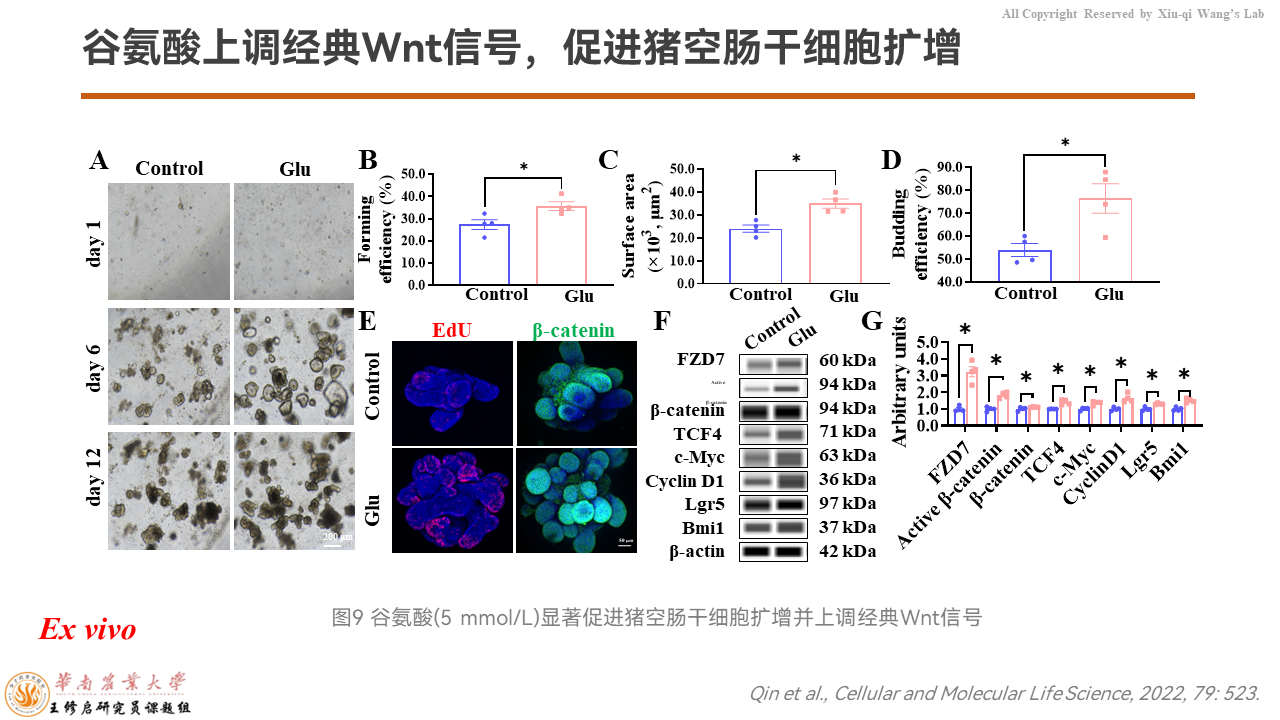
那么我们想验证FZD7是不是介导了谷氨酸来上调Wnt信号通路、促进干细胞扩增?
我们用离体类器官的模型,添加5 mmol/L的谷氨酸,发现确实是可以的。

之后我们用抑制剂Fz7-21来抑制FZD7,发现谷氨酸上调类器官生成、出芽效率和大小都被显著抑制。当然,FZD7/β-catenin信号通路也被抑制。
主要是因为在类器官上,如果我们敲除FZD7的话,类器官就不能生长,以及干细胞它不能够发芽生成类器官。
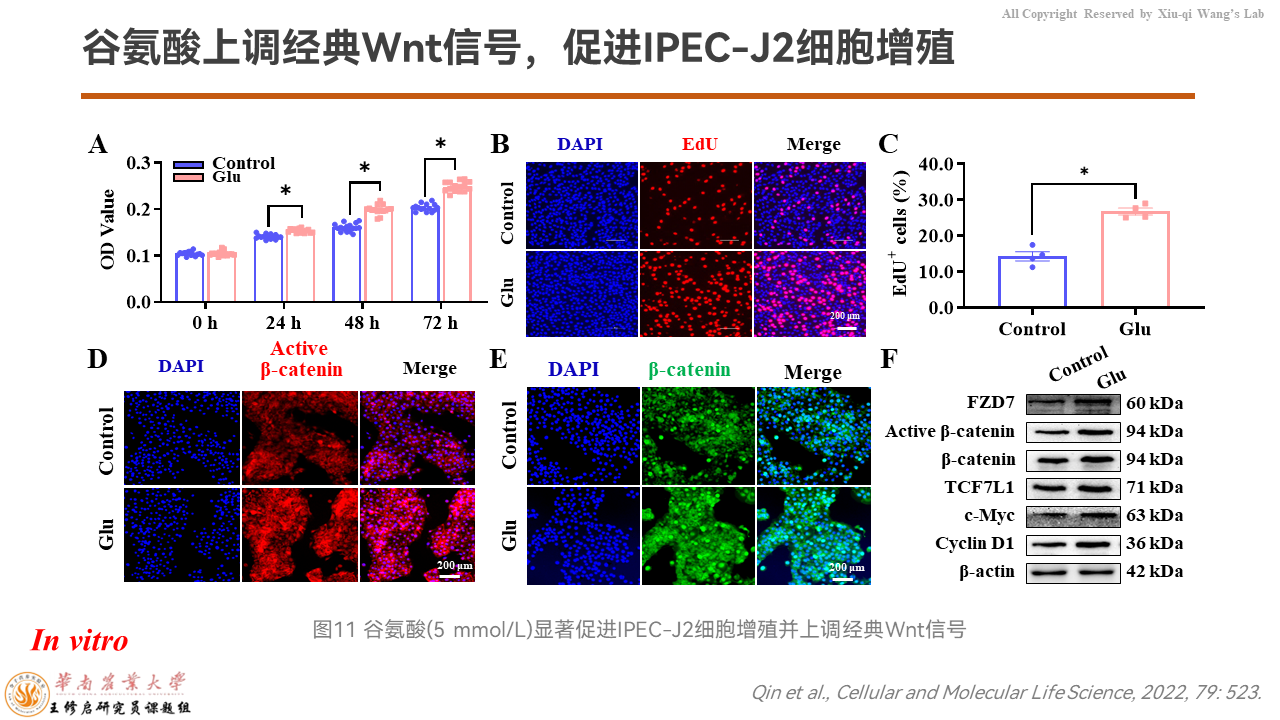
之后,我们就换做IPEC-J2的细胞模型。
在体外水平上看,谷氨酸确实能够促进IPEC-J2细胞的增殖。无论是MTT还是免疫荧光都显示,细胞增殖能力更强,而且β-catenin被显著上调。
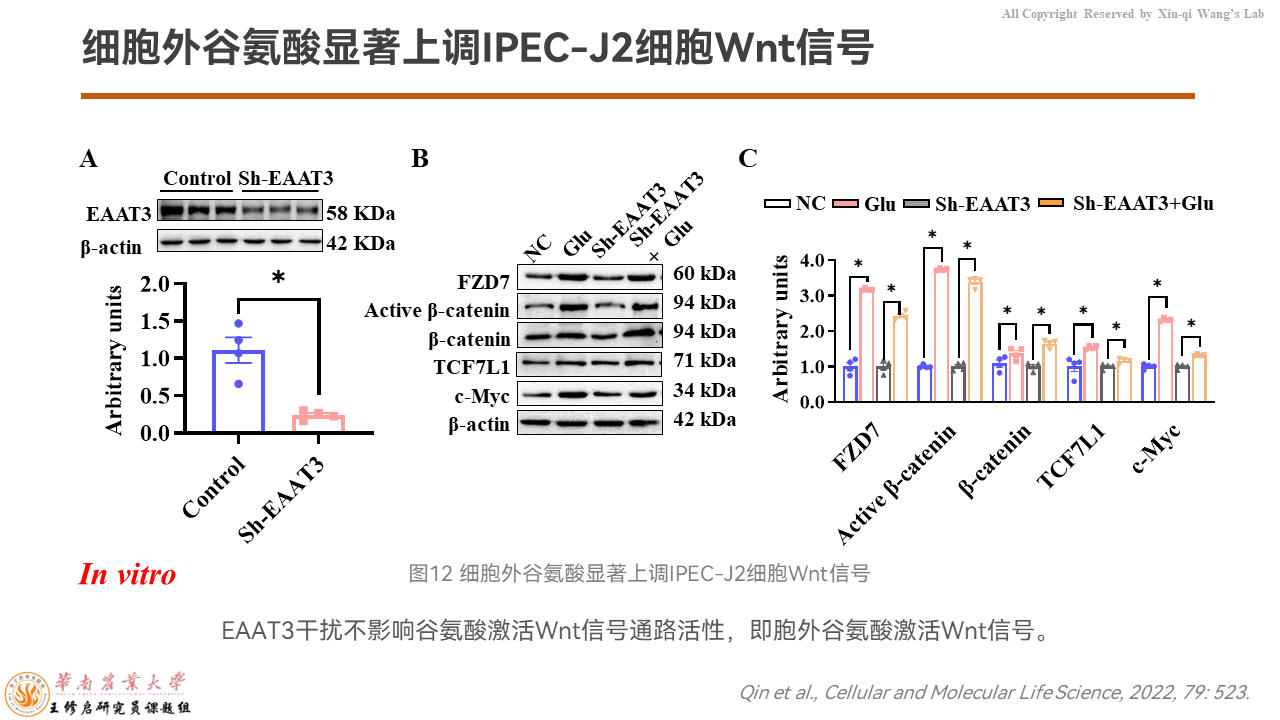
到底是胞外的谷氨酸还是胞内的谷氨酸上调了β-catenin信号通路呢?
我们把细胞膜上负责由细胞外向细胞内转运谷氨酸的转运载体EAAT3干扰掉,发现谷氨酸激活FZD7/β-catenin信号通路没有受到影响。也就是说胞外的谷氨酸激活了Wnt信号通路,而不是胞内的谷氨酸来发挥作用。
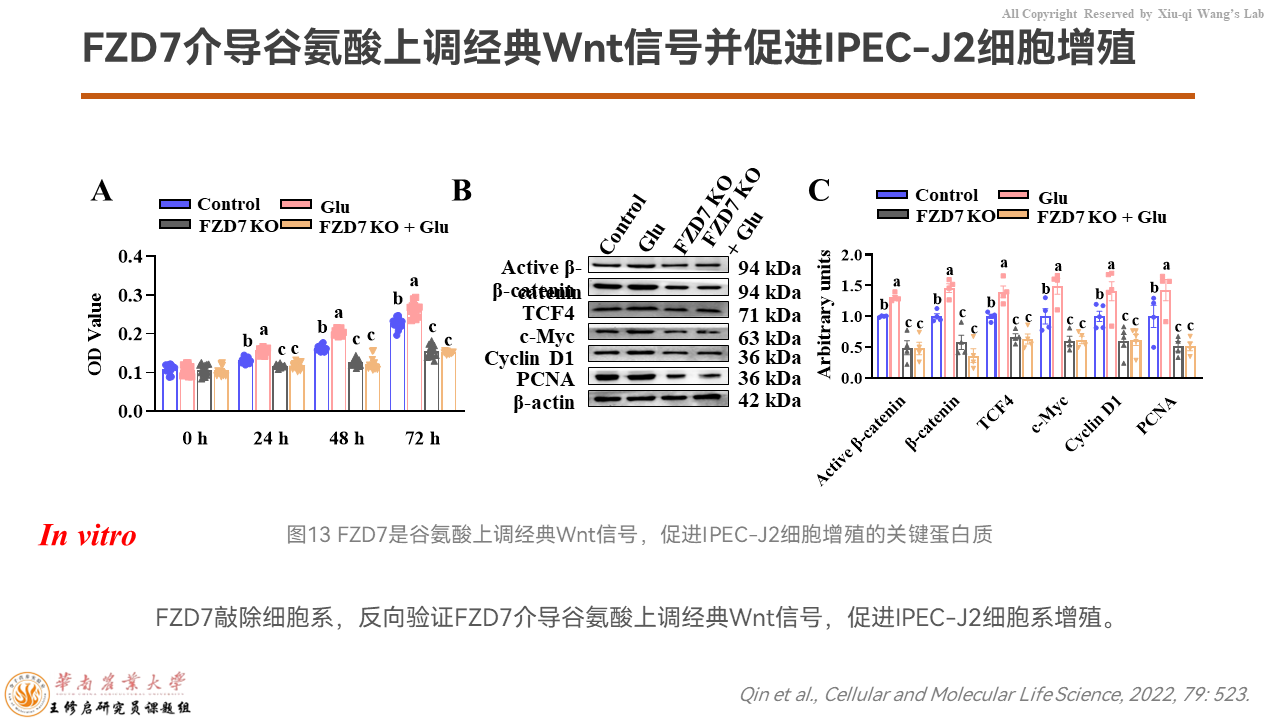
之后我们去检测谷氨酸来上调Wnt信号通路的时候,我们把FZD7在IPEC-J2细胞系完全敲除掉,发现谷氨酸上调Wnt/β-catenin信号通路、促进IPEC-J2细胞增殖的效果没有了。
这也反向验证FZD7介导了谷氨酸上调经典Wnt信号,促进IPEC-J2细胞增殖。
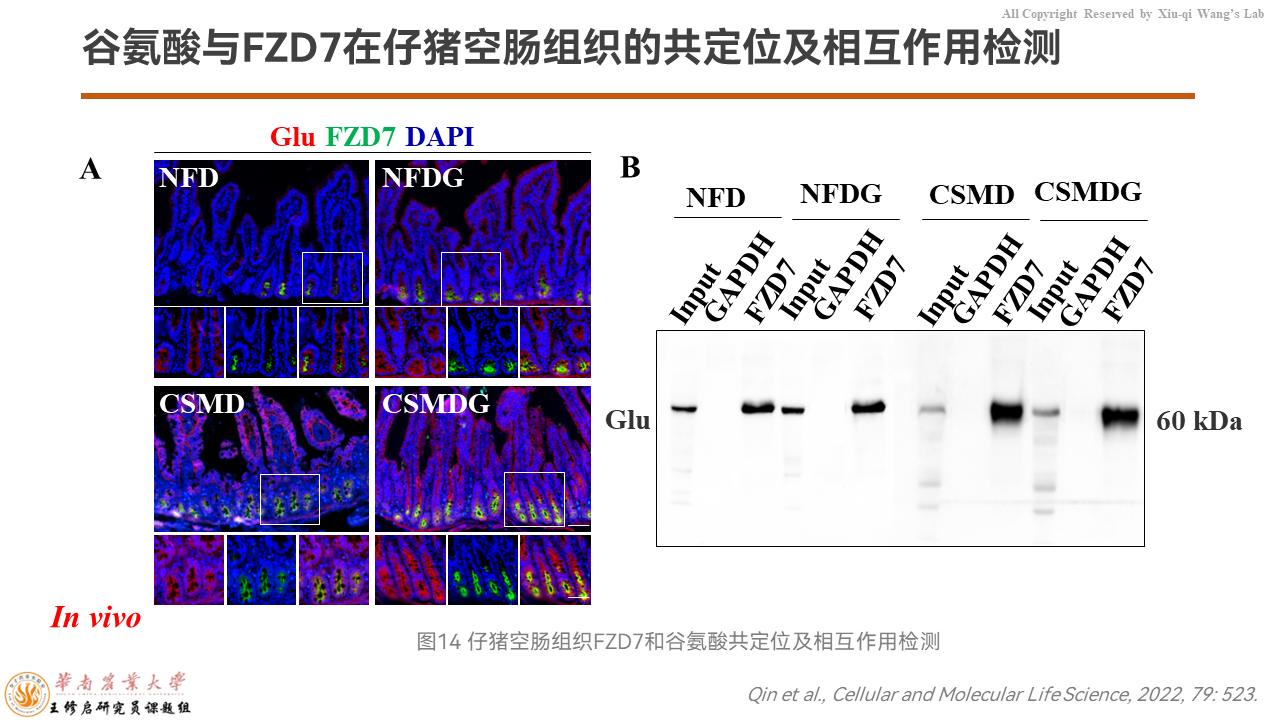
然后我们同时在仔猪的肠道组织,用谷氨酸抗体和FZD7的抗体去做了IHC的共定位。
我们发现这两个抗体在仔猪的肠道隐窝存在融合,说明它们存在互作。同时用Co-IP发现,谷氨酸和FZD7存在强的相互作用。
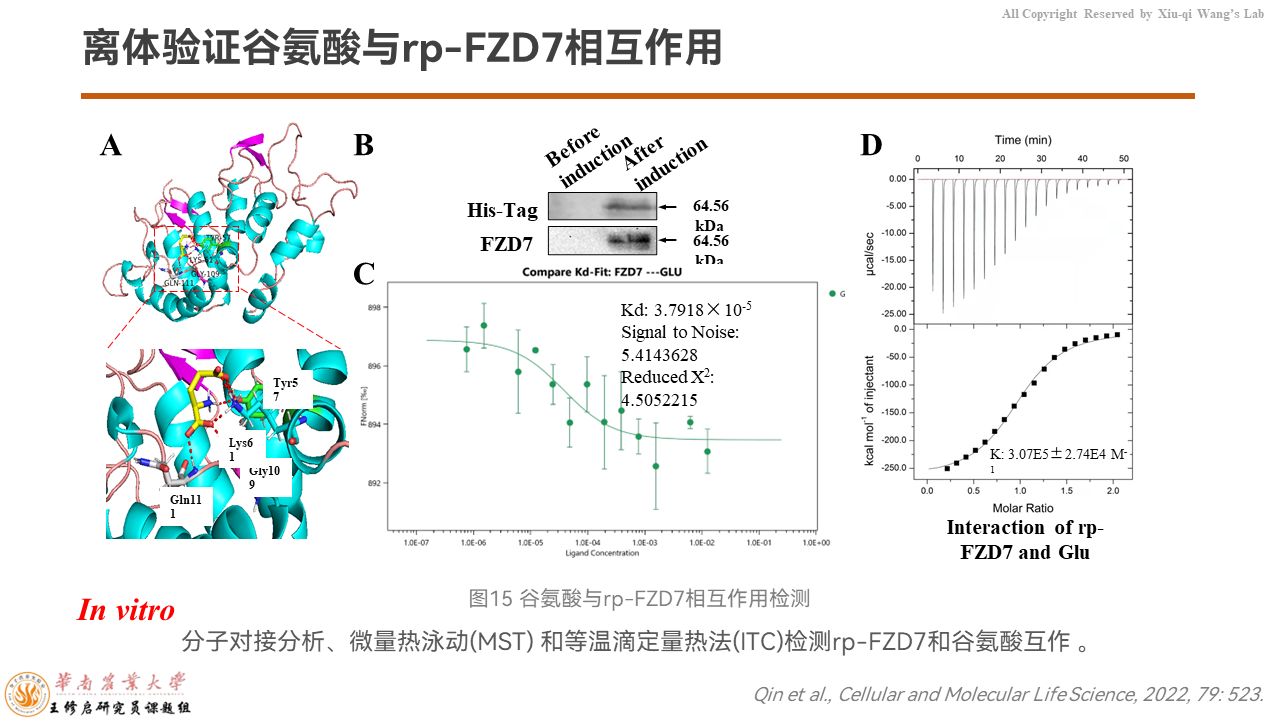
之后我们在体外的水平上,通过分子对接分析、微量热泳动和等温滴定量热法进一步验证,谷氨酸和重组的猪FZD7蛋白质存在分子互作。
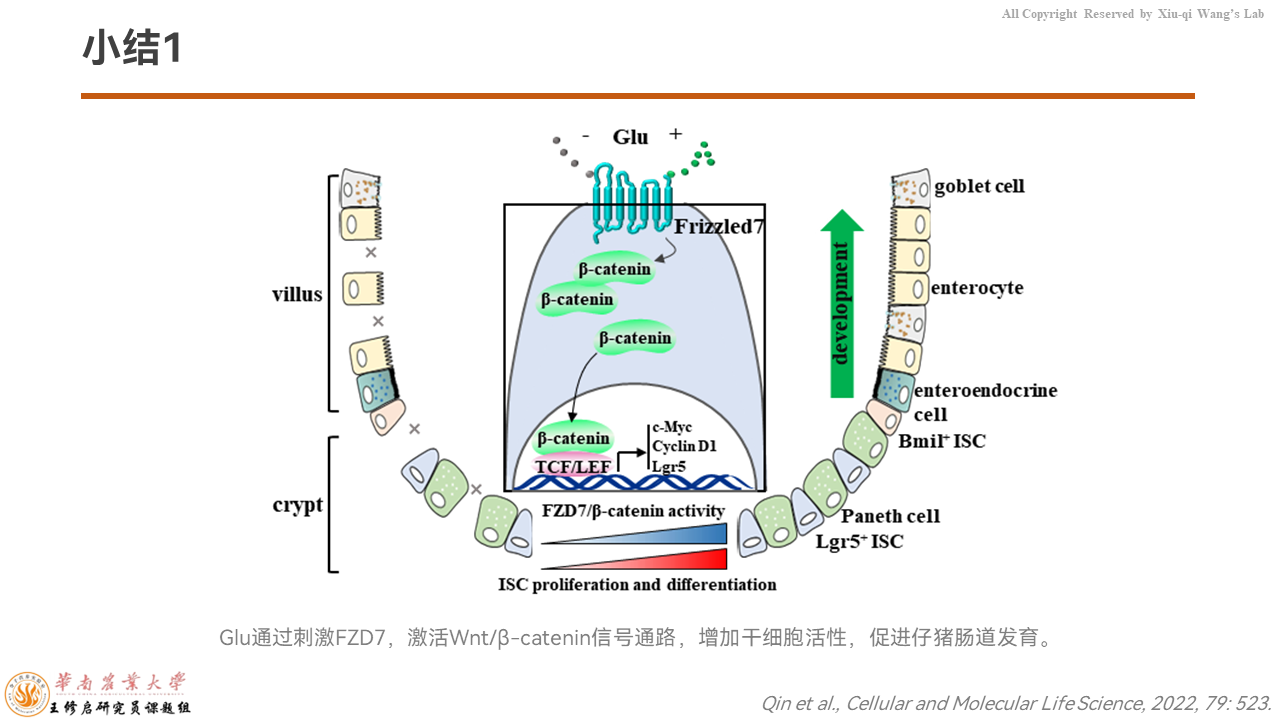
我们小结一下:谷氨酸通过与细胞膜上受体FZD7结合,激活Wnt/β-catenin信号通路,增加干细胞的活性,促进仔猪肠道发育。
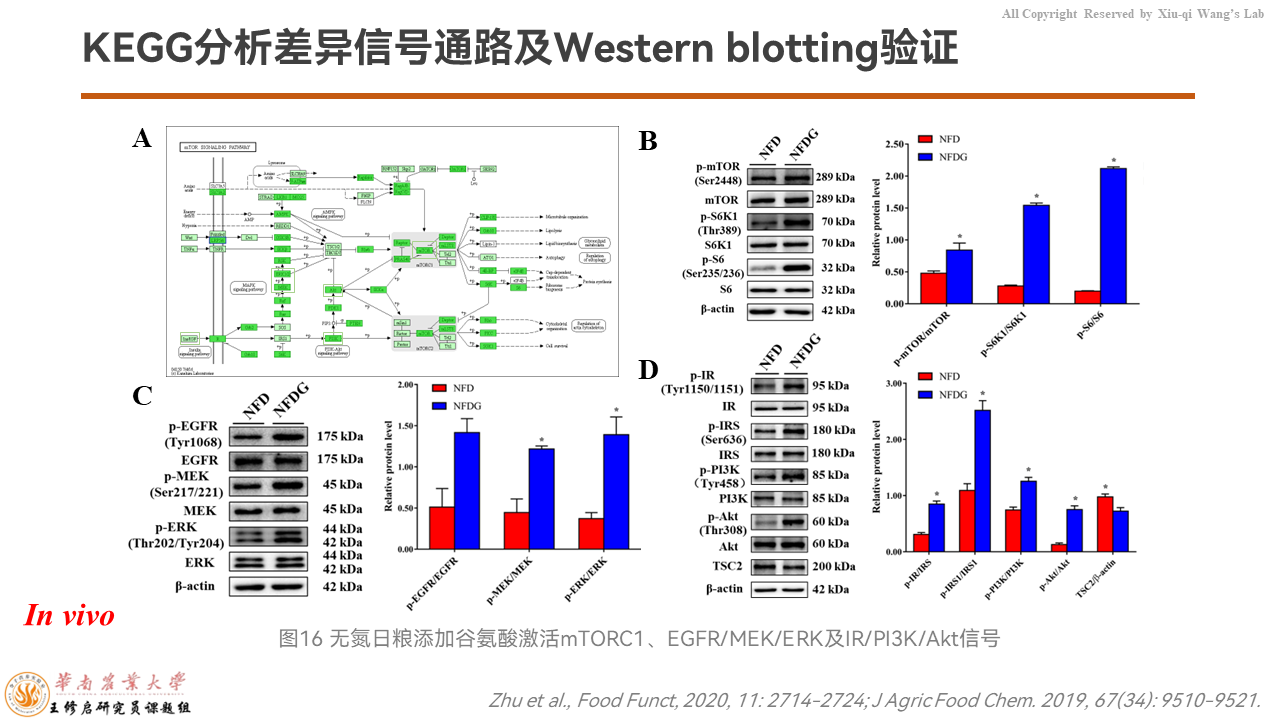
之后我们通过KEGG分析发现,这个差异的信号通路里边mTORC1信号通路,它上游的EGFR/MEK/ERK信号通路,以及IR/PI3K/Akt信号通路都被谷氨酸显著上调。
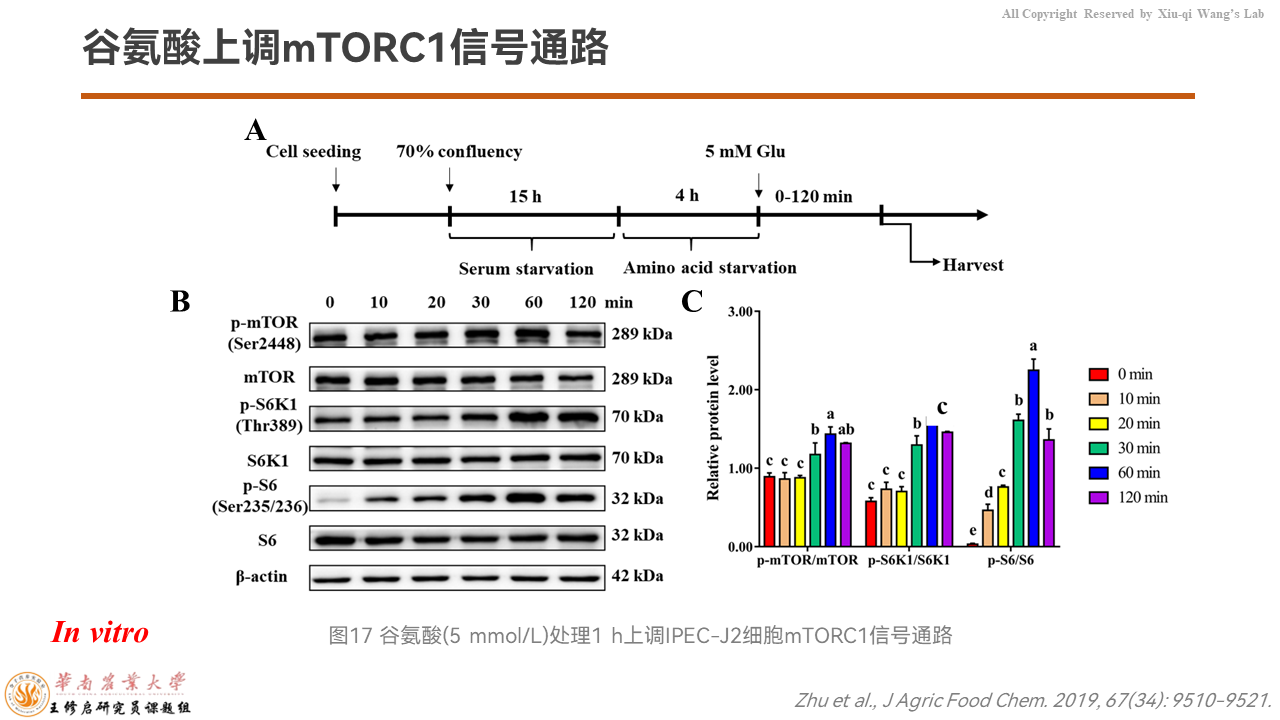
我们接下来用IPEC-J2细胞系在体外进行了验证,发现添加5 mmol/L的谷氨酸,60分钟之后可以显著地增强mTORC1信号通路的活性。
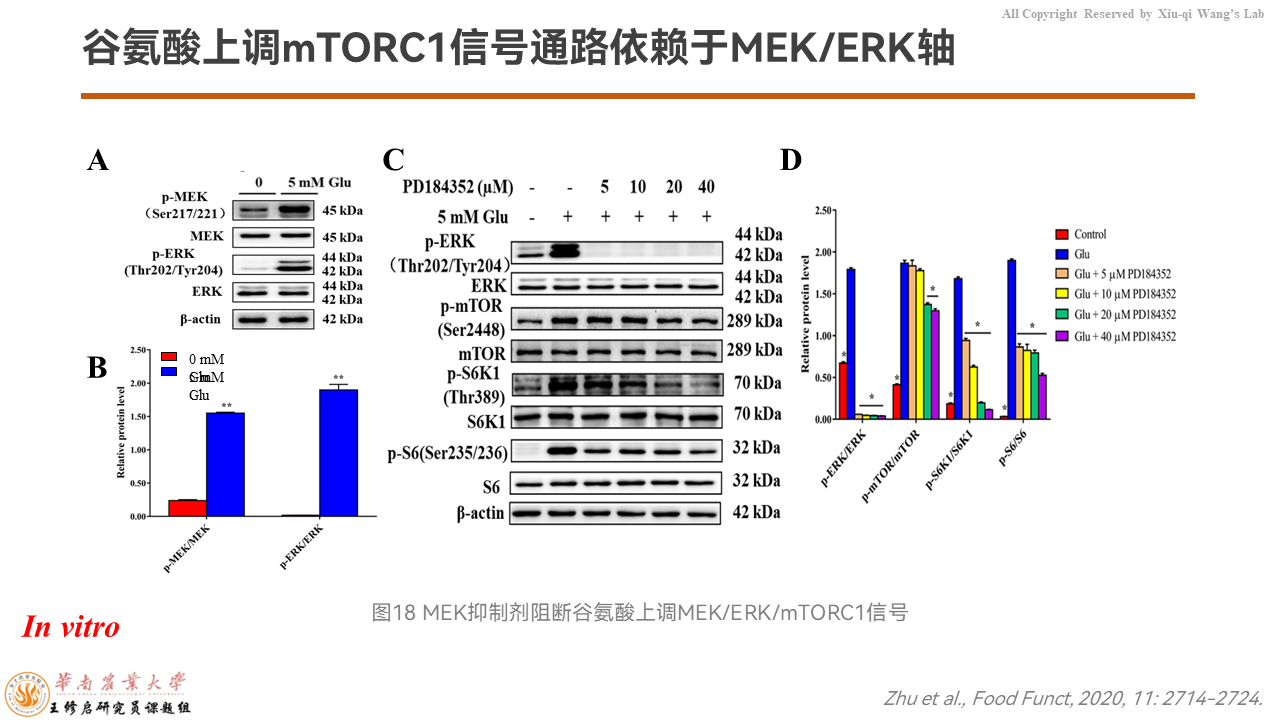
为了验证到底是上游哪些信号分子介导mTORC1信号通路的激活,我们首先通过MEK的抑制剂来验证。如果我们把MEK抑制掉,mTORC1信号通路的激活程度就被降低了。
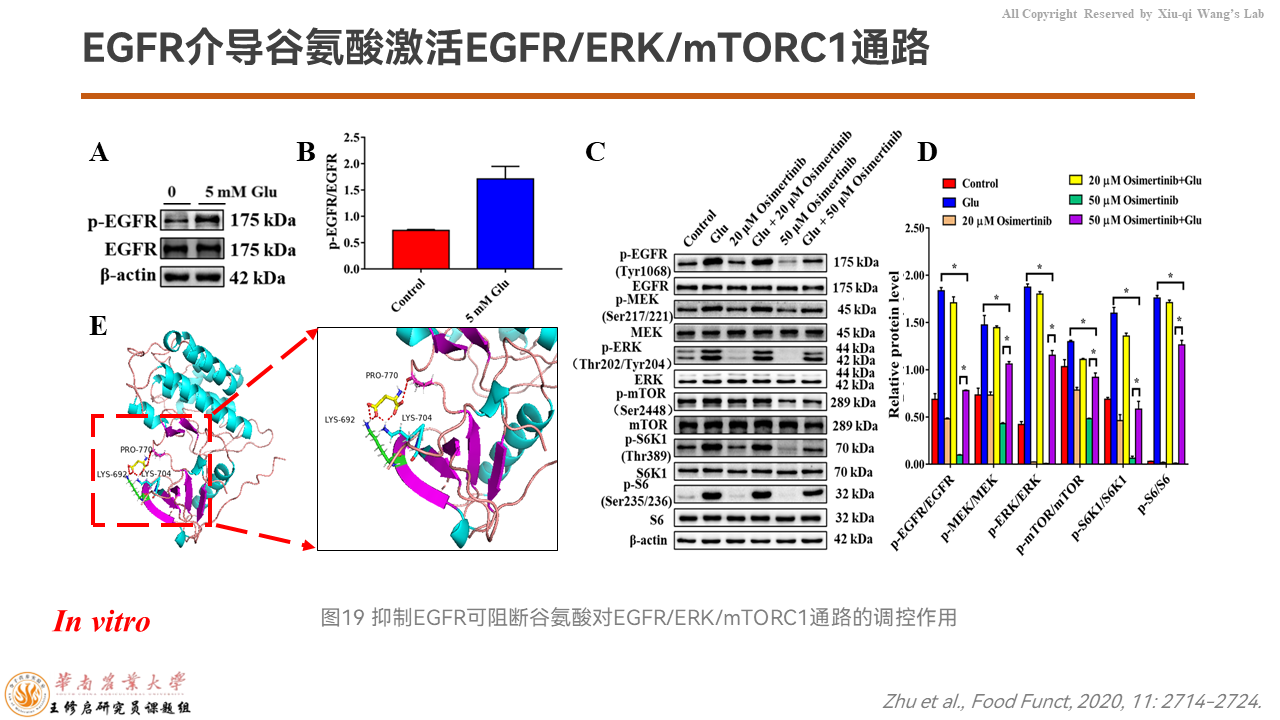
进一步向上溯源的时候,我们发现谷氨酸可以上调EGFR的蛋白质表达量。
分子对接分析显示,谷氨酸和EGFR存在结合位点。我们用EGFR的抑制剂去抑制掉之后发现,谷氨酸激活mTORC1信号通路的效果被打了折扣。
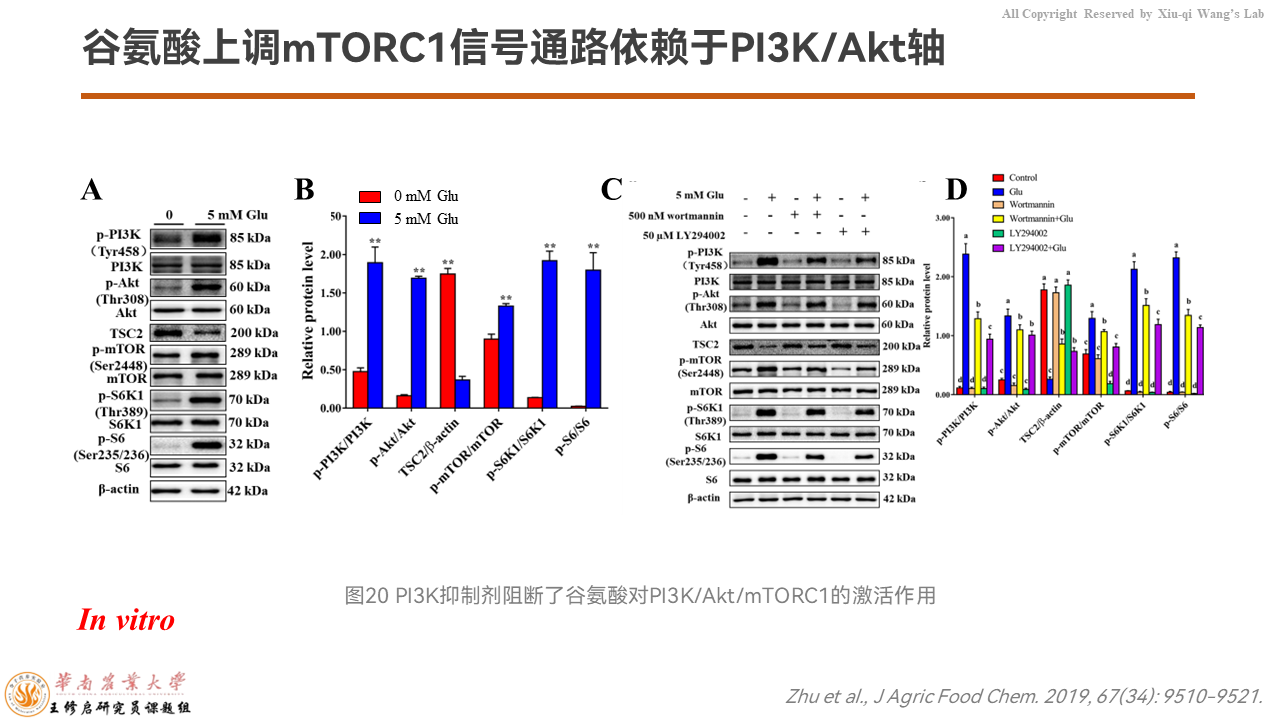
之后我们去验证PI3K/Akt这个轴是否调控了mTORC1信号通路。
我们用PI3K抑制剂发现,PI3K被抑制之后,它阻断了谷氨酸激活mTORC1信号通路的作用。
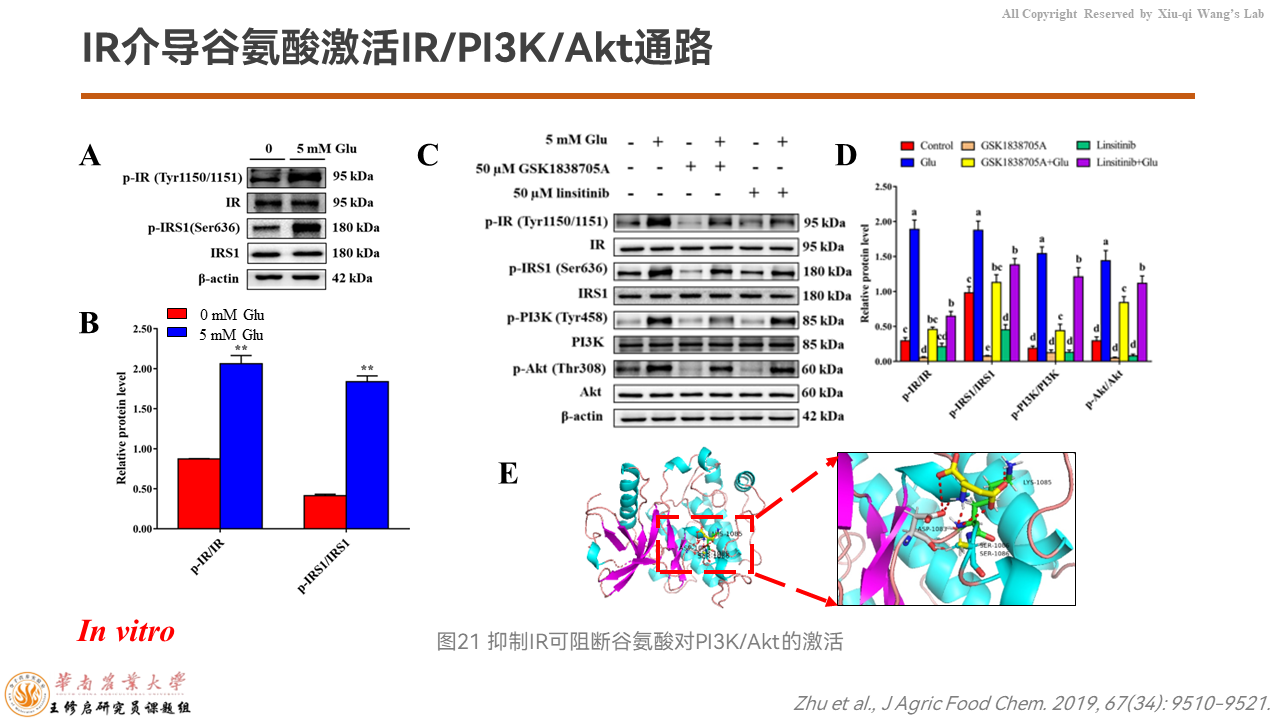
进一步向上溯源,我们用IR的抑制剂来检测是不是IR介导了这个过程。
分子对接分析显示,IR和谷氨酸同样存在结合位点,意味着它们存在互作。而且,添加谷氨酸能够上调IR的蛋白质表达量。如果我们用IR的抑制剂会发现,谷氨酸激活mTORC1信号通路被阻断掉了。
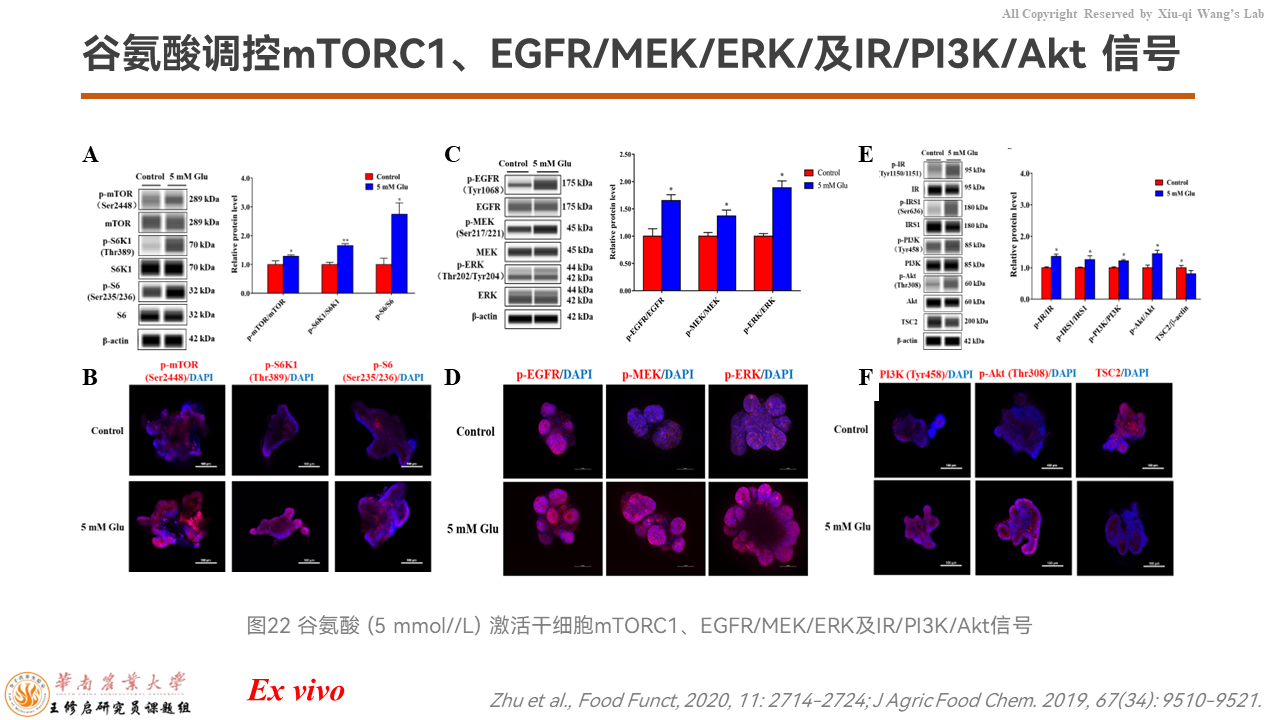
之后我们用猪的肠道类器官在离体水平上,研究谷氨酸增强肠道干细胞扩增能力,是否是由于EGFR/MEK/ERK、IR/PI3K/Akt信号通路共同激活了mTORC1信号通路,增加了蛋白质合成。
结果显示,无论是类器官的荧光信号,还是Wes全自动蛋白质定量表达检测系统的结果都提示,确实如我们预期的一样——谷氨酸通过EGFR、IR途径激活了mTORC1信号通路。
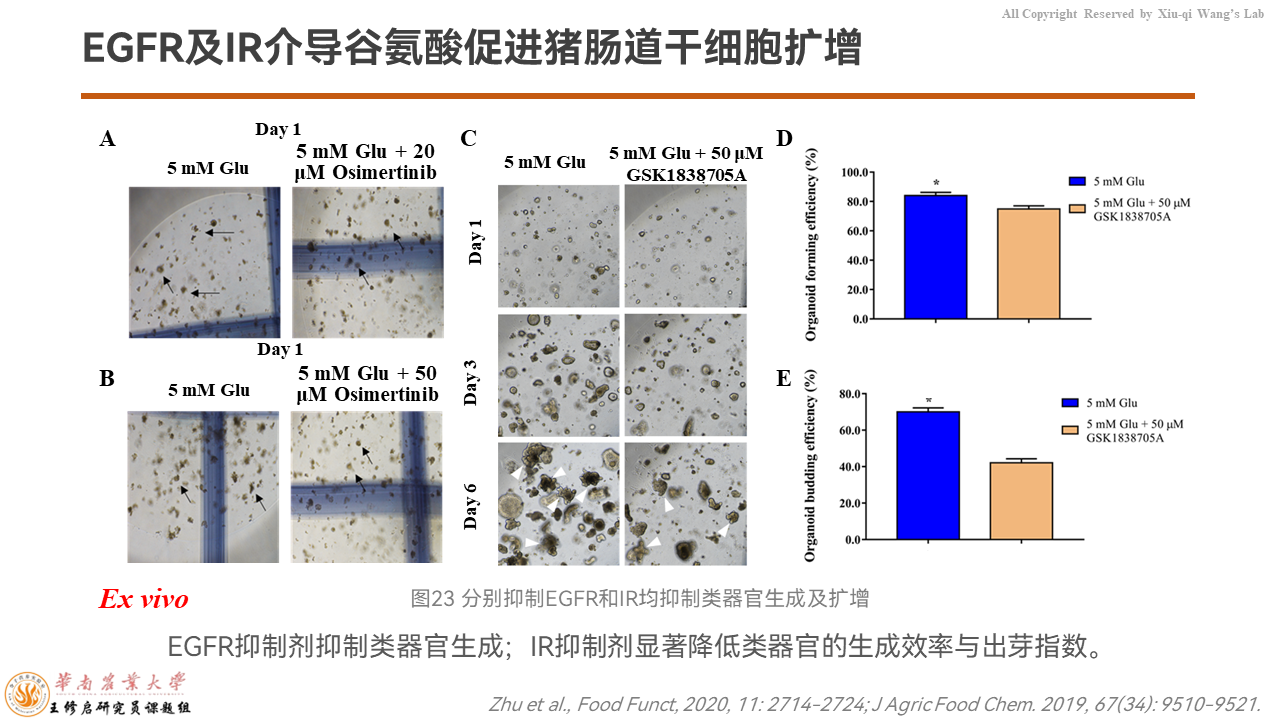
在类器官模型上,我们分别使用EGFR以及IR的抑制剂发现,当添加抑制剂的时候,谷氨酸促进肠道干细胞扩增的生成效率、出芽效率都被抑制。
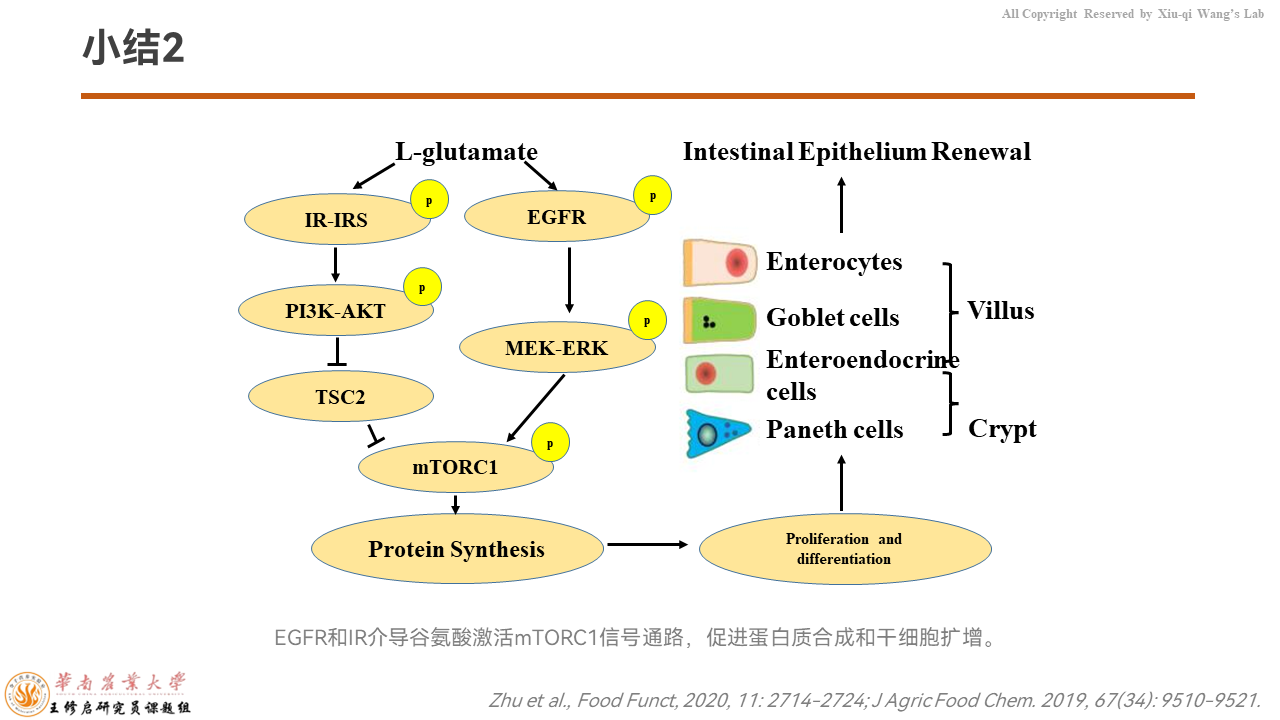
再小结一下,胞外的谷氨酸可以通过IR受体、EGFR受体,分别通过IR/PI3K/Akt、EGFR/MEK/ERK信号通路共同调控mTORC1的活性,控制蛋白质的合成。然后来增加细胞的增殖和分化能力,增强干细胞向功能细胞单位,如杯状细胞、内分泌细胞、肠细胞的分化能力,来改善隐窝-绒毛轴的结构,完成隐窝-绒毛轴的更新,增强肠道健康。
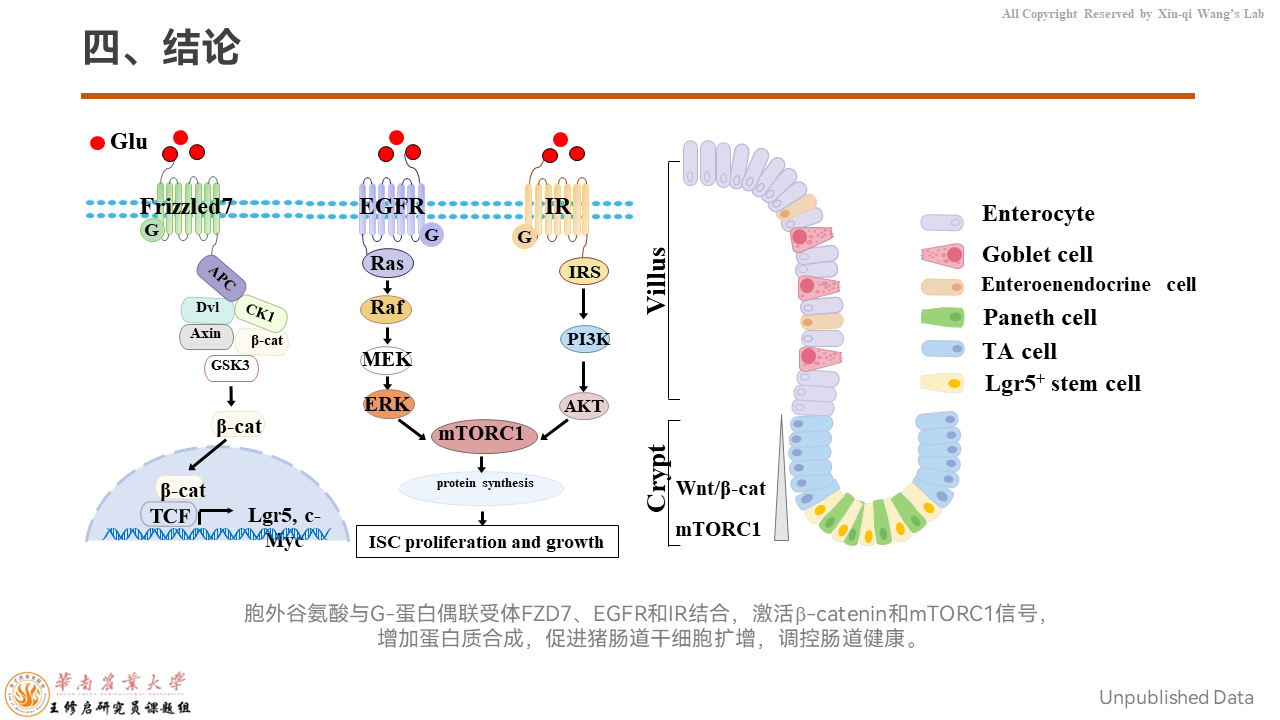
通过我们的研究发现,胞外谷氨酸与细胞膜上的G蛋白偶联受体FZD7、EGFR、IR结合,可以激活β-catenin和mTORC1信号,增加蛋白质的合成,促进猪肠道干细胞扩增,调控肠道健康。
其实这是我们关于谷氨酸调控仔猪肠道健康研究的一部分,后续我们还正在研究线粒体作为胞内谷氨酸信号的控制器,如何来调控肠道干细胞的活性、保护肠道健康。
希望以后有机会进一步和大家分享。

感谢国家自然科学基金以及其他科研项目的资助,感谢秦颖超、朱敏、周加义和黎相广博士的辛勤付出与努力。

谢谢!


