
大家晚上好,我是来自上海交通大学医学院分子医学研究院的王炜。我今天想和大家聊一下化学家和肠道菌群的一些偶遇的故事。
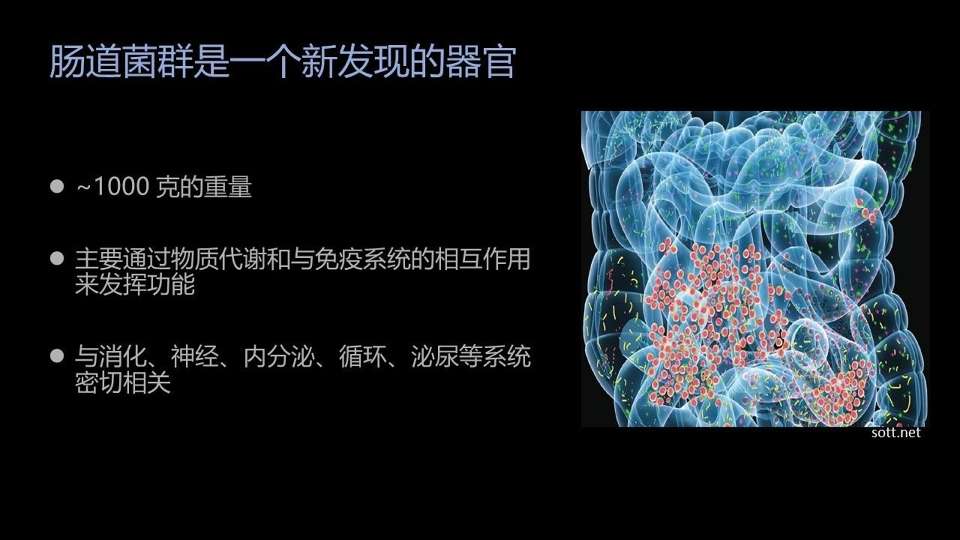
如果现在说肠道菌群是一个新发现的器官,相信大家不会有太大的争议了。
一个健康人的肠道中,大约有1千克左右的肠道细菌。它们主要通过物质代谢和与免疫系统的相互作用来发挥它们的影响。
这么大的体积,这么重要的作用,这么广泛的影响,把它称为一个新发现的器官,应该是大家都能接受的。

但是我今天更想强调的是,肠道菌群同时也是一个非常复杂的生物反应器。它至少含有300-500种的细菌,细胞数目与人类自身细胞的数目总数相当。
并且更重要的是,其中含有大约1000万个左右的基因,大家可以想见其中有多么复杂和多么多样的化学反应。
据估计,我们每个人的血液中,大约有接近1000种的小分子化合物,是来自于肠道菌群的,那现在已知的只有大约10%。
大家想一下,每个人的肠道中都有这么一个非常复杂的反应器,每天都有大量的肠道菌群产生的小分子化合物进入到我们的血液中。
但是我们对这个过程的了解之少,其实也非常让人惊讶。
这就引出了我今天想讲的一个话题——就是如果我们想更细致更深入的研究肠道菌群的功能,必须需要化学家的参与。
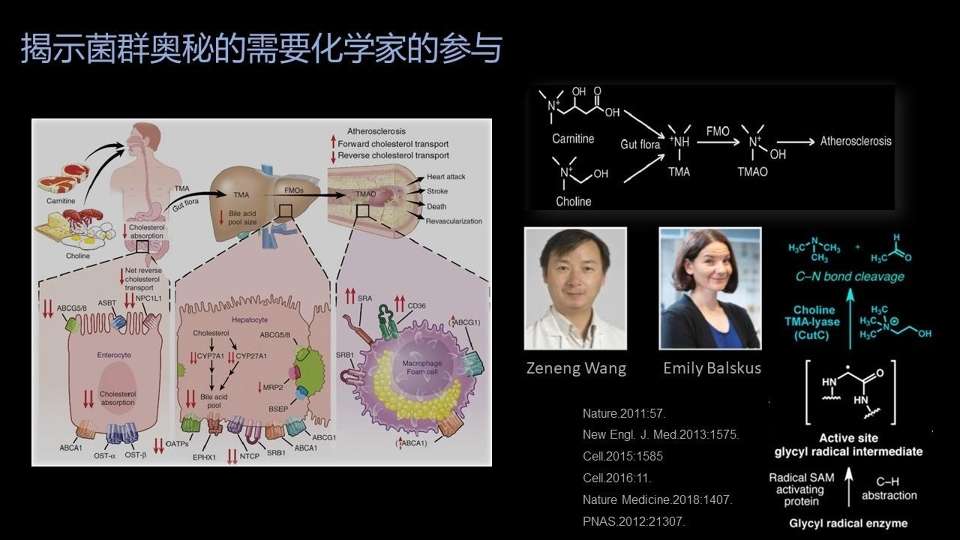
近些年,在肠道菌群物质代谢方面,研究的比较清楚的一个例子是氧化三甲胺这个分子。
我们平常吃的红肉、鸡蛋、奶酪中,都往往含有高含量的胆碱、肉碱,这些物质的共同特点是含有三甲胺这样一个基团。
在肠道中,肠道细菌可以把三甲胺基团释放出来,形成游离的三甲胺;这些游离三甲胺进入血液到达肝脏以后,被转化为氧化三甲胺;这些氧化三甲胺就有可能造成动脉粥样硬化。
这个过程的发现,是和美国凯斯西储大学王则能教授的贡献密不可分的,王老师是一位生物学家。
另外一个问题——到底是哪些细菌的哪些酶把这个碳氮键打断,从而释放出三甲胺分子?这些酶类的发现是哈佛大学化学与化学生物学系Emily Balskus教授的贡献。
举这个例子想和大家说明,生物学家和化学家的通力合作,对我们理解肠道菌群的细致深入的功能是多么的重要!
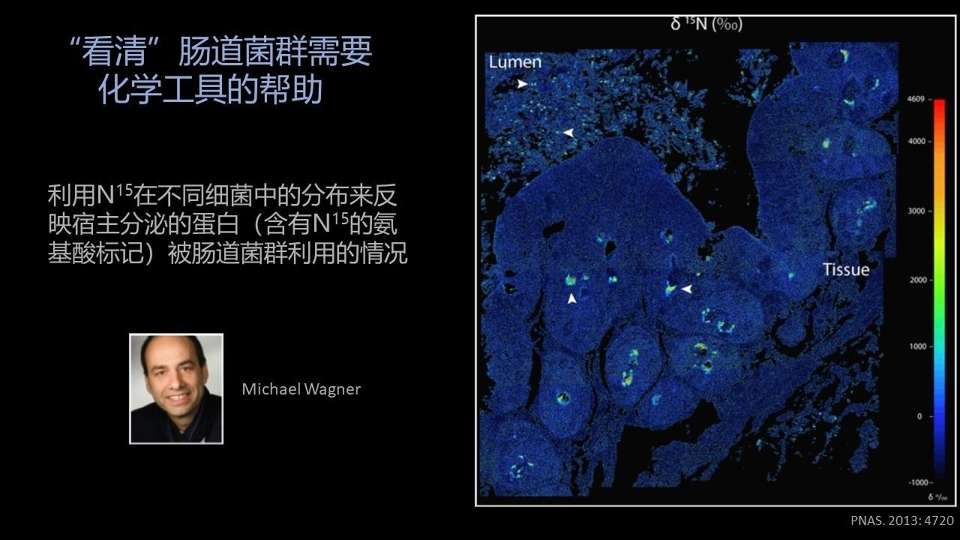
另外一个例子,想跟大家聊的是来自维也纳大学的Michael Wagner教授的一个非常漂亮的工作。
他们是想研究,在宿主的体内有哪些肠道菌群,能更善于利用宿主分泌的一些蛋白(比如说粘蛋白),为它们自己所利用,这是一个非常重要的物质交换的过程。
他们将含有N15标记的氨基酸,通过静脉注射给小鼠以后,过一段时间在小鼠的肠道中做一个切片。
然后用先进的质谱分析的方法,结合FISH(免疫荧光原位杂交)的方法,他们就能发现特定的细菌确实能有高含量的N15的信号。
就说明了这些细菌很可能就是真正在体内喜欢、擅长利用宿主的这些粘蛋白为自己所用。这样的话,通过一种非常直观的成像的方式,就能让所呈递的信息一目了然。
下面我想给大家简单介绍一下,近些年发展的一些肠道菌群的成像的化学工具。
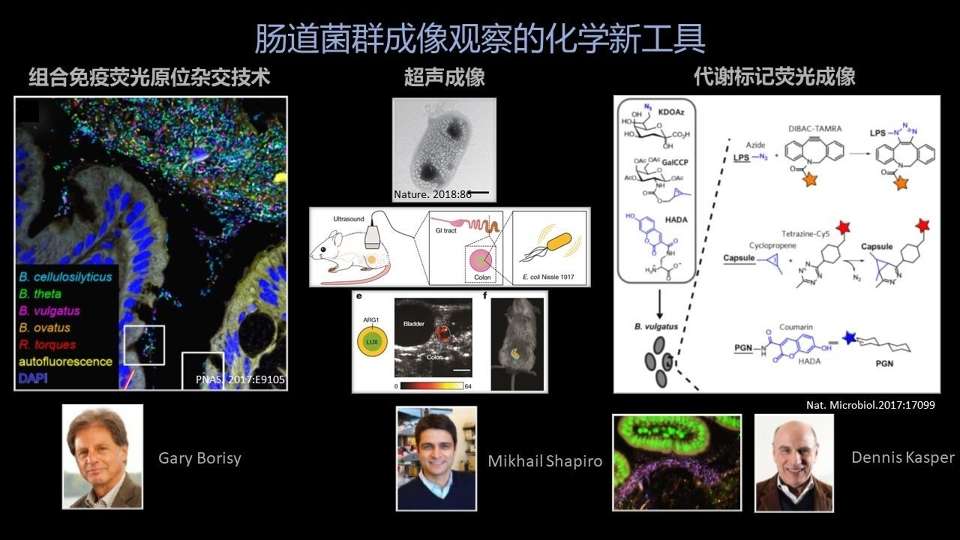
第一个还是大家非常熟悉的FISH的方法——免疫荧光原位杂交技术。
简单介绍一下的话,它就是一段特定的标记了荧光的DNA序列,能够靶向地结合特定的细菌的Ribosome(核糖体) RNA的结构。
FISH碰到的一个问题,就是可以选择的荧光染料是种类比较少的。因为太多荧光染料的话,可能会有信号的重叠。
哈佛大学医学院的Gary Borisy教授就发明了这样一种排列组合的方法,在同一个DNA上面连两种不同的荧光基团。
大家知道,排列组合以后,可以选的荧光种类、可以选的DNA的数量就会大大增加。我们可以在同一个样品中,同时观察更多种的细菌。
另外一个非常酷的工作,是去年发表在《自然》杂志上的,由加州理工大学的Shapiro教授开发的,利用超声成像肠道细菌的一个技术。
他们在一些可以导外源基因的细菌,比如说大肠杆菌中导入外源蛋白。不过导入的不是一种普通的荧光蛋白,而是一种能够在细菌细胞内形成纳米小气泡的这样一种蛋白。
大家知道,超声对小气泡是非常敏感,有非常强响应信号的。因此他们就能充分利用超声对组织的高穿透性的特点做相关研究。
把这样的大肠杆菌导入小鼠的肠道内以后,他们就能利用超声的成像仪器,直接观察这些大肠杆菌在小鼠肠道里边的分布情况。
第三个例子,我想举的也是哈佛大学的Dennis Kasper教授开发的代谢标记结合荧光成像肠道细菌的方法。
大家也都知道,现在绝大部分肠道细菌还是不能进行转基因操作的,并且常规的荧光蛋白在肠道里边的效果也是不太好的。
他们用的这种策略——代谢标记,是一种化学生物学中非常经典的一种方法。简单来说,就是在养细菌或者养细胞的时候,我们加进去一个外源的小分子探针。
这个小分子探针的结构和细菌本身细胞表面的一些原有的结构非常像,但是同时它们又带有一些特异的化学基团、化学标签。
这样的话,这些探针就能在细菌本身的代谢通路中蒙混过关,从而表达到细菌的表面。同时它们带有的化学标签也让我们有了更进一步进行化学操作的可能。
比如说,我们可以进行一个点击化学反应,将一些荧光基团偶联到细菌的表面,从而可以利用这些荧光基团来追踪细菌的分布。
这样就完美地绕过了转基因的这一步操作,从而只要细菌可以养,我就有办法给它稳定地带上荧光。
通过这几个例子,大家能看到,看清肠道菌群其实还是大家一个关注的焦点。
下面我想讲一下,最近几年我们自己在肠道菌群成像观察工具开发中的一些尝试。
我自己本科是学的临床医学专业,然后博士期间是学的生物化学和微生物学,在博后阶段,我又接触到了化学生物学。
我自己对开发利用化学工具来解决和医学相关的微生物学问题,是非常感兴趣的。
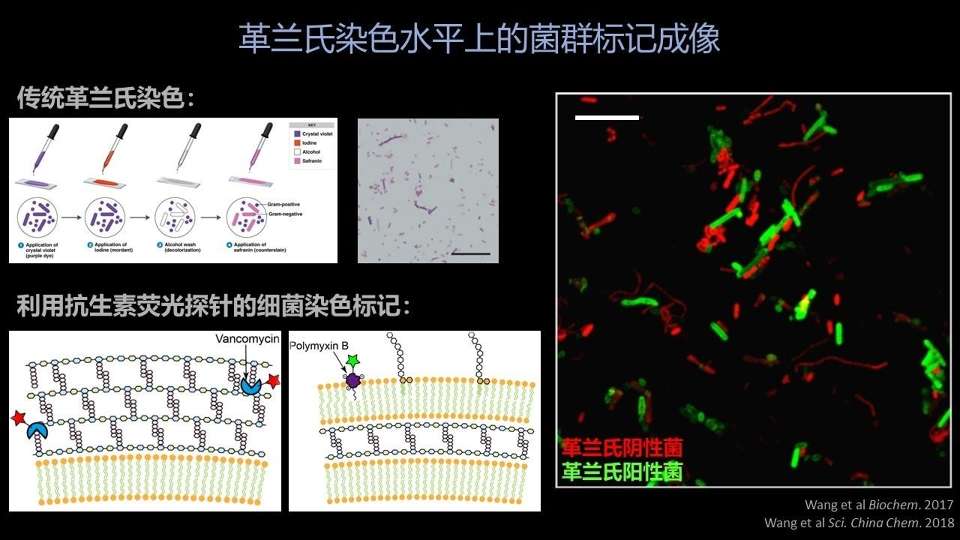
在几年前,我们刚刚进入到肠道菌群研究领域的时候,我们就想,先给自己设定一个小目标吧——能不能在一个复杂的肠道菌群样品中,先把革兰氏阳性菌、革兰氏阴性菌用荧光成像的办法区分开来。
因为大家知道,传统的革兰氏染色是在1884年,由丹麦的Hans Christian Gram教授发明的,沿用了130多年,基本没有做什么根本性的改动。
它的一个问题,就是在面对复杂样品的时候,成像、染色效果往往不好。
我们了解到这个问题以后,我们就想能不能利用抗生素分子对细菌结合的特异性,在不破坏抗生素与细菌结合的这种特异性的同时,把抗生素分子改造成一种荧光成像的探针呢?
我们选择了两种抗生素,分别是万古霉素和多粘菌素,它们分别能够结合革兰氏阳性菌和革兰氏阴性菌。
我们通过简单的化学反应——荧光修饰,把它们分别连上了不同的荧光基团。
大家能看到,我们对肠道菌群的荧光标记成像是非常清楚、非常漂亮的。大家看到红色的,这就是革兰氏阴性菌,绿色的就是万古霉素标记的革兰氏阳性菌。
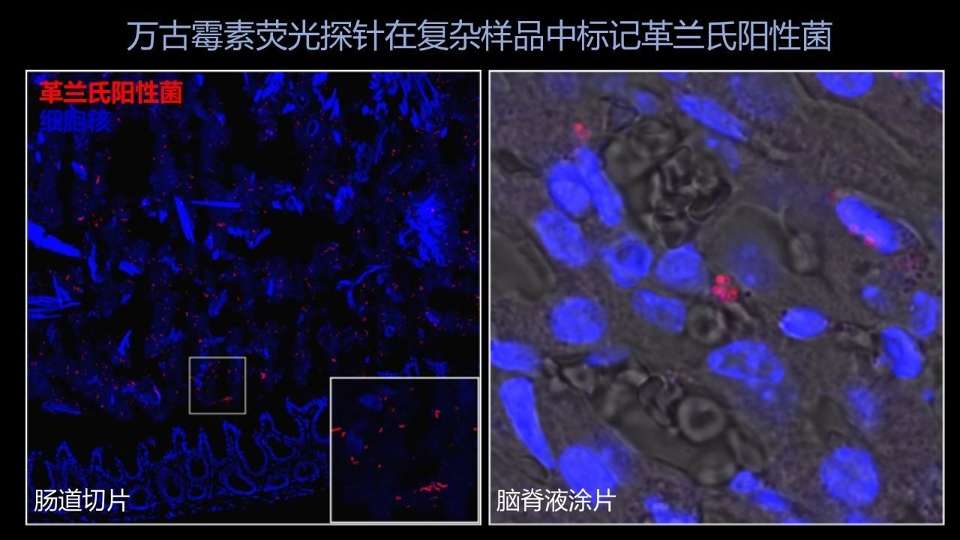
更有意思的是,在更复杂的样品里边,比如说这是一个小鼠的肠道组织切片,我们的万古霉素探针同样可以非常清楚地显示出其中的革兰氏阳性菌的所在。
这是一个毫米级的样品,我们能显示出微米级的单菌的分布情况。
可能更有意思的是,在一些临床组织样品里边,比如说这个脑脊液的涂片,当时检验科的医生送过来的时候,他们认为是有细菌感染的。
但是传统的革兰氏染色方法没有办法很好的显示出其中的细菌,因为好多细菌是藏在免疫细胞细胞内的。
但是我们的万古霉素探针却能非常清楚地显示出这些细菌的所在,那现在我们也在努力的把这项技术推广到临床应用中去。
举这个抗生素的例子,我想跟大家说一下,就是我们用化学的思路,通过简单的修饰改造,也能把一些看似毫不相关的分子,比如说这些抗生素分子,非常好、非常灵活、非常有利地应用到肠道菌群的研究中去。
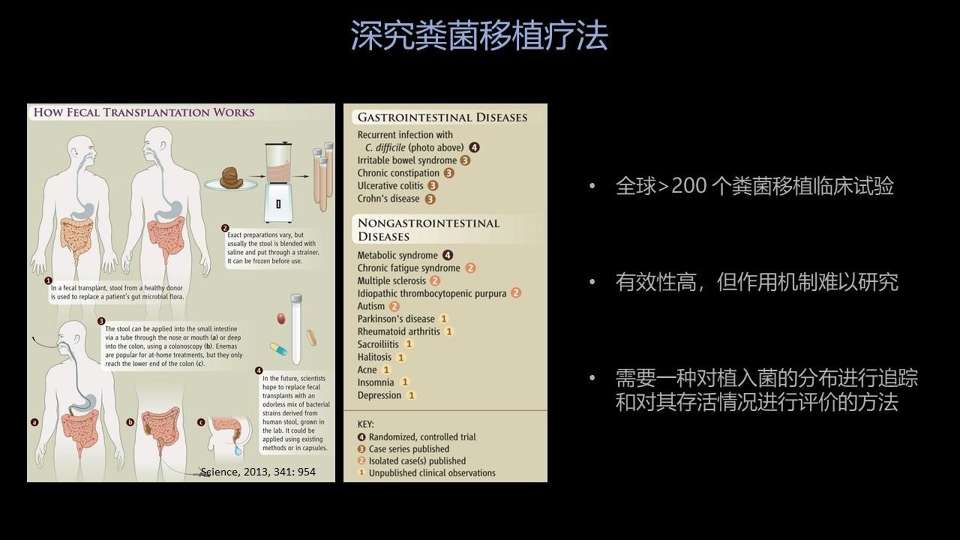
下面一个我想跟大家分享的例子,是我们最近刚刚发表的一个工作,是有关粪菌移植。
关于粪菌移植,大家都很熟悉了。它就是一个微生物疗法,用健康人的菌群移植给病人以后,改善他的肠道微环境,可以治疗很多的肠内和肠外疾病。
那现在全世界有超过200个注册在案的粪菌移植临床试验,并且大部分都显示了有一定的疗效。
但是现在大家面临的普遍的一个问题就是——粪菌移植的作用机制不清楚,那这就大大限制了我们对粪菌移植的理解,对粪菌移植操作步骤的优化和供体的标准化。

我们了解到这个问题以后,就想能不能有一种方法,可以让我们对粪菌移植过程中植入的菌的分布情况进行追踪,并且能够判断植入的菌中,哪些是真正能够在受体里边存活下来的呢?
因为这个信息,就有可能告诉我们粪菌移植发挥真正功效,是不是就是由于这些移植过程中存活下来的菌。
为了解决这个问题,我们设计了这样一个思路——
如果我们用代谢标记的办法,将一只供体小鼠的菌群都带上绿色的荧光。因为代谢标记是依靠细菌自己的酶的作用才能实现的,所以说只有活的细菌才能带有这样的荧光标记。
这时候我拿这样一种绿色的供体的菌群,移植给另外一只受体的小鼠的时候,理论上我们就能追踪供体菌群的分布情况。
同样的,如果我们再进行第二次的荧光标记,比如说这时候我们选的荧光是一种红色的荧光。那移植过来的细菌,如果它能在受体里边存活,那理论上讲,它们是有机会接触到这个红色的探针,从而实现第二步的标记的。
我们最后收集这只受体小鼠整的菌的时候,应该能看到里边有某些细菌既带有红色又带有绿色,这一定是在移植过程中能存活下来的植入菌。
为什么呢?因为它之所以带有绿色,肯定是来自供体的菌群;之所以带有红色,肯定是在受体中有代谢活动,能够存活下来的细菌。
所以说双色标记的细菌,我们就认为它是移植过程中存活下来的细菌。
如果它只带有绿色不带有红色,很可能就是在移植过程中没有存活下来的植入菌;如果它只带有红色不带有绿色,它有很大的可能性是受体小鼠原有的一些菌群。
这样我们通过两种颜色在不同细菌的分布,就能非常好地区分出几种细菌的各自的来源和去处。
同时我们可以用流式细胞仪,可以用荧光显微镜来非常清楚地表征这种信号的分布。
我们也给我们这个方法起了一个非常形象的名字,叫做STAMP(Sequential Tagging with D-Amino acid-based Metabolic Probes),这来自于它的英文简写。
它就像一个邮戳一样,能告诉我们这个细菌是从哪里来,它们要到哪里去,它们最终到了哪里去。
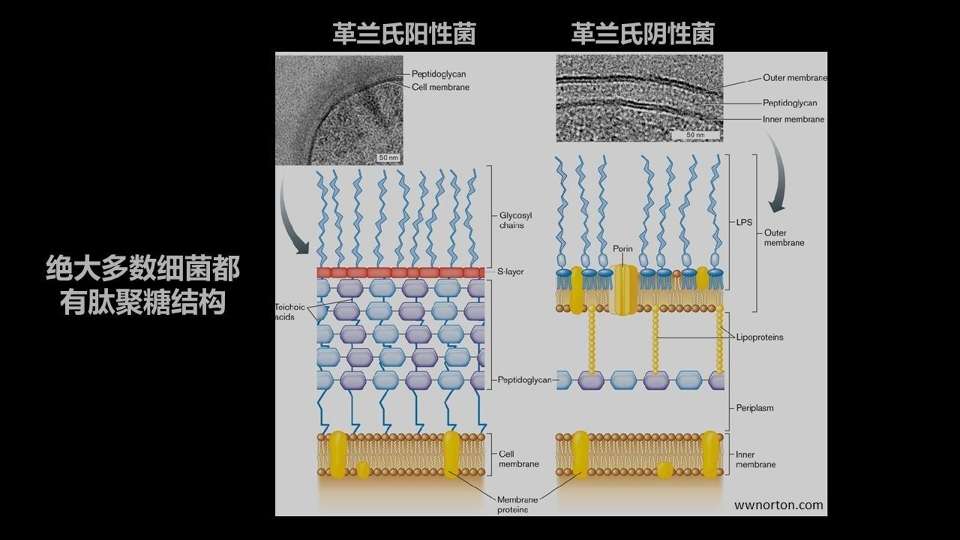
我们用的代谢标记探针是一种基于D-型氨基酸的非天然小分子,它的标记的靶标是细菌肽聚糖结构中的D-型的丙氨酸的位置。
细菌的肽聚糖结构非常保守,它在革兰氏阳性菌、阴性菌中都有分布。
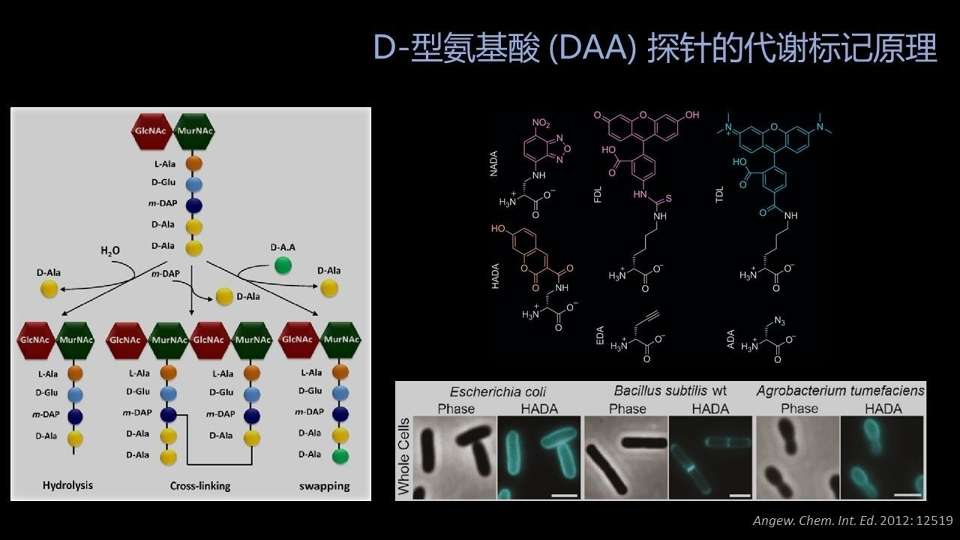
它的D-型氨基酸的位置是相对不稳定的,可以被细菌自己的酶所水解、所取代。
当细菌生长的环境中有其它的D-型氨基酸的时候,它的酶就有可能用这个周围环境中的D-型氨基酸,替换掉它原本的D-型的丙氨酸的位置。
并且这个酶对这些D-型氨基酸的侧链的修饰的容忍度很高的——即使你的侧链上带有荧光,它也不管不顾的,就把它修饰到了细菌的细胞壁上。
最后,在我们完成标记的时候,这个细菌的细胞壁就带有稳定的带有荧光分子的修饰。
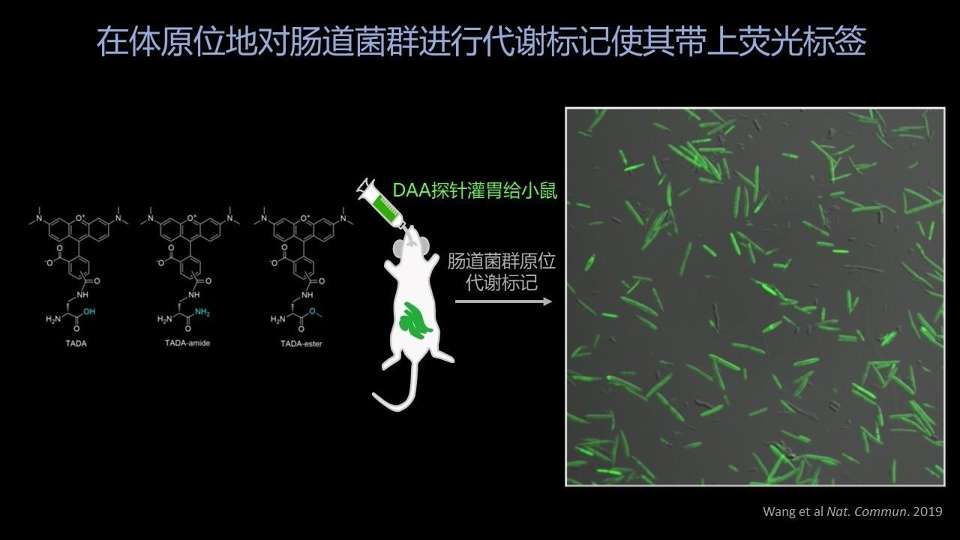
这是我们用的代谢标记的探针的结构式。
当我们用这个绿色的荧光探针,通过灌胃的方式给到供体小鼠,让供体小鼠的菌群在原位接触到这些探针,从而给它们一定的机会,让它们代谢标记到它自己的细胞的表面。
最后我们拿到的供体的菌群,就带有这样非常清楚、高强度、高覆盖率的荧光标记。我们的荧光标记的信号覆盖率现在可以达到85%,也是非常强的。
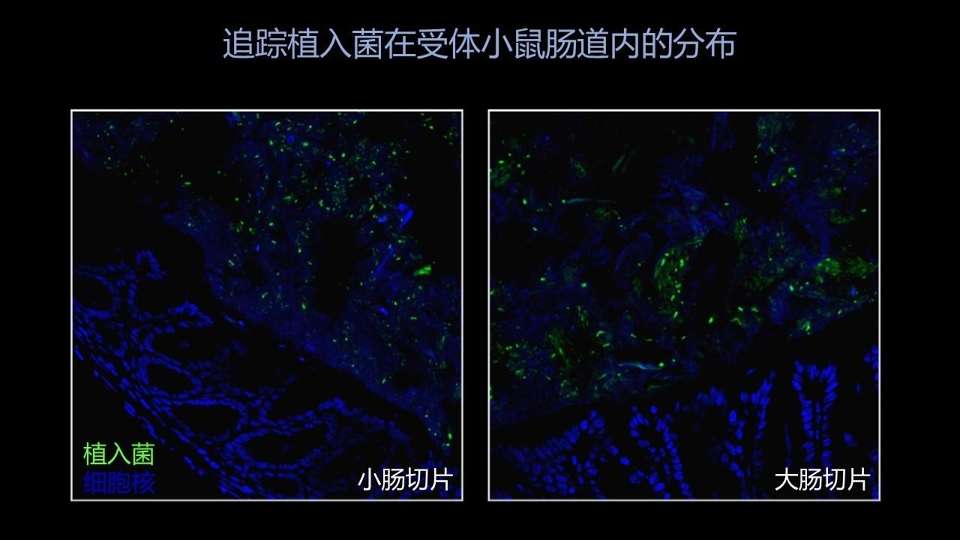
我们拿这个绿色的供体小鼠的菌群移植过去以后,就能在受体小鼠的肠道内看到我们植入菌的分布情况。
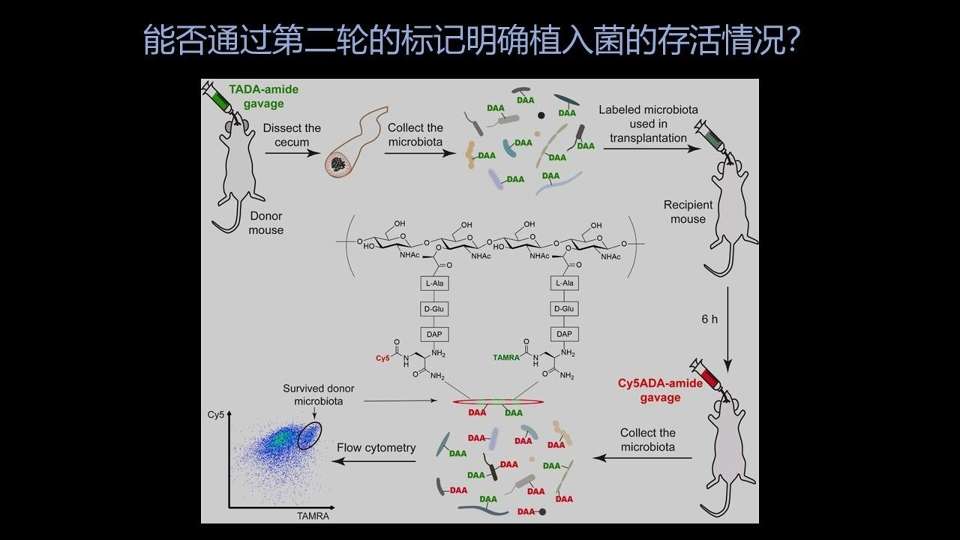
现在关键的问题就是,第二步的标记是不是可行?能不能看到双色标记的细菌呢?
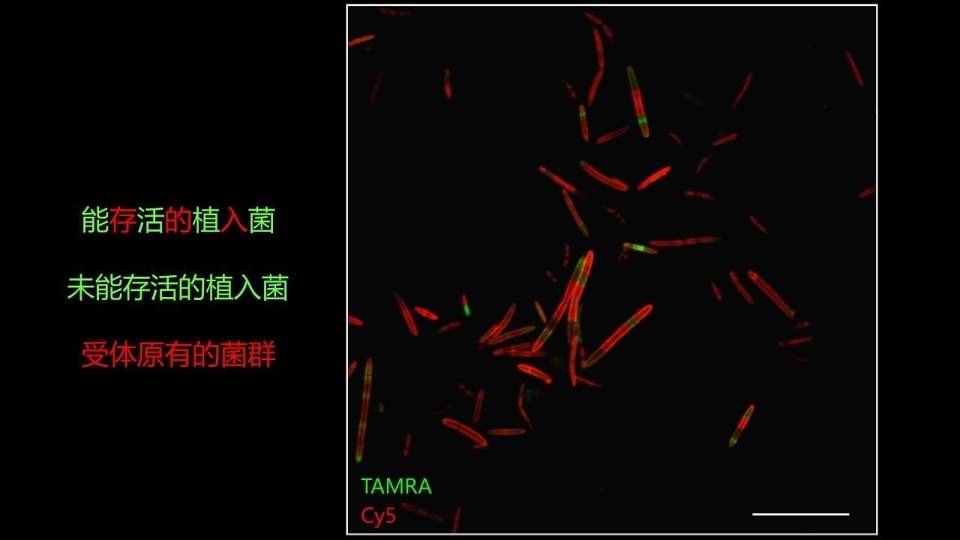
这是我们得到的一个结果,相信大家能非常清楚地看到,相当一部分的细菌是既带有红色又带有绿色标记信号的。这部分细菌一定就是植入过程中存活下来的植入菌。
并且两种颜色在细菌上的分布是有一定规律的,大家能看到,大部分的细菌还是只红不绿的,绝大部分还是受体原有的菌群。
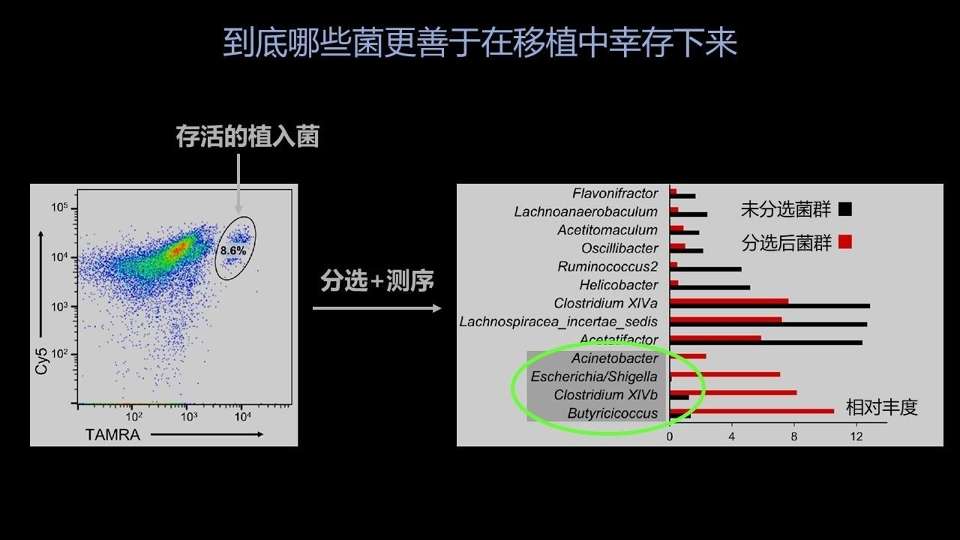
我们也用流式分选技术,把这部分双标的细菌进行了分选,并且进行了后续的测序。我们发现有几种细菌是在善于存活的亚群里边富集的,并且在其中有几种传统意义上的益生菌。
现在的一个自然的问题就是,如果我们只选用这几种细菌作为一个标准的供体做粪菌移植的话,是不是能够起到现在所用的常规粪菌移植的效果?
相信这是一个非常值得继续深入研究的问题。
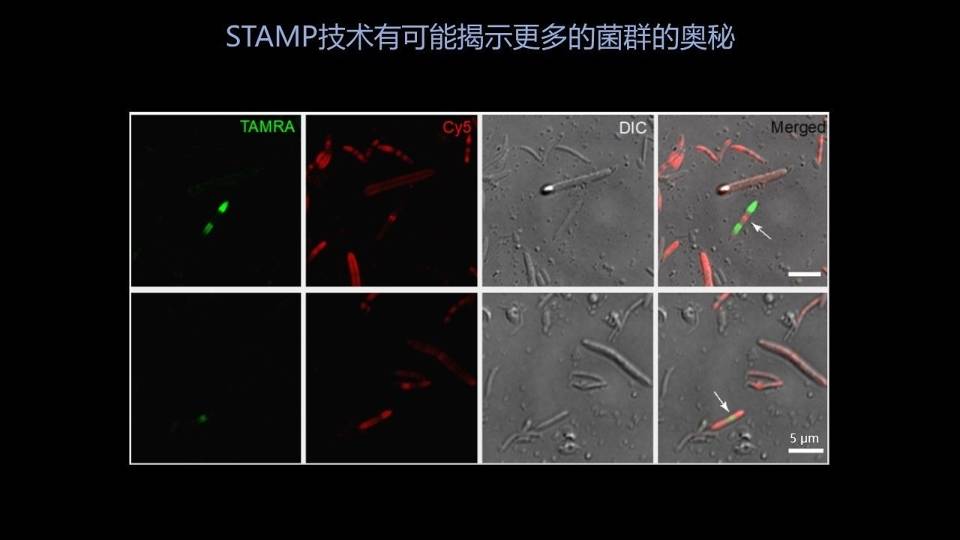
更有意思的是,用我们的STAMP技术可以在原位研究肠道细菌在肠道里边的一些基本的微生物活动。
大家看到右侧的这两个细菌,它们都是能够在移植过程中存活下来的植入菌,都带有双色的标记。但是大家如果仔细看的话,就能看到两种颜色在两个细菌上的分布正好是相反的。
因为我们第二次用的探针是红色的,所以说这个细菌新生成的细胞壁应该是带有红色的标记的。
所以说右上角这个细菌,应该就是传统的二分裂的细菌,从中间往两端生长;下边这个细菌正好相反,它很可能是从两端往中间生长。
现在我们也在继续地利用STAMP的技术,想研究一下肠道细菌里边的各型各色的细菌,到底在干什么,它以什么样的形式进行分裂。
因为好多细菌,之前是不能培养的,我们对它们的认识是非常贫乏的。

今天我一直在讲如何更好地看清肠道菌群,尽量做到所谓的“眼见为实”。
那我们现在就有一个问题——如果我们有一个办法,能够在体外直接看到肠道细菌在小鼠里边的分布,我们相信这也对整个的肠道菌群研究是非常有帮助的。
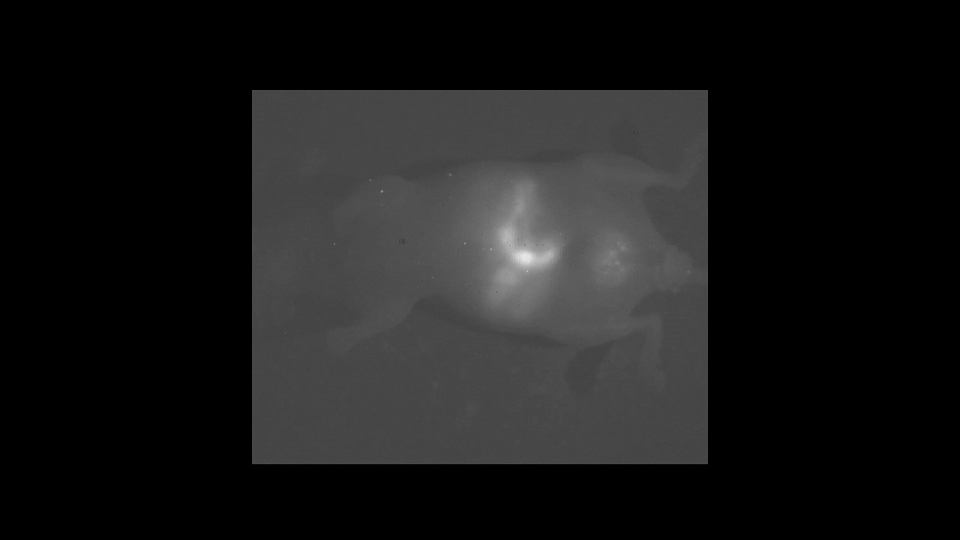
这就到了我们今天想和大家分享的最后一个故事,我想先给大家看一个视频。
这是我们看到的一只活的小鼠,它的肠道菌群在肠道内的实时的活动情况。现在这只小鼠仍然是活的,只是处于麻醉状态下。
这个视频也是实时的视频,大家还能看到肠道菌群在小鼠肠道里边,运动还是非常活泼的。
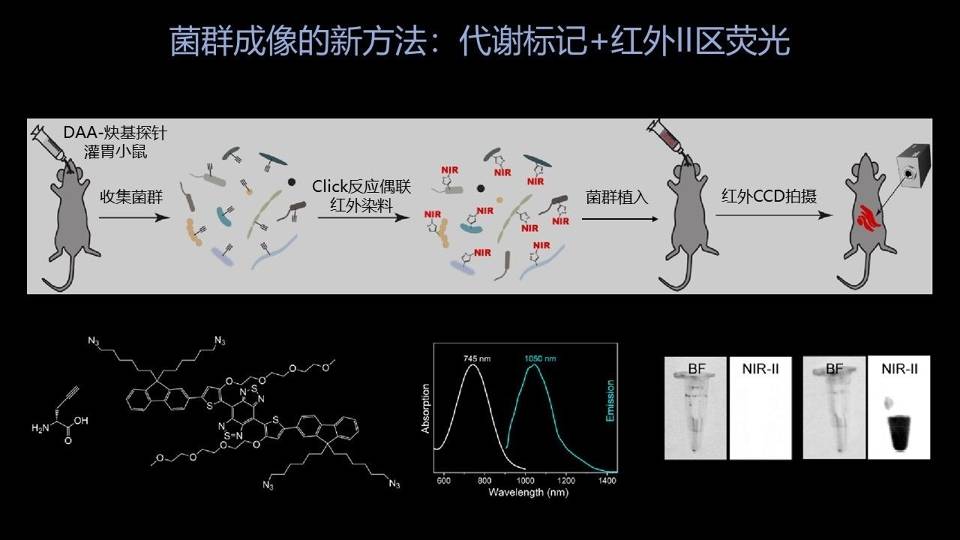
我们是怎样实现这一点的?同样的,我们用了代谢标记的策略。
但是这次我们用的代谢标记探针,它的DNA探针的侧链是带有炔基基团的,是一个碳碳三键。
这个碳碳三键是非常稳定的,在我们代谢标记完成以后,在这个菌群的细胞表面,应该就带有大量的这种炔基的标记。
炔基同时还有一个特点,它能和一个我们称做叠氮基团的化学基团进行非常特异性的、高完成度的反应,我们叫做点击化学反应。
我们用的荧光染料就是带有这样的叠氮基团的,所以说我们点击化学完成以后,我们这只供体小鼠的菌群就应该带有非常强的荧光标记的。
特别需要指出的是,我们用的红外的荧光染料不是普通的红外荧光,而是我们称为红外Ⅱ区荧光的一种分子。
这是近些年来在材料化学中兴起发展非常快的一种成像技术,它的发射波长能够达到1000纳米以上。这也导致了它们有非常好的组织穿透力,能够穿透接近2cm的组织。
我们把这样的菌群移植给另外一只老鼠以后,我们就可以用红外CCD相机——专门的红外CCD相机来在体外实时的看到肠道中的细菌的分布和运动情况。
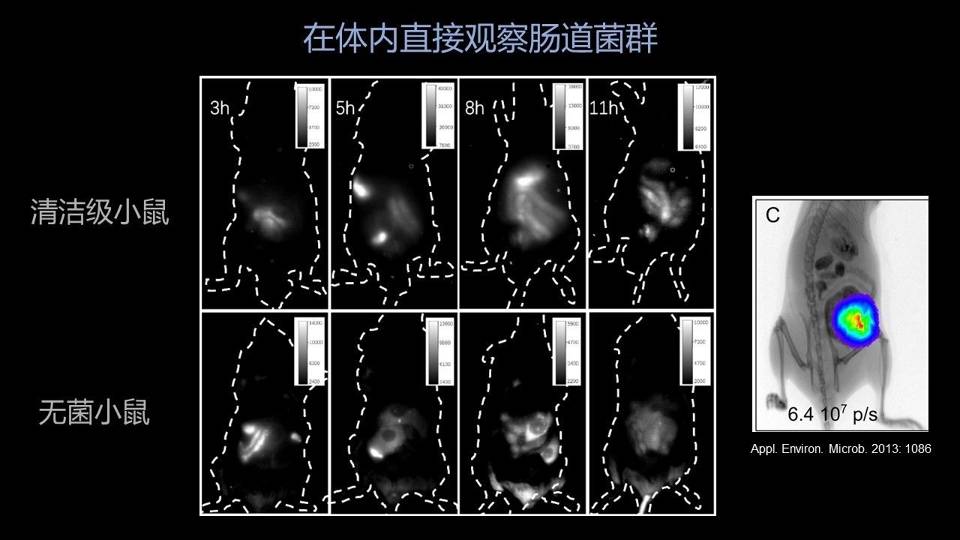
这是我们得到的一个结果,粪菌移植完成以后,可以看到同一只老鼠在不同的时间段,我们植入的细菌在它的肠道里边的分布情况,从回肠、盲肠、结肠都能非常清楚地看到。
更有意思的是,在无菌小鼠里边,我们移植完成以后,甚至能够看到肠道中的一些气泡。包括在最后一个时间点,我们看到肠道中的一个粪块,可以说是毫厘毕现。
相比传统的依靠化学发光进行体外活体成像的技术,我们的空间分辨率要高了很多,并且我们不需要进行转基因操作,所有的细菌都可以用这种方法来进行体外的实时成像。
相信我们这种红外成像结合代谢标记的策略,会成为今后肠道菌群研究中的一个常用的工具。

我想通过今天的演讲,能够说服大家下一步如果要更细致、更深入、更便捷的研究肠道菌群,确确实实需要化学家的参与。
我也想呼吁更多的化学家、化学生物学家来参与到肠道菌群的研究中来,和我们的微生物学家、医学家、生物学家一起,共同研究这个非常迷人的新发现的器官,揭开这个复杂生物反应器中的更多的奥秘。

最后要感谢一下几位老师、教授和几位同事、学生在这个研究过程中的支持和帮助。
谢谢大家!


