
大家好,我是浙江大学医学院的王宇浩。
今天我想跟大家分享的是肠道菌群和脂质吸收间的密切关系,也许我们的身体吸收多少脂肪在很大程度上是由我们的肠道菌群所决定的。
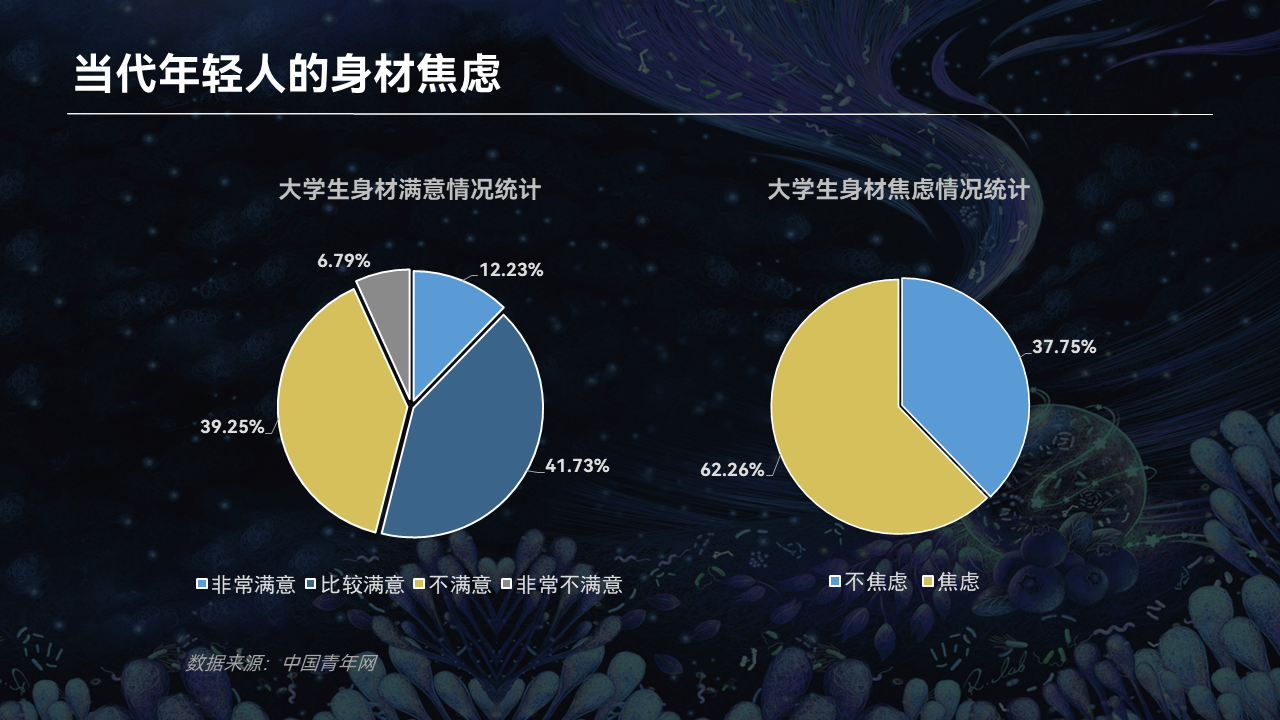
现在的年轻人都非常注重自己的形象。
根据中国青年报的一项调查,在大学生群体中,大约45%的人都对自己的身材表示不满意,更有高达62%的大学生或多或少存在着身材焦虑。

因此我们总能在社交媒体上看到一个灵魂拷问:能不能只吃不胖?
确实美食和苗条的身材往往不能兼得,大多数人都需要管住嘴、迈开腿,才能维持健康的身材和体重。
但是如果我告诉你,世界上有一种动物无论怎么吃都不会胖,你会不会感到非常神奇呢?
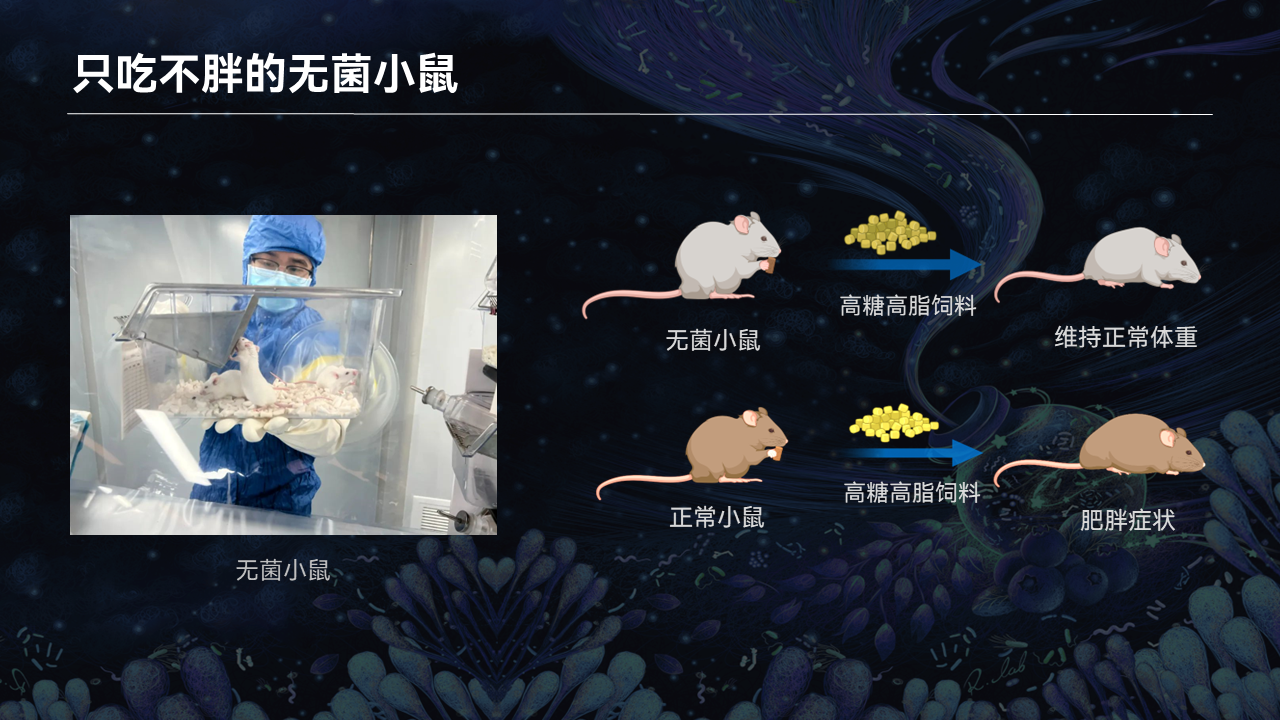
这种动物就是无菌小鼠。
所谓无菌小鼠,就是生长在无菌环境中的小鼠,它们身体中包括肠道在内的所有组织和器官,都没有任何已知的细菌。
我们在研究中发现,即使给无菌小鼠喂食高脂高糖的饲料,它们也能够维持正常的体重。而普通饲养的小鼠在给予了高脂饲料后,只需短短几周便会出现明显的肥胖症状。
这个结果表明,菌群的缺失将严重影响机体对脂质的吸收能力。

因此我们认为,菌群尤其是肠道菌群,很可能是调控机体脂质吸收过程的关键因素。
为什么缺失肠道菌群会导致脂质吸收缺陷呢?

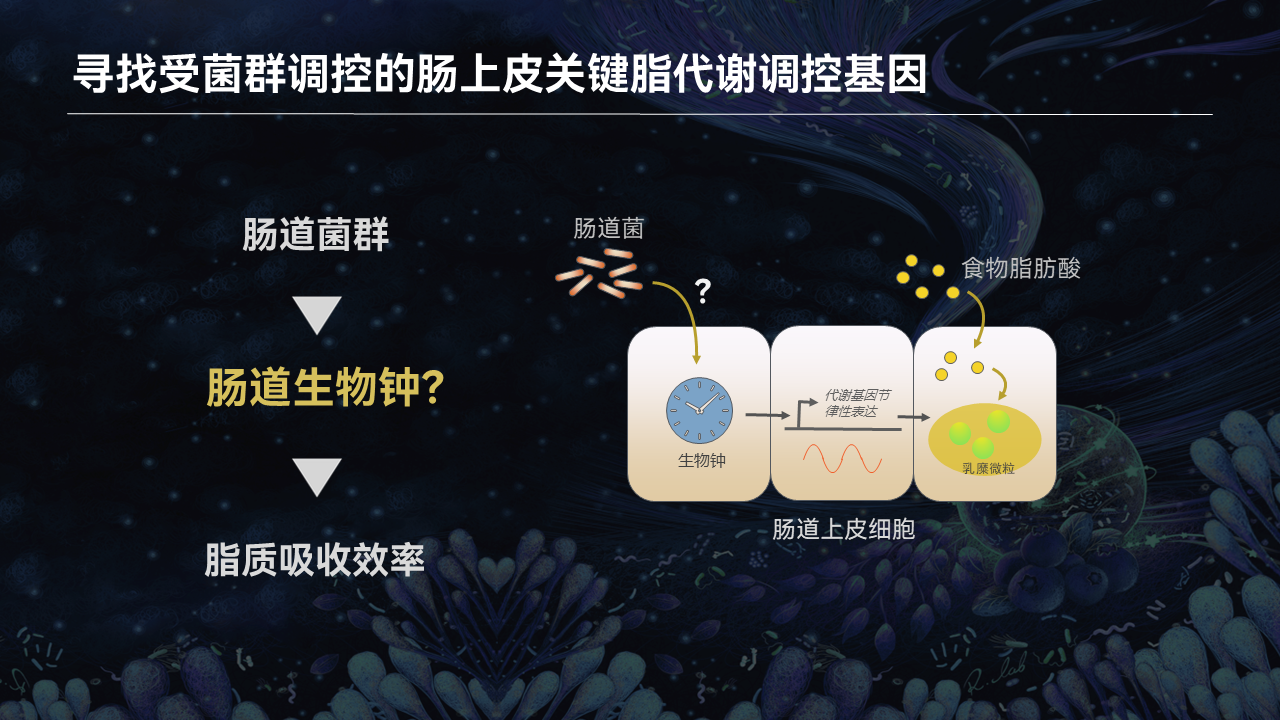
我们知道,食物中的长链脂肪酸都需要经过肠道吸收,这些脂肪酸被转运进肠道上皮细胞,需要进一步通过加工和包装形成乳糜微粒后,才能被输送至循环系统被各个组织所利用。
而肠腔中存在着数以万亿计共生菌,这些细菌时刻都在与肠道上皮细胞进行着交互。

因此我们认为,肠道菌群对脂质吸收的影响,很可能是通过对肠道上皮脂质吸收关键基因的调控来实现的。
那这些受肠道菌群调控的基因到底是哪些?

为了解答这个问题,我们分别从无菌小鼠和普通饲养的小鼠肠道分离了肠道上皮细胞,并对两者的转录组进行了测序分析。
结果发现,有非常多的基因表达在缺失肠道菌群的条件下都发生了改变。也就是说,这些基因的表达是受肠道菌群的存在与否调控的。

而我们想寻找的能调控肠道脂质吸收的关键基因,也一定存在于这其中。
那么这些关键基因究竟是哪个呢?
生物钟基因NFIL3
我们知道,基因可以根据其参与的生理功能进行分类。其中一类基因能够参与机体昼夜节律的调节,被称为生物钟基因。
而生物钟在肠道的脂质吸收过程中发挥了非常重要的作用,它能让肠道根据我们的作息和饮食节律周期性地启动脂质吸收过程。
那么肠道菌群是不是可以通过调控肠道上皮细胞的生物钟基因,来影响肠道的脂质吸收?
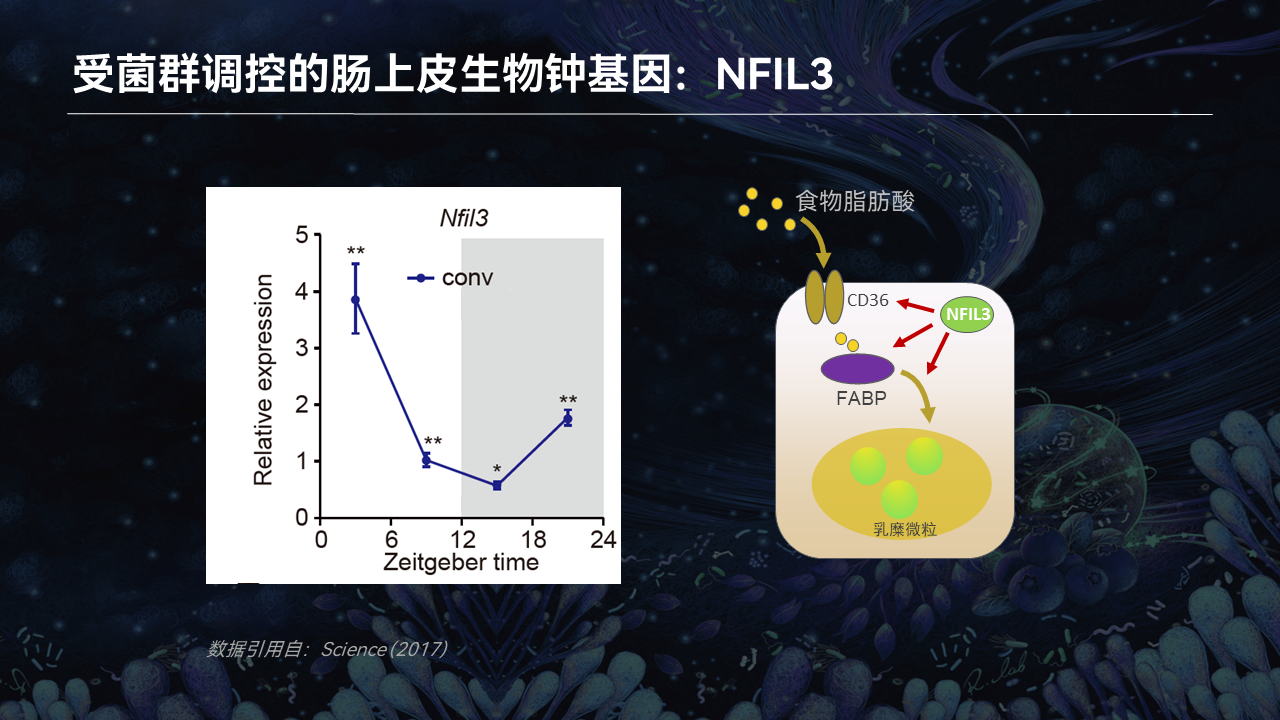
食物中的脂肪酸需要经过吸收、转运、包装等一系列步骤,才能转化成乳糜微粒进入循环系统。而肠道上皮细胞中有一个非常重要的生物钟转录因子,叫核因子白细胞介素3调节因子(NFIL3),这个转录因子能够参与脂肪酸加工包装的每一步调控。
在正常情况下,NFIL3的表达存在着非常明显的节律变化,这个节律也和小鼠的作息保持一致。在白天,小鼠处于睡眠状态,因此NFIL3的表达逐渐降低。而在晚上,小鼠处于觅食状态,NFIL3的表达也逐渐升高,因此促进了肠道对脂肪的吸收过程。
但是我们通过对无菌小鼠肠道上皮细胞的转录组分析发现,缺失肠道菌群能够导致NFIL3的表达显著降低。这表明肠道菌群能通过促进NFIL3的节律性表达,提高肠道对脂质的吸收。
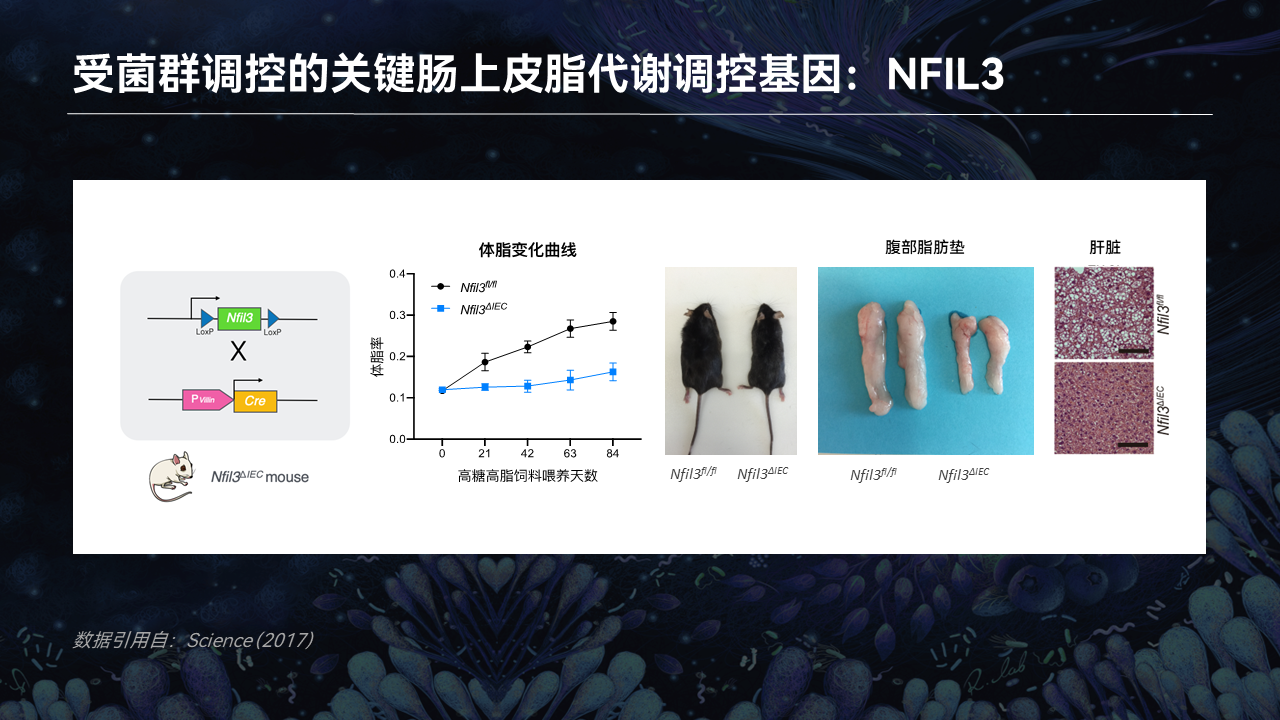
事实也的确如此。
当我们把NFIL3在小鼠的肠道上皮细胞中特异性敲除后,这些小鼠表现出了与无菌小鼠一样不长胖的表型。在喂食了高脂饲料后,依旧保持了很低的体脂率,体型明显小于野生型小鼠,腹部脂肪垫也明显小于野生型小鼠,肝脏也没有出现明显的脂肪肝现象。
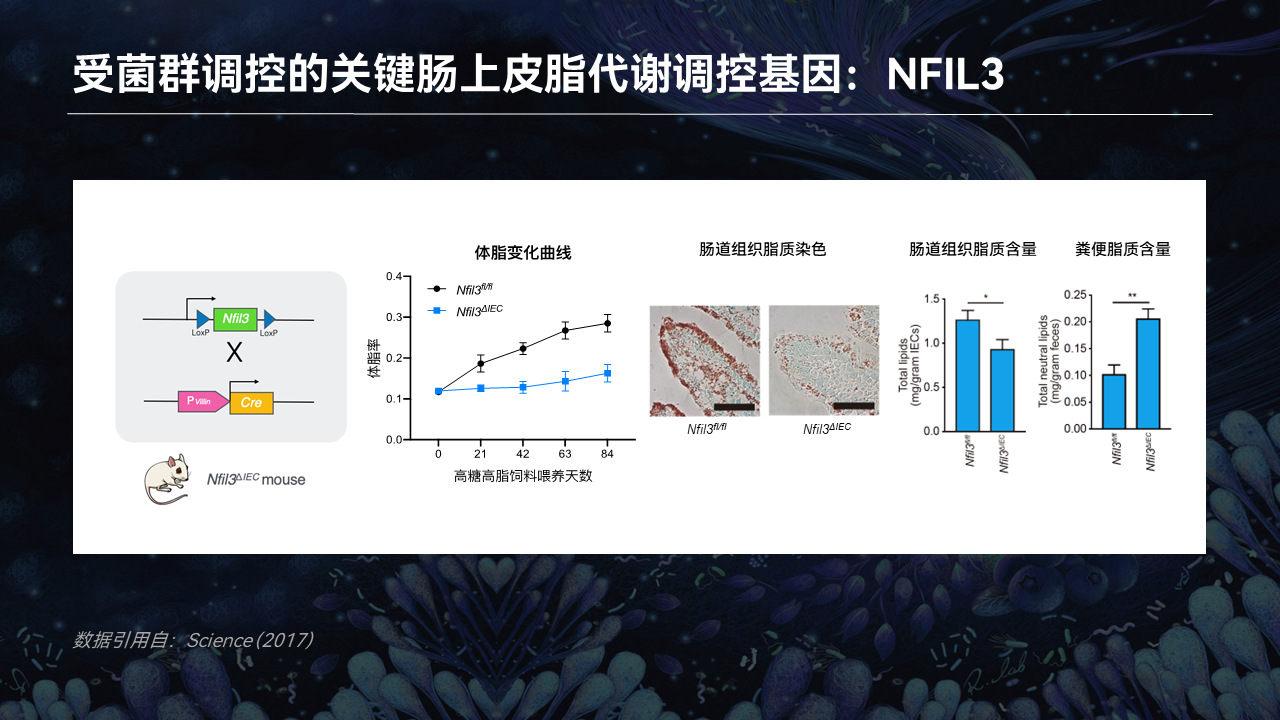
因为NFIL3主要调控的是脂质吸收过程,因此当NFIL3被敲除后,肠道上皮中的脂质积累明显降低,肠道组织中的脂质含量明显减少,而留存在粪便中没有被吸收的脂质则明显增多。
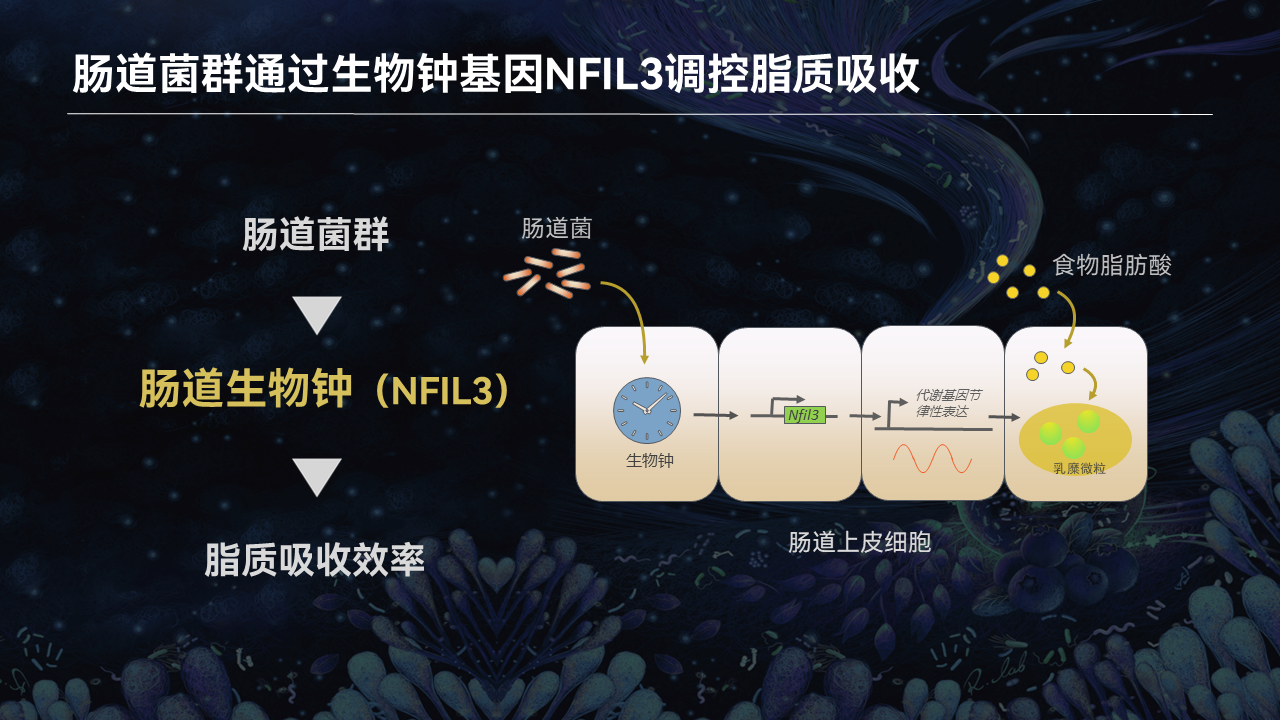
以上结果说明,肠道菌群确实能够通过生物钟基因NFIL3调控肠道脂质的吸收。
组蛋白修饰酶HDAC3

但是受肠道菌群调控的基因还有非常多。除了生物钟之外,一定还有其他途径也能被肠道菌群利用,并用以调节脂质的吸收。
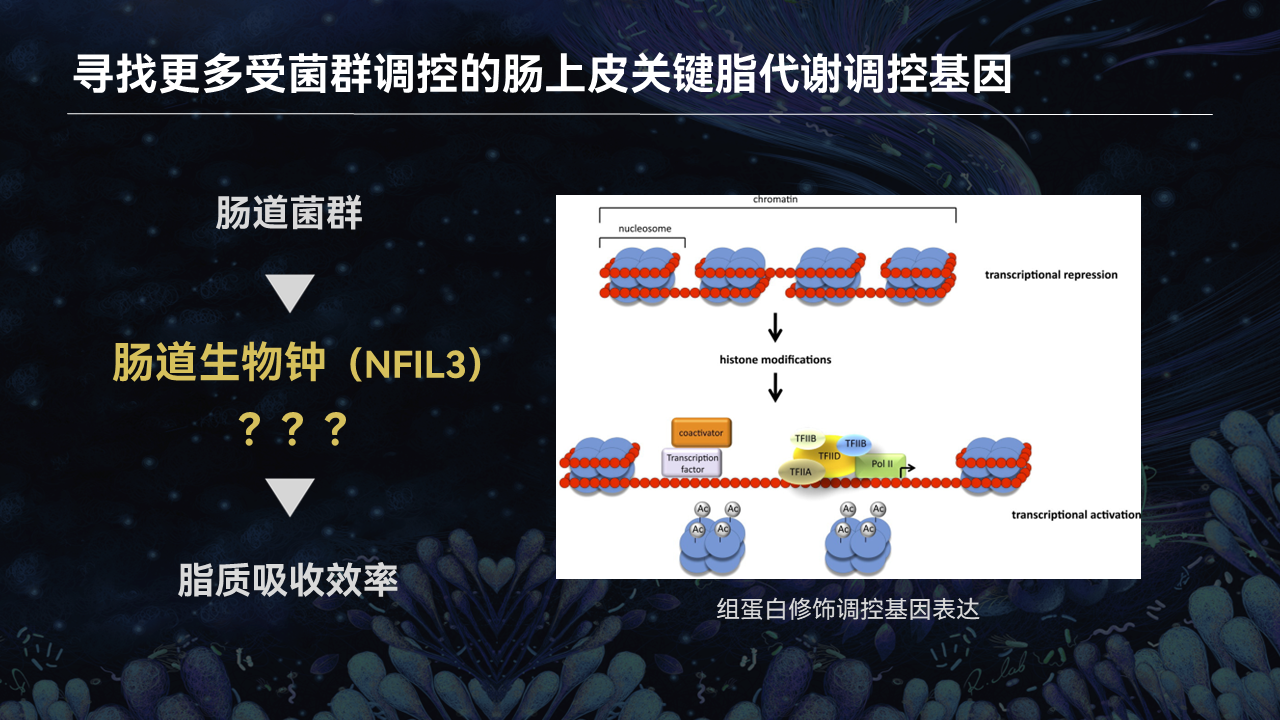
于是我们又想到了另一类关键基因表达调控机制,这就是组蛋白修饰。
我们知道,一个基因的转录、激活或抑制,可以由其组蛋白的乙酰化、甲基化等修饰所调控。

因此,肠道菌群很可能也能通过改变某些组蛋白修饰酶的活性或表达,来影响脂质的吸收。
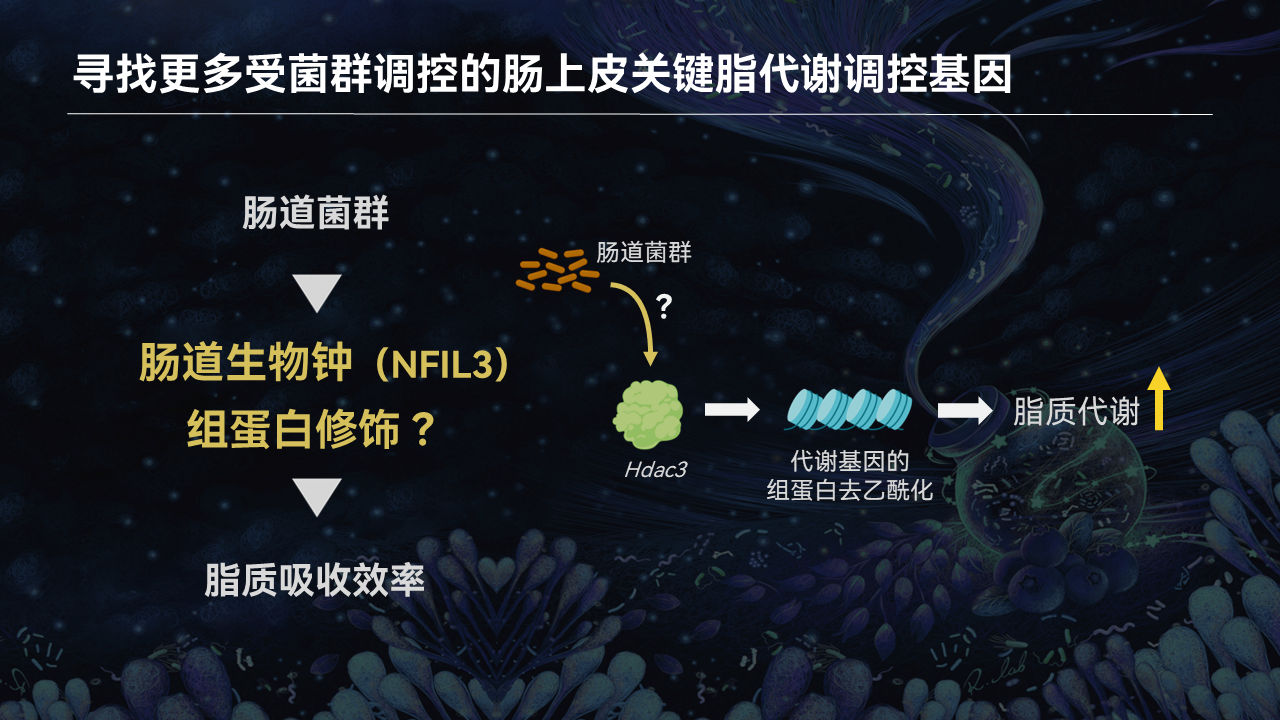
肠道上皮细胞中存在着重要的组蛋白去乙酰化酶3(HDAC3)。它能够通过去乙酰化许多脂质代谢相关基因的组蛋白,激活这些基因的表达,从而提高肠道对脂质的吸收和代谢效率。
因此,肠道菌群是否能够通过HDAC3来调节肠道脂质的吸收?
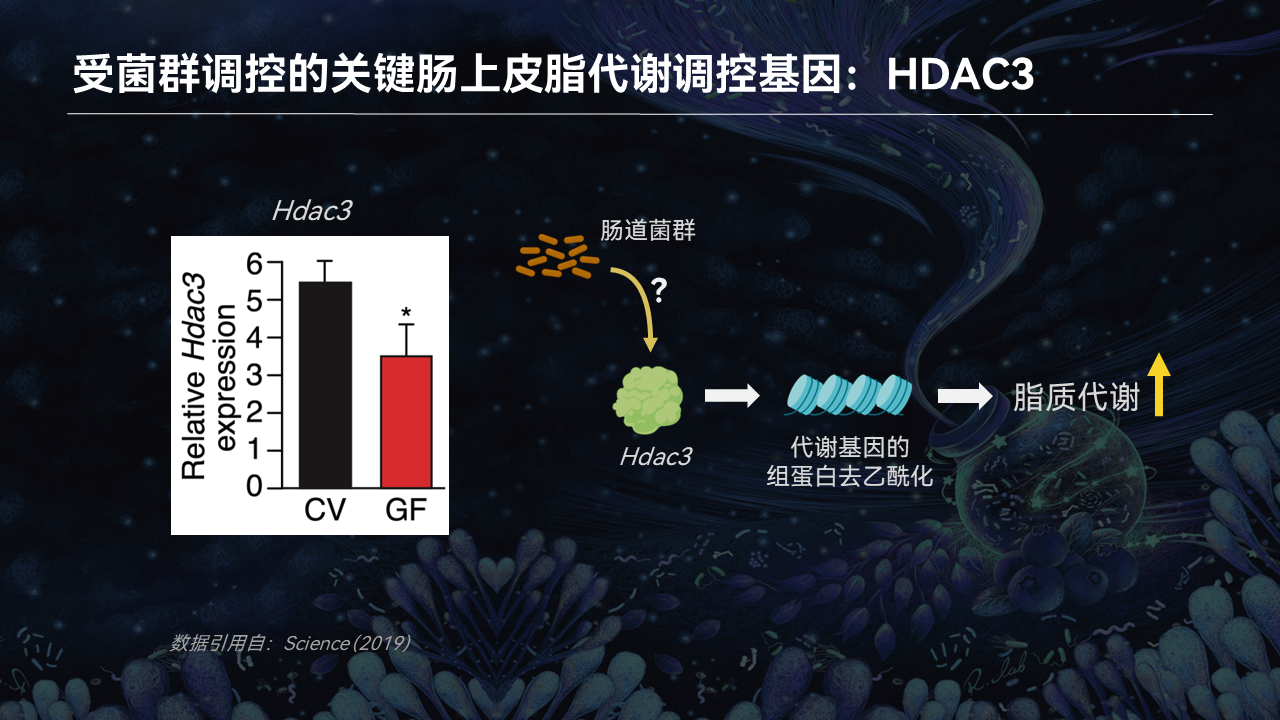
通过对无菌小鼠肠道上皮细胞转录组的分析,我们发现,HDAC3的表达确实在无菌小鼠显著降低。这说明,肠道菌群的确能通过HDAC3调控肠道的脂质吸收和代谢。
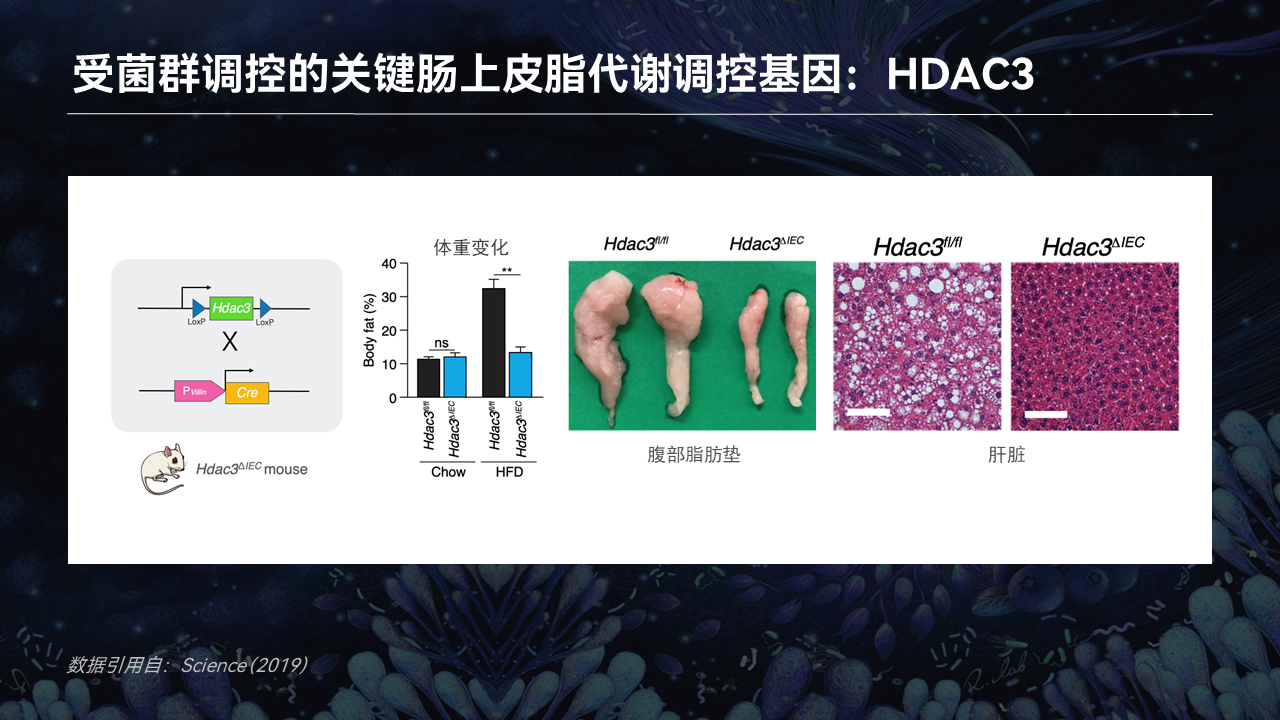
为了证明这一点,我们同样将HDAC3在小鼠的肠道上皮细胞中进行敲除。敲除HDAC3后的小鼠也表现出了不长胖的表型,在喂食高脂饲料后维持了很低的体脂率,积累了很少的腹部脂肪,以及没有出现明显的脂肪肝症状。
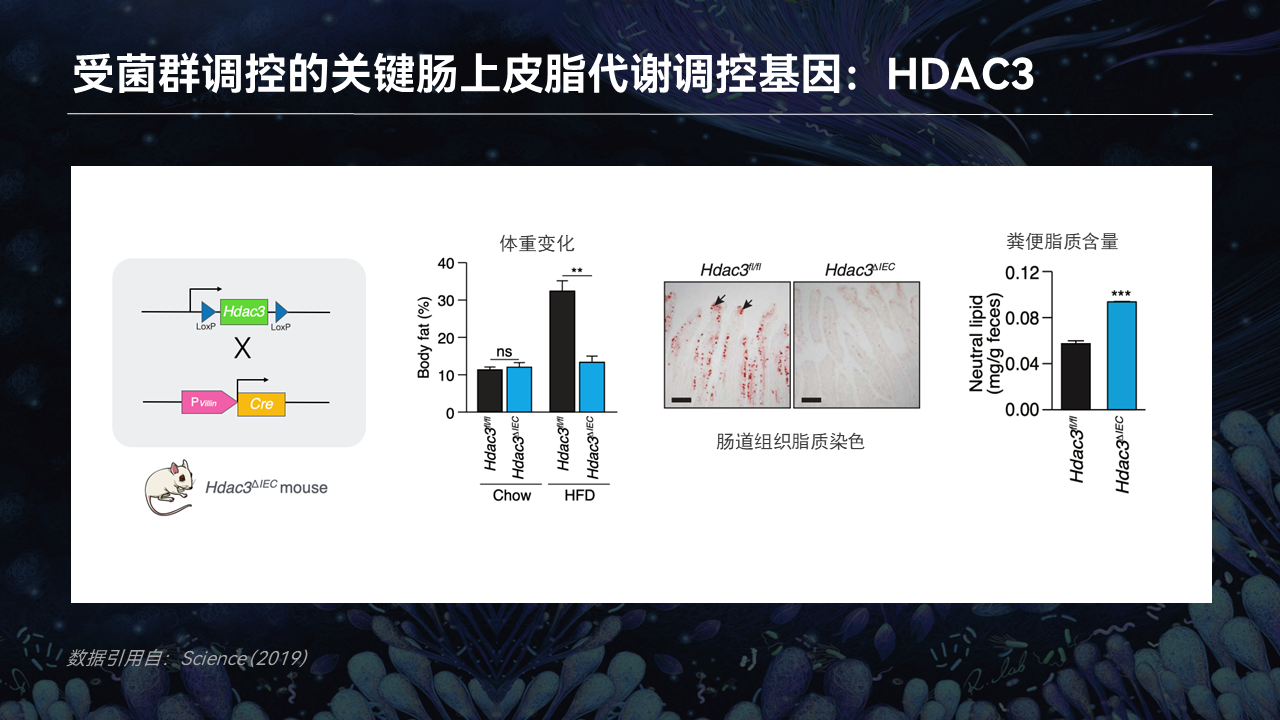
因为HDAC3同样调控了脂质的吸收过程,因此HDAC3敲除的小鼠肠道上皮细胞中的脂质积累也明显少于野生型小鼠,那些没有被吸收的脂质则被留在了粪便中。
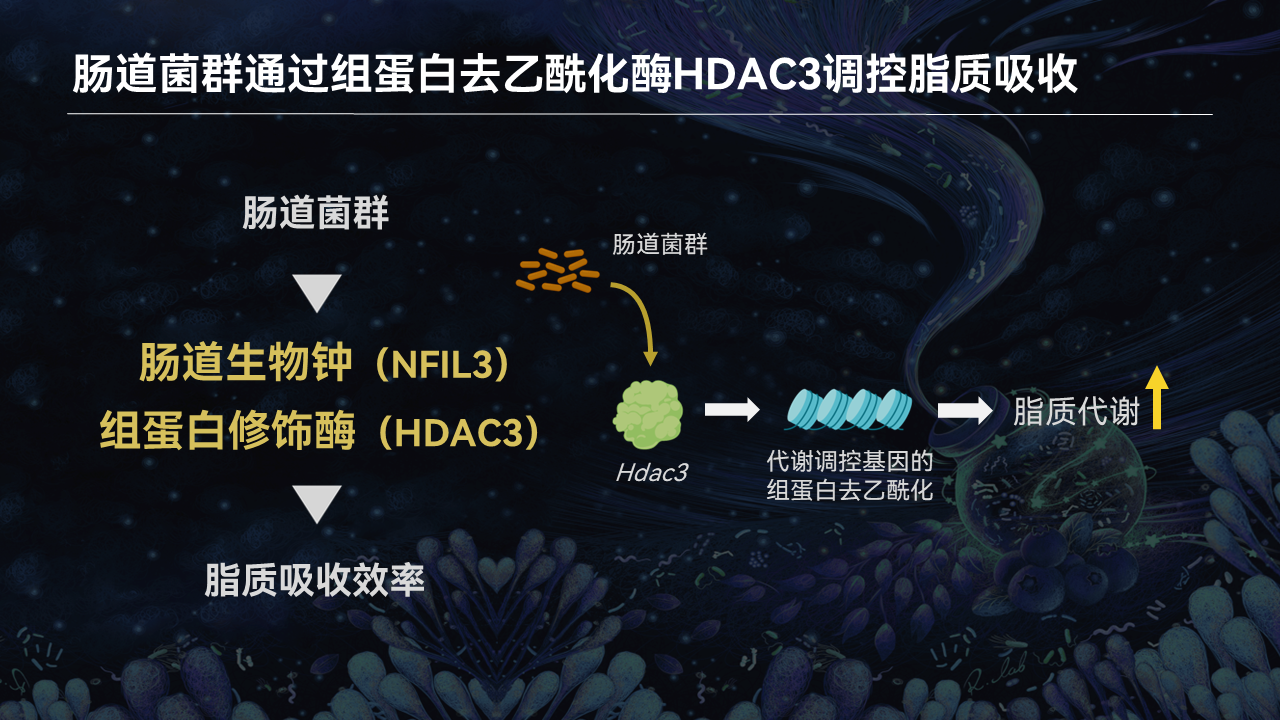
所以,这是我们继肠道生物钟后发现的第二条通路。也就是说,肠道菌群还能够通过调控关键的组蛋白修饰酶的表达,来影响肠道的脂质吸收和代谢。
长链非编码RNA Snhg9
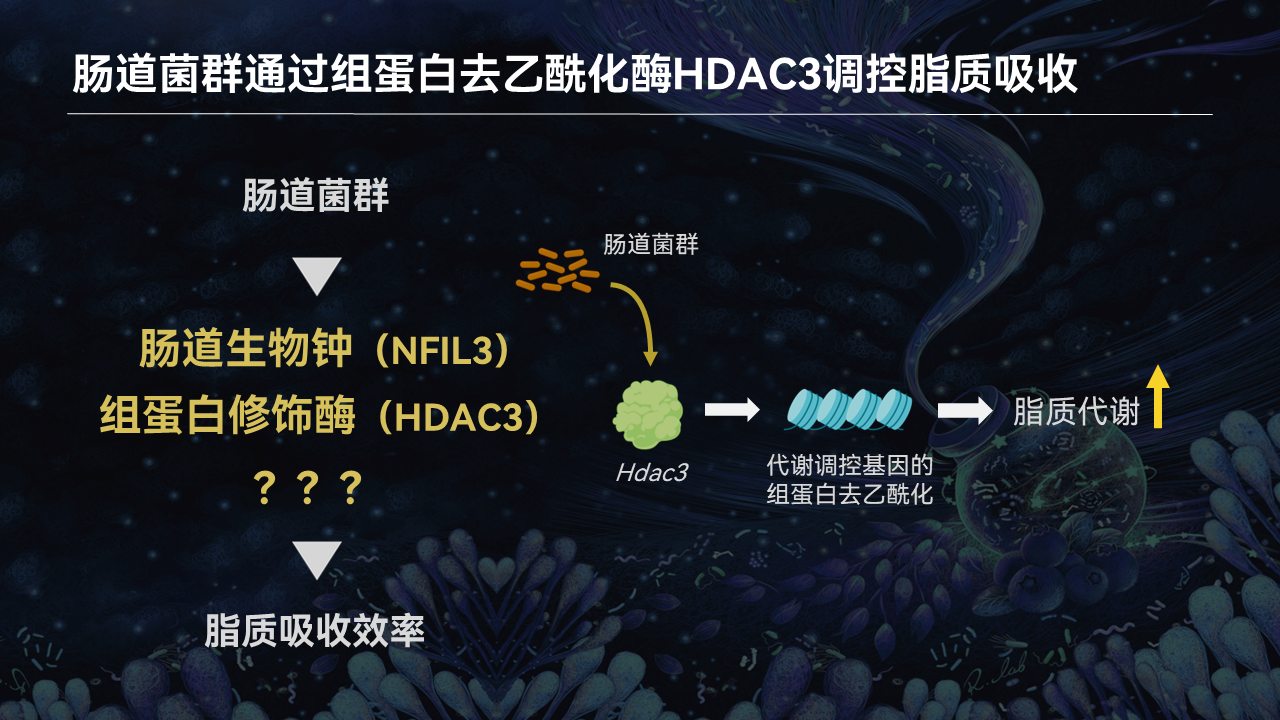
那还有没有第三条通路呢?还确实有。

我们最近的研究发现,有一个名为小核仁RNA宿主基因9(Snhg9)的长链非编码RNA,在无菌小鼠肠道上皮细胞的表达显著上升。
那非编码RNA的表达升高,是不是也和无菌小鼠不长胖的表型密切相关呢?
我们知道长链非编码RNA是一种不翻译蛋白质,但也是在各类生理活动中发挥重要调控作用的一类分子。
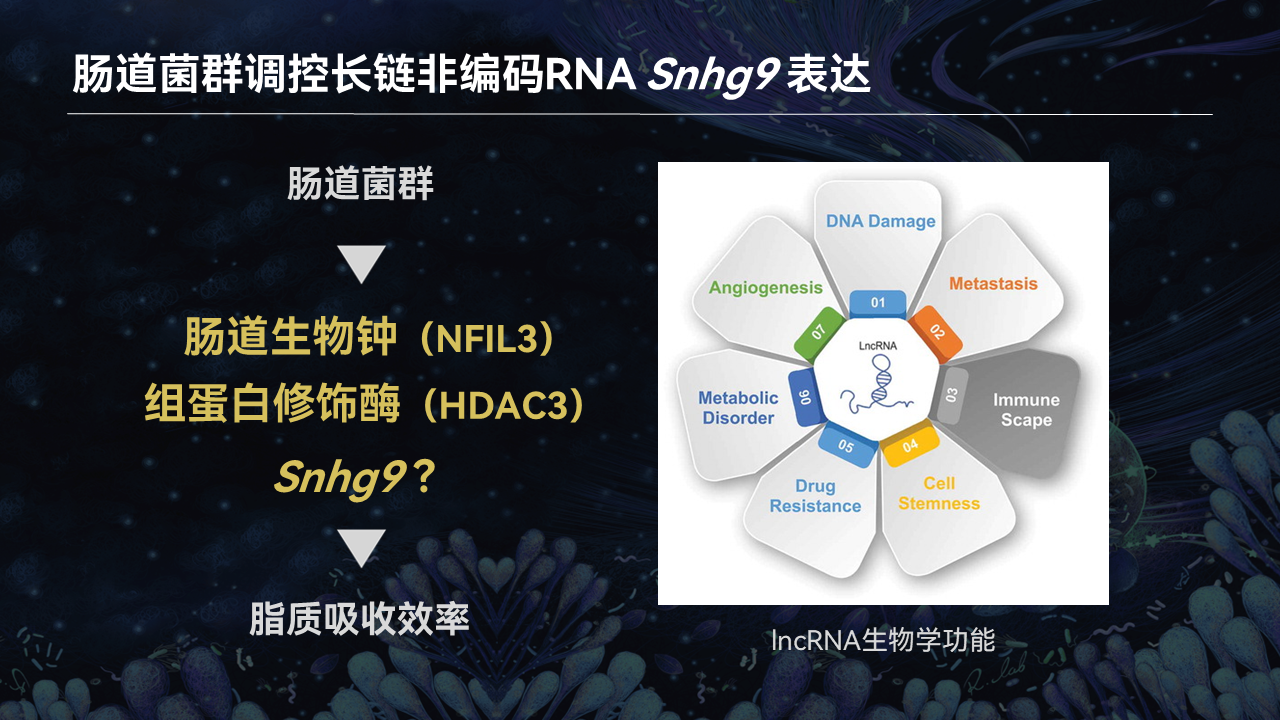
因此我们有理由认为,Snhg9在肠道菌群调控脂质吸收过程中也发挥了非常重要的作用。

为了探索Snhg9的功能,我们将Snhg9在小鼠的肠道上皮细胞中特异性地过表达。
我们发现,一旦Snhg9的表达升高了,小鼠也会出现体脂率下降、不易发生饮食诱导的脂肪肝,以及肠道脂质吸收效率显著降低的现象。

这些结果都说明,肠道菌群的确能够通过长链非编码RNA来影响肠道的脂质吸收。而肠道菌群对脂质吸收的调控是一个非常复杂的过程,里面包含了多种机制的参与。

这些结果也在机制上解释了为什么无菌小鼠能够做到怎么吃都不胖的原因。
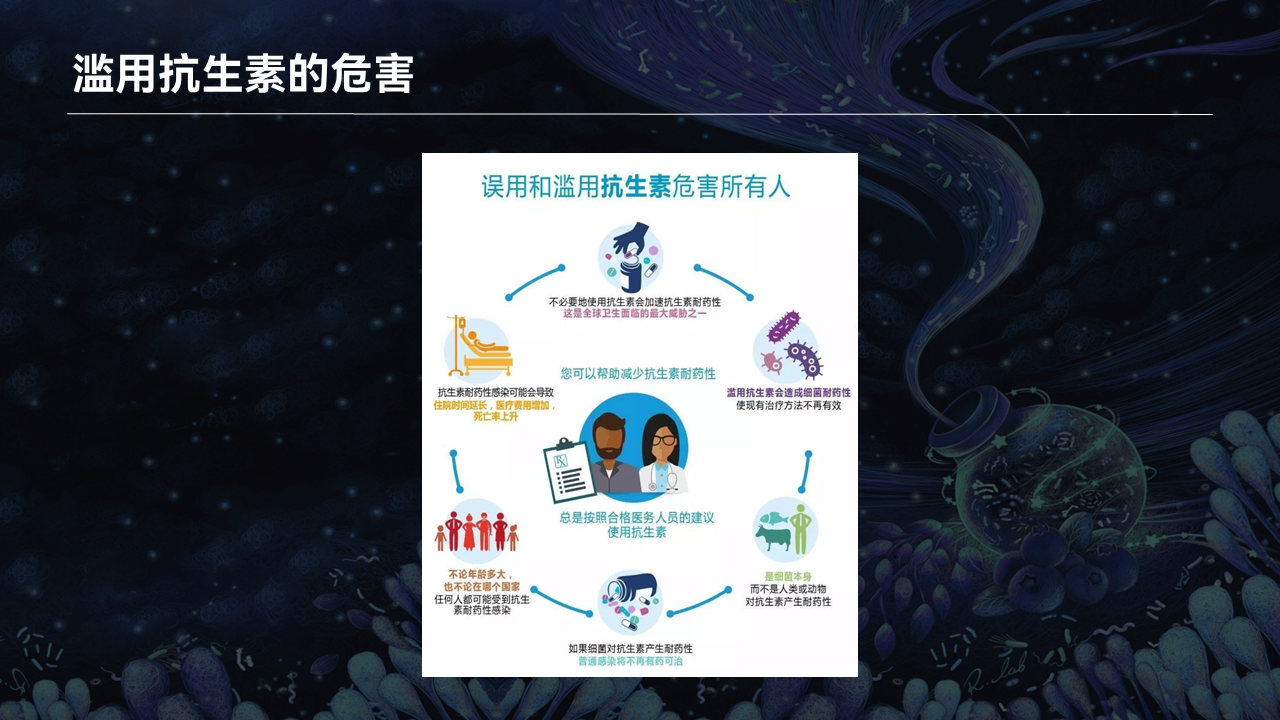
可能很多人会问,我们能不能通过服用抗生素来减肥呢?答案是万万不可!
因为滥用抗生素的危害已经被明确报道,滥用抗生素会加速耐药细菌的出现,导致细菌对抗生素产生抵抗,以至于在感染病菌后不再有药可用。这也是目前全球卫生领域面临的最大威胁之一。

因此我们一定要牢记,千万不要试图通过抗生素来减肥!

其实我们在研究中发现,Snhg9的表达并非在肠道菌群存在的情况下时刻被抑制。当我们改变肠道菌群的组成时,Snhg9的表达会随之发生变化,而该组小鼠的体脂率也会随着Snhg9的表达升高而降低。
因此我们可能可以通过人为改变肠道菌群的组成,比如服用某些能够提高Snhg9表达的益生菌来降低肠道的脂质吸收效率,达到减肥的目的。这也是我们未来的目标。

希望通过我们的基础研究搞清楚肠道菌群调控脂质吸收的分子机制,并且在研究的基础上开发出基于肠道菌群的治疗方法,比如通过益生菌、益生元、菌群移植等手段,在现实中实现治疗或缓解肥胖等代谢性疾病的目的。

我的分享到此结束,感谢聆听!


