
大家好,我是来自重庆医科大学附属第一医院的郑鹏。非常高兴今天来到《肠·道》,跟大家分享从肠道微生物组探索抑郁症的发病机制。


既往的话大家都知道,大脑作为我们全身的中枢,通过我们的神经内分泌系统、神经系统等,控制我们包括肠道在内的各种重要的外周器官。
但是在 2011 年有科学家提出,肠道微生物可以通过我们的微生物源的免疫、微生物源的代谢、微生物源的神经递质以及我们的肠-脑神经通路等,反向作用于我们大脑,影响我们大脑的功能以及行为。
该理念的提出就是今天要着重跟大家分享的微生物-肠-脑轴。这个概念的提出,对我们既往的以脑疾病“脑分子”异常学说为主的学说,提出了一个新的思路。
我们既往的这些研究都聚焦于脑内本来的分子异常学说。现在开发的药物也是针对于这些脑内的学说而开展的。
但是大家都知道,我们人体存在着血脑屏障。因此,很多药物很难透过我们的血脑屏障达到我们的中枢。
因此,微生物-肠-脑轴的提出,为我们研究脑疾病的发病机制、筛查新的干预靶点,提供了一种新的思路,有望“脑病肠治”。
我们来回顾一下在这个领域的一些重要的研究。
大家知道,我们要去研究肠道微生物与脑是否有联系,就需要用到一个非常重要的模式生物,就是我们的无菌老鼠。
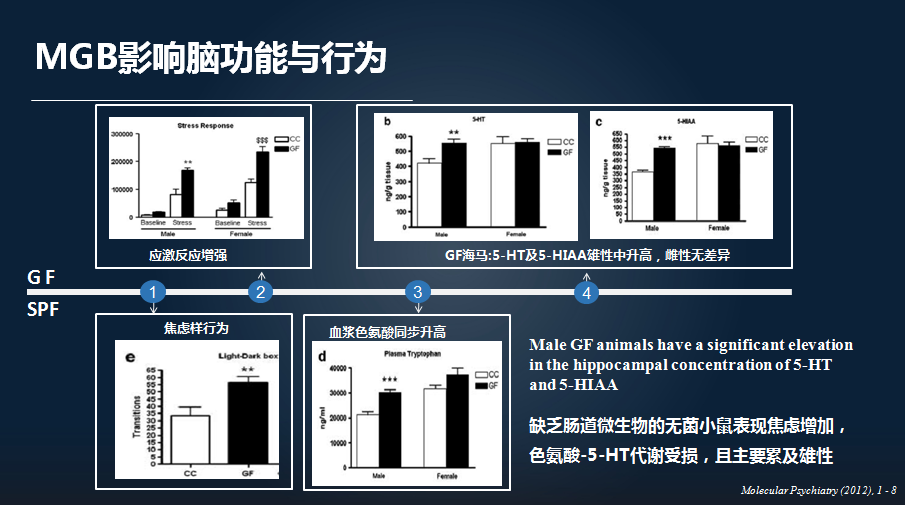
通过比较无菌老鼠和我们正常的 SPF(无特定病原体)老鼠,我们可以从“全”和“无”两个角度,去评价肠道微生物是否影响我们脑的功能以及行为。
这里的研究发现,缺乏肠道微生物的无菌老鼠表现为焦虑样行为,并且具有疾病的性别特异性。
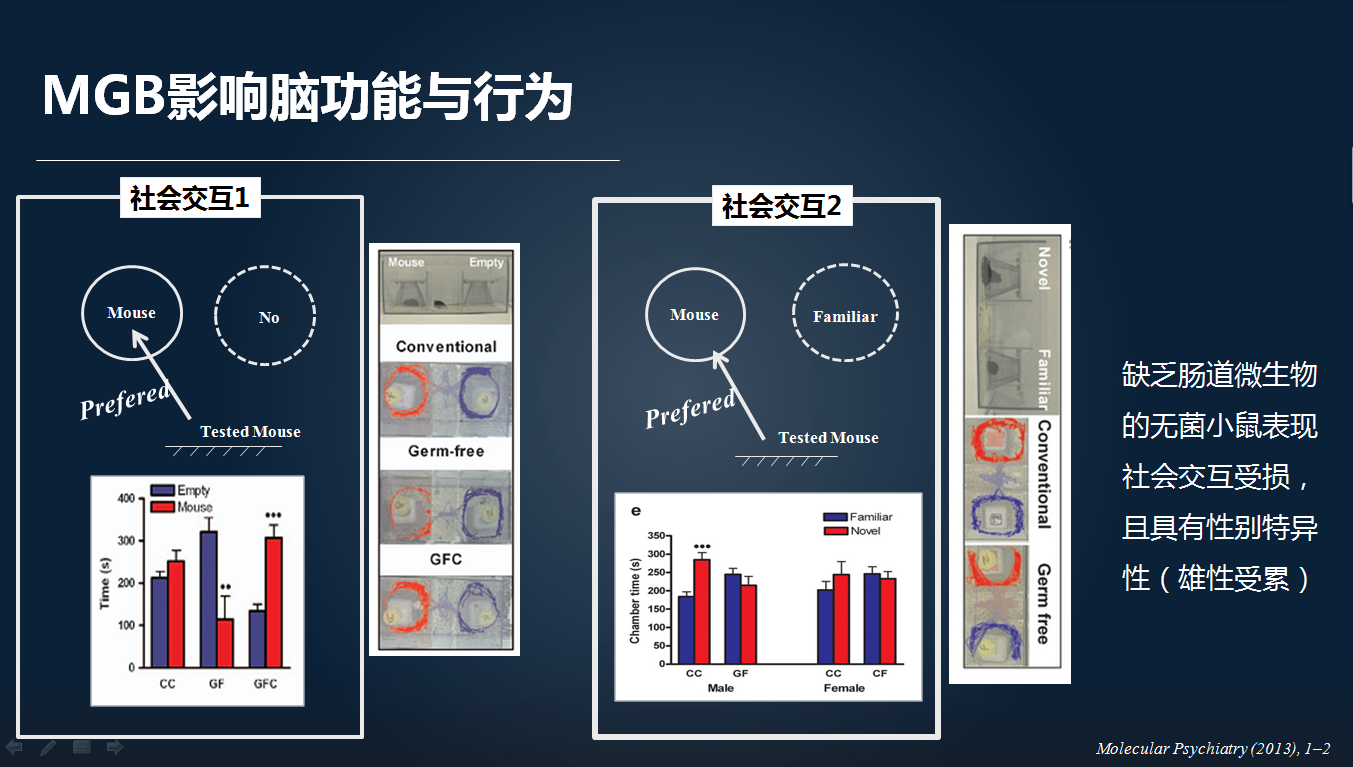
2013年,另外一个课题组研究发现,缺乏肠道微生物的无菌老鼠可以出现社会交互行为的改变。
大家都知道,我们的焦虑样行为和社会交互行为与我们重大的精神疾病,比如焦虑症、自闭症等密切相关。

我们前面的这两个研究从神经生化的角度证实,肠道微生物可以调控我们脑的神经生化。但是很多人就想,那肠道和脑之间是否存在直接的联系?
在 2018 年,Cell 和 Science 这两篇研究系统地绘制了肠到脑之间的神经通路,这为研究微生物-肠-脑轴开启了新的篇章。

大家知道,我们在 2011 年提出了很多新的想法,经过这么几年都得以证实。
比如我们刚才讲的微生物如何作用于脑这几条通路,现在通过动物研究已经基本证实。此外,哪些因素可以影响我们肠-脑轴也基本明确。同时,越来越多的临床研究和我们临床转化研究提示,我们肠道微生物紊乱所介导的肠-脑轴与我们重大的神经、精神疾病高度相关。

我们自己课题组聚焦的是微生物-肠-脑轴与抑郁症的相关研究。
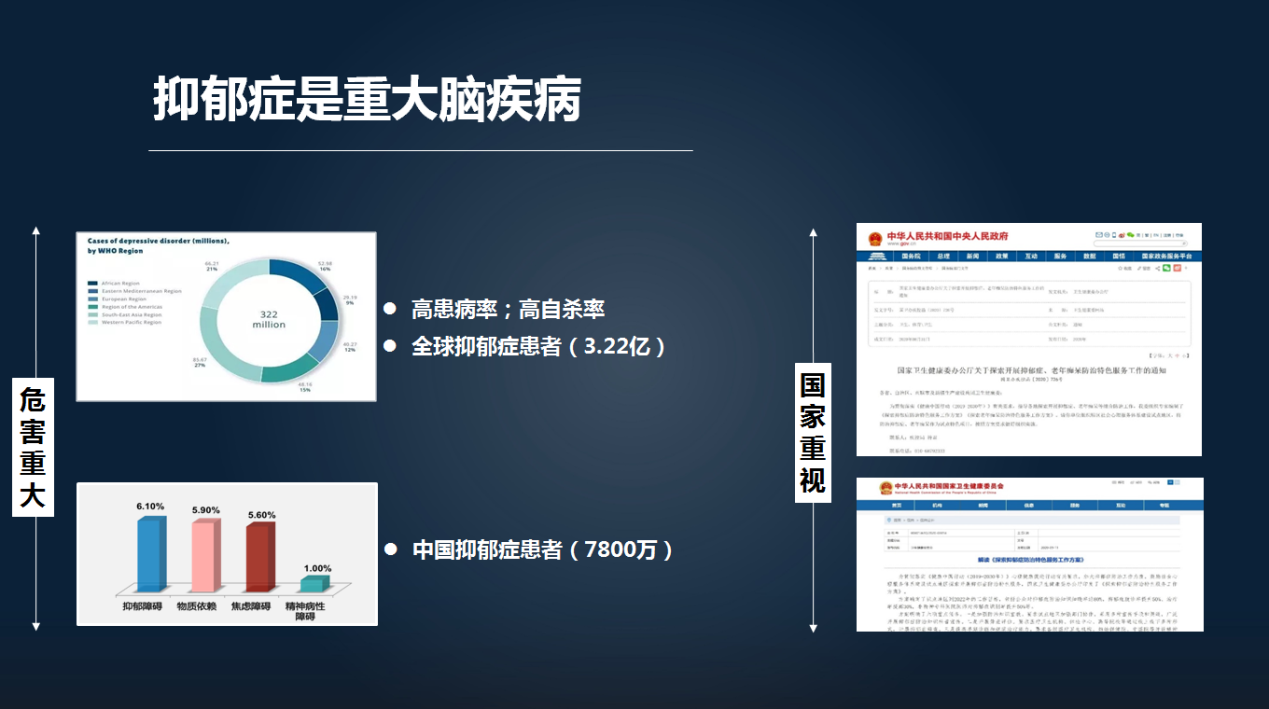
抑郁症是我们当今一个非常重大的精神疾病,它具有高患病率、高自杀率以及复发率高的特点,给家庭和社会带来沉重的负担。
我们国家在即将启动的“脑计划”以及我们既往的国家重大、重点研发计划,都将抑郁症等重大脑疾病作为重点支持方向。
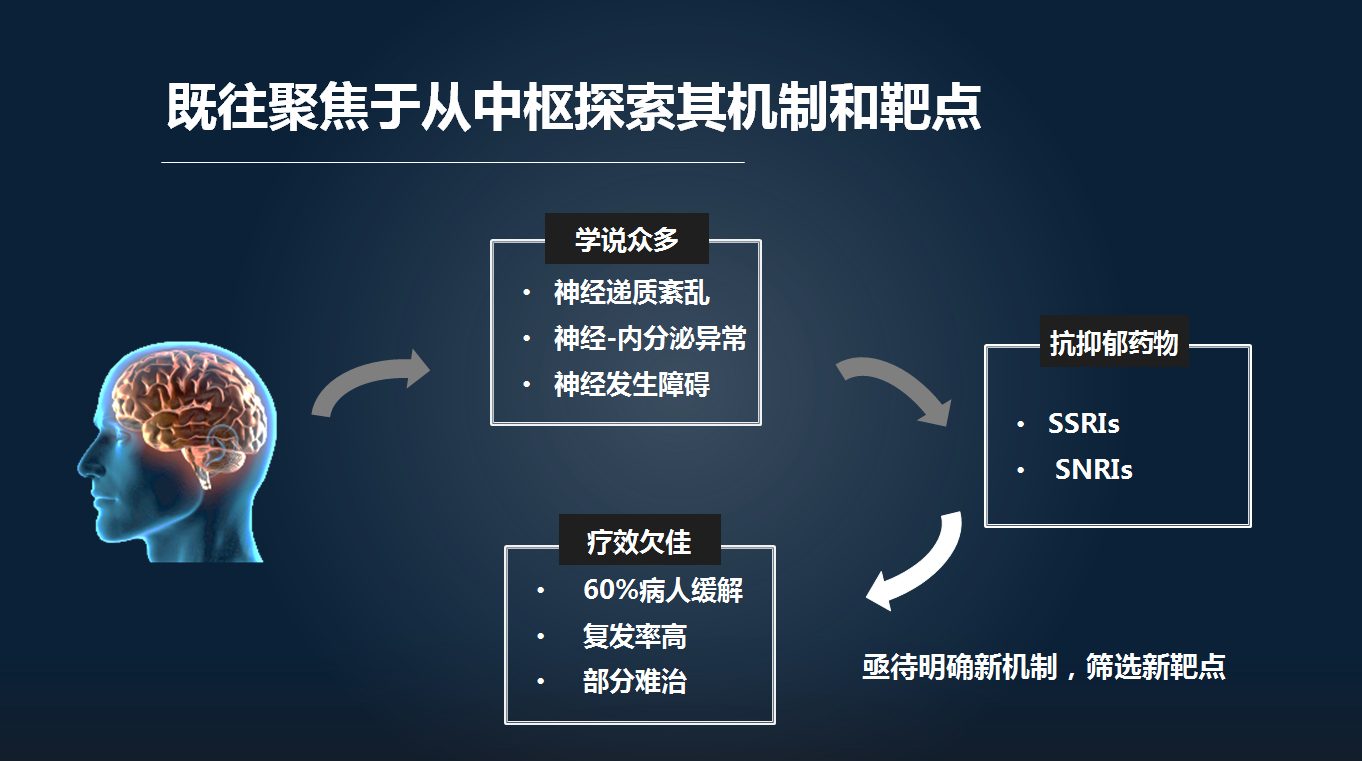
抑郁症的发病机制学说很多,但是都主要聚焦于中枢神经系统的紊乱,包括神经递质紊乱、神经内分泌异常以及神经发生障碍等等。
基于这些学说所开发的抗抑郁药物,如临床上用得非常多的 SSRI 类药物(选择性 5-羟色胺再摄取抑制剂),也仅能使 60%的病人得以缓解,部分病人对现有的药物耐药。
这就提示,我们现有的学说是否完整地解释了抑郁症的病理、生理机制。因此,在丰富既往学说的同时,我们亟待挖掘新的抑郁症的发病机制,寻找到新的干预靶点。

在七、八年前,我们课题组在开展抑郁症的生物标志物研究的时候,偶然发现抑郁症患者伴有微生物源的代谢紊乱。
其实,我们在开展这个研究的时候,我们旨在筛选抑郁症的尿液生物标志物,希望找到一些可以运用于抑郁症的诊断和鉴别诊断的指标。
但是非常偶然,我们发现这些抑郁症所伴有的尿液代谢产物中,有一大类是我们人体与微生物的共代谢产物。

这一新的线索被美国生物化学与分子生物学会指出,这可能是一个新的值得我们探索的领域。所以我们也非常偶然地从 2013 年进入了抑郁症与微生物-肠-脑轴这一新的研究领域。
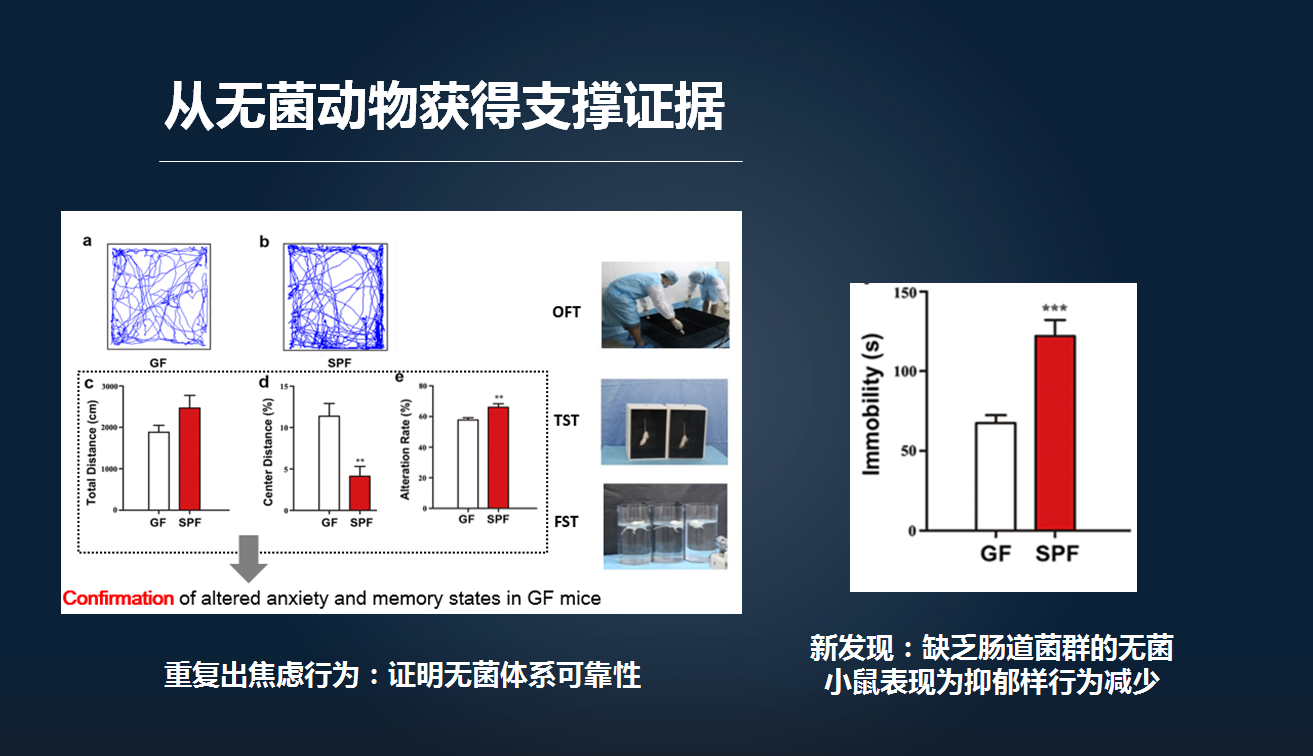
我们前面得到一个初步的临床证据之后,要进一步去夯实这个临床的线索。因此我们参考既往的研究,首先比较了无菌老鼠和正常的 SPF 老鼠。
研究缺乏肠道微生物的无菌老鼠,我们除了重复了文献所报道的其与焦虑行为相关之外,我们还发现,它与抑郁样行为以及我们这里所做的强迫游泳实验,也有高度相关,从而提示肠道微生物的确可能与我们抑郁症的发生存在关联。
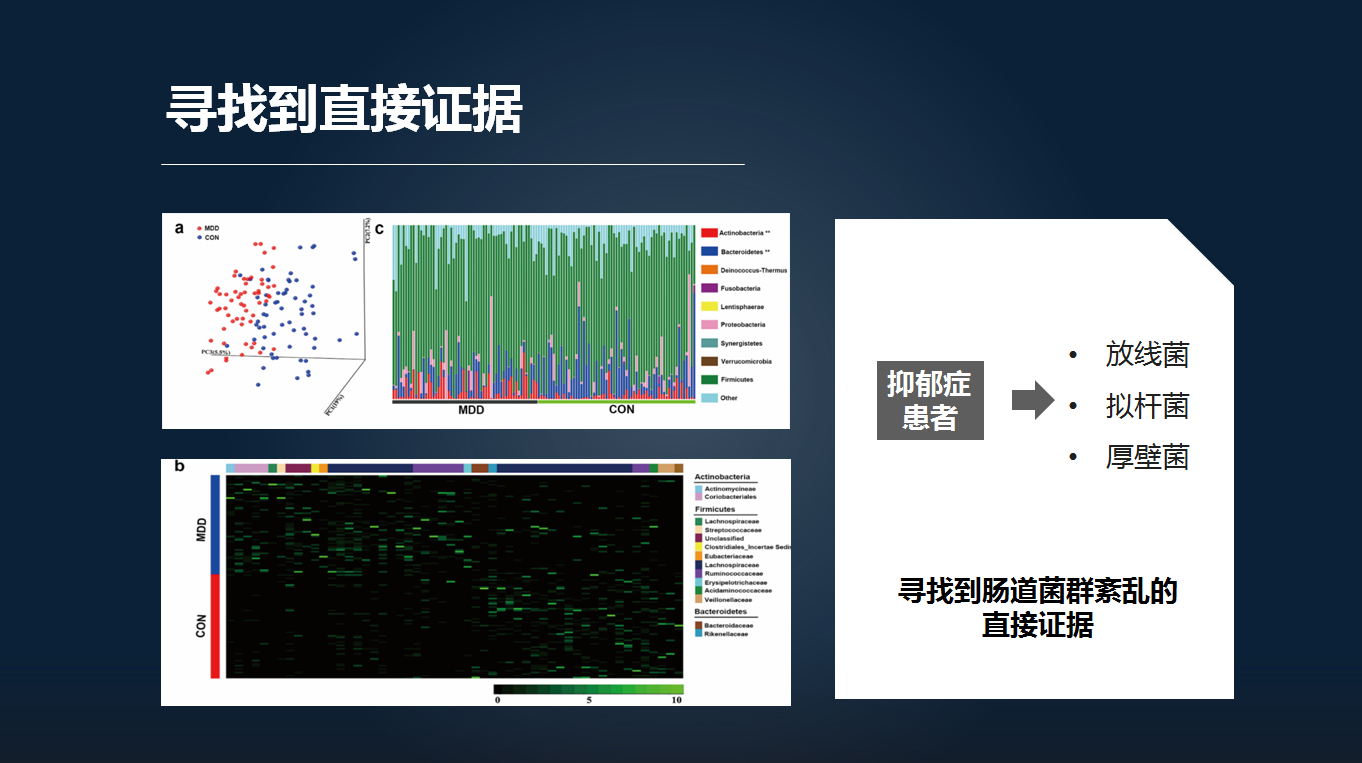
我们下一步就要去寻找到抑郁症是否伴有肠道微生物紊乱的直接证据。因此,我们收集了抑郁症患者以及健康对照的粪便,开展了菌群结构分析。
我们发现,抑郁症患者的整体微生物的表型与健康对照显著不同。抑郁症患者在门的水平主要伴有放线菌、拟杆菌和厚壁菌的紊乱。

我们所观察到的抑郁症患者伴有肠道微生物的紊乱,它是一个原因还是一个结果?因此,这里我们做了一个粪菌移植实验,我们将抑郁症患者以及健康对照的粪便移植给无菌老鼠。
我们发现,移植抑郁症患者粪菌的无菌老鼠表现为典型的抑郁样行为,在强迫游泳或悬尾实验中表现为不动时间的延长,而两组之间的运动能力没有差异,从而证实,肠道微生物组的紊乱可能是抑郁症发生的潜在原因。
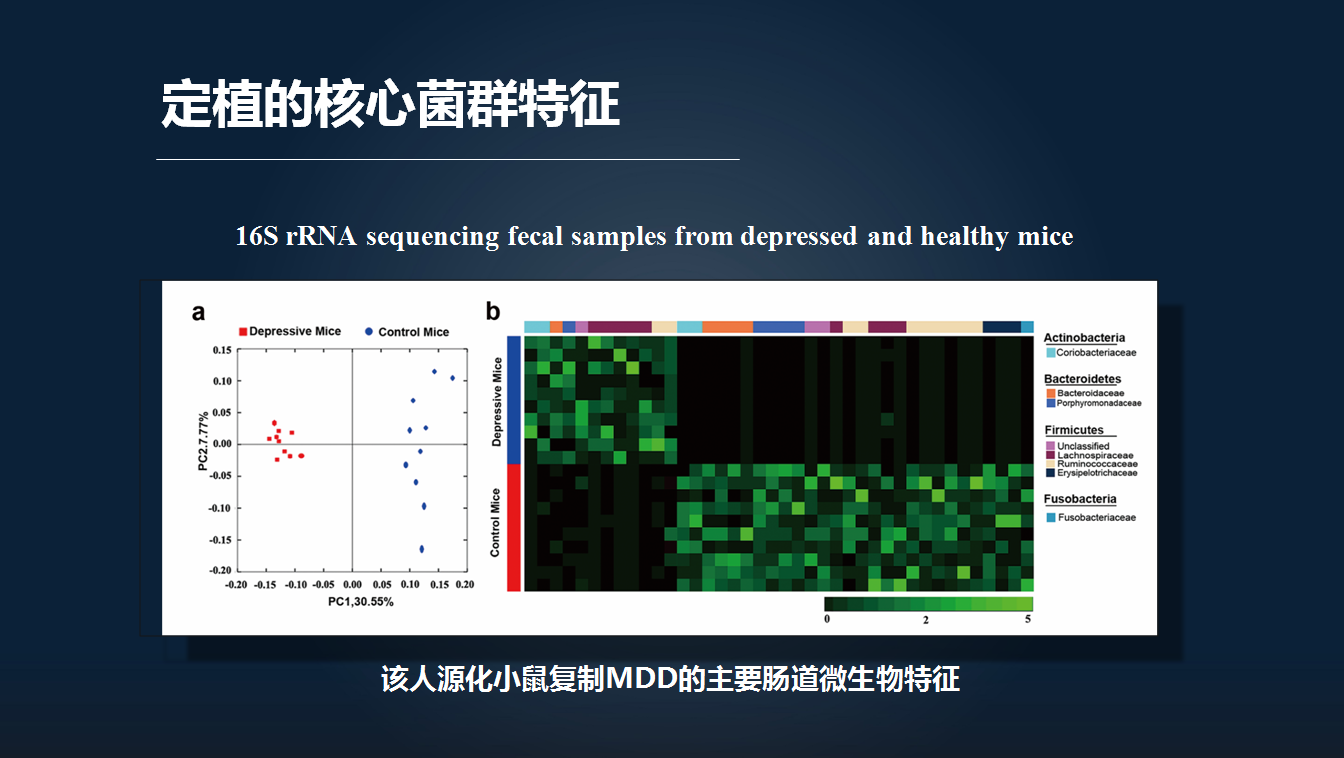
我们所构建的人源化抑郁小鼠既然出现了一个典型的抑郁样行为,那么抑郁症患者粪便的微生物特征是否成功传递给了无菌老鼠?因此我们对人源化抑郁小鼠粪便做了分析。
我们发现,的确与抑郁症患者微生物结构一样,人源化抑郁小鼠也重复出相关的微生物的改变。

进一步的分子机制探索发现,紊乱的肠道微生物主要通过介导肠-脑轴的碳水化合物以及氨基酸紊乱,介导抑郁行为的发生。
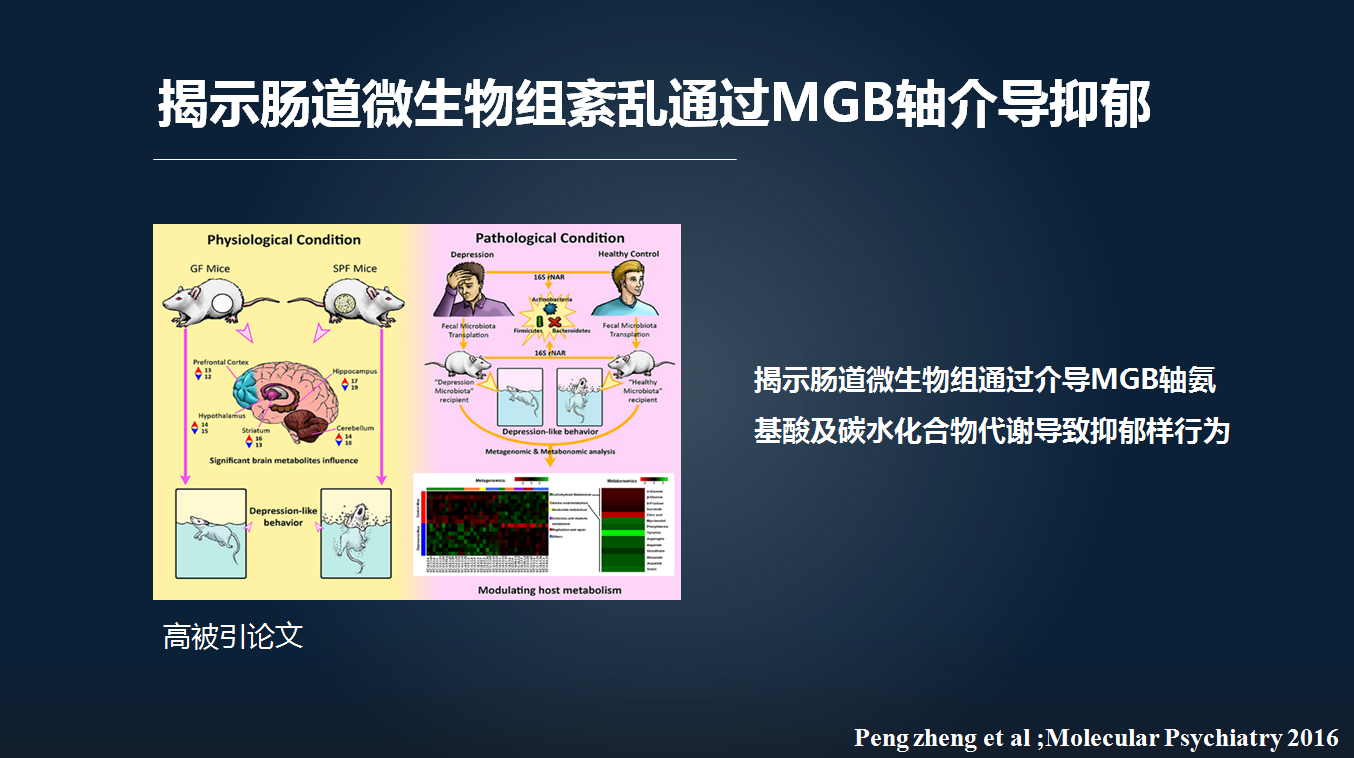
因此,我们通过前面从临床然后到动物实验初步证实,肠道微生物的紊乱可以通过介导微生物-肠-脑轴导致抑郁行为的发生。

接下来我们就需要进一步去明确,我们所观察到的紊乱的肠道微生物组是否具有疾病特异性。如果我们所发现的这个现象不是只聚焦于抑郁症,其他的神经、精神疾病如果也伴有相同的肠道微生物紊乱,那我们的研究的价值就比较有限。
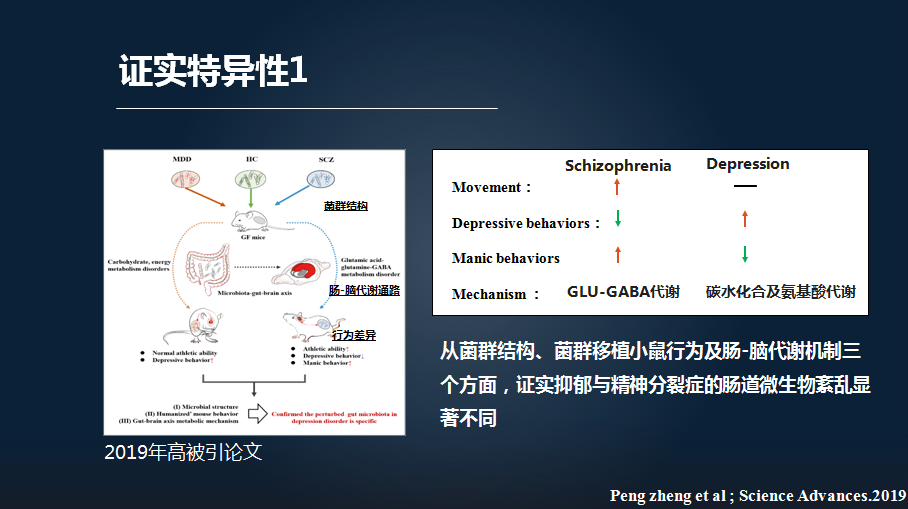
首先我们比较了抑郁症与精神分裂症患者。
我们发现,抑郁症患者与精神分裂症患者其菌群结构,以及粪菌移植所构建的人源化抑郁小鼠行为,及所介导的肠-脑机制三个方面都存在显著不同。
比如我们发现,将精神分裂症患者的粪菌移植给无菌老鼠,该老鼠表现为运动的增加、躁狂样行为的增加以及抑郁样行为的减少。其分子机制表明,其紊乱的肠道微生物主要调控肠-脑轴的谷氨酸和γ-氨基丁酸的代谢。这与我们前面讲的抑郁症显著不同。
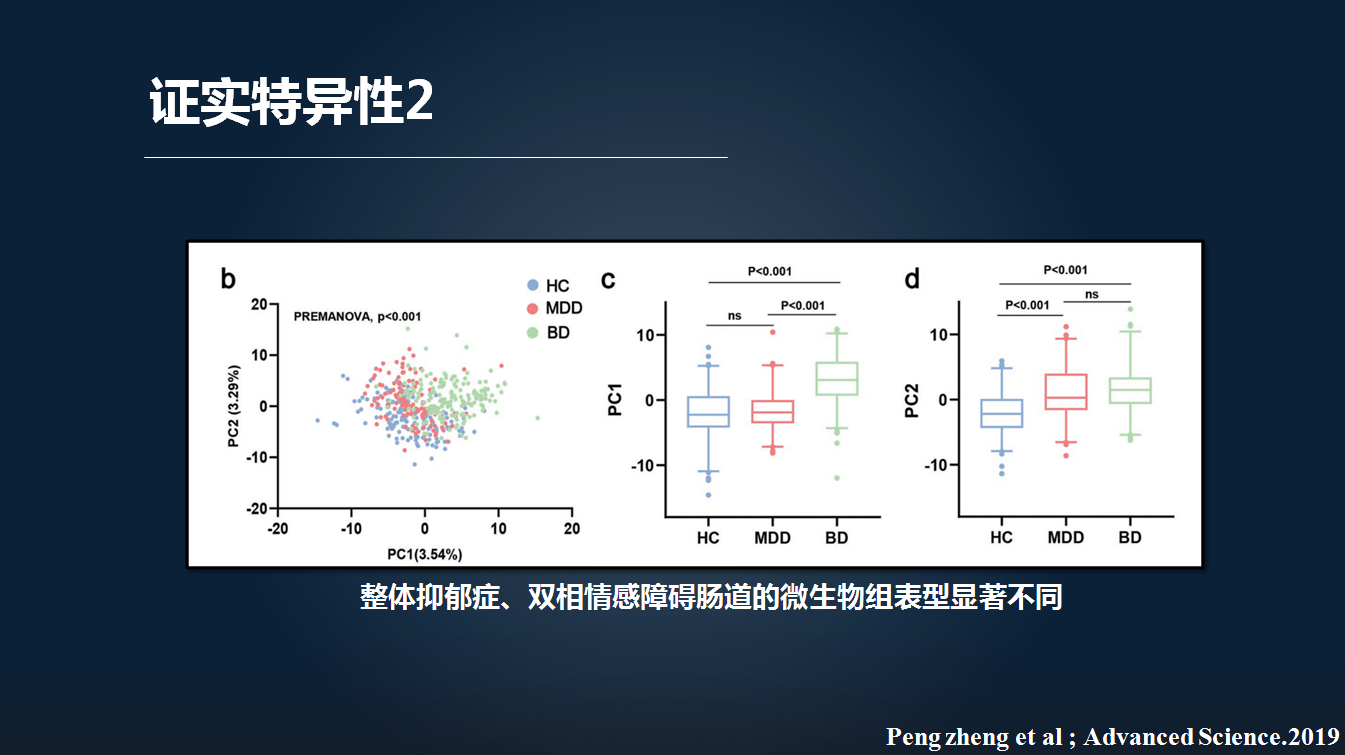
在临床上,抑郁症患者特别难以与双相情感障碍伴有抑郁发作的患者所鉴别。双相情感患者往往经历两个阶段,一个是抑郁发作,第二个是躁狂发作。但是绝大部分患者处于抑郁发作。
因此,我们比较抑郁症患者和双相情感障碍患者的微生物构成。我们发现,两者之间显著不同。
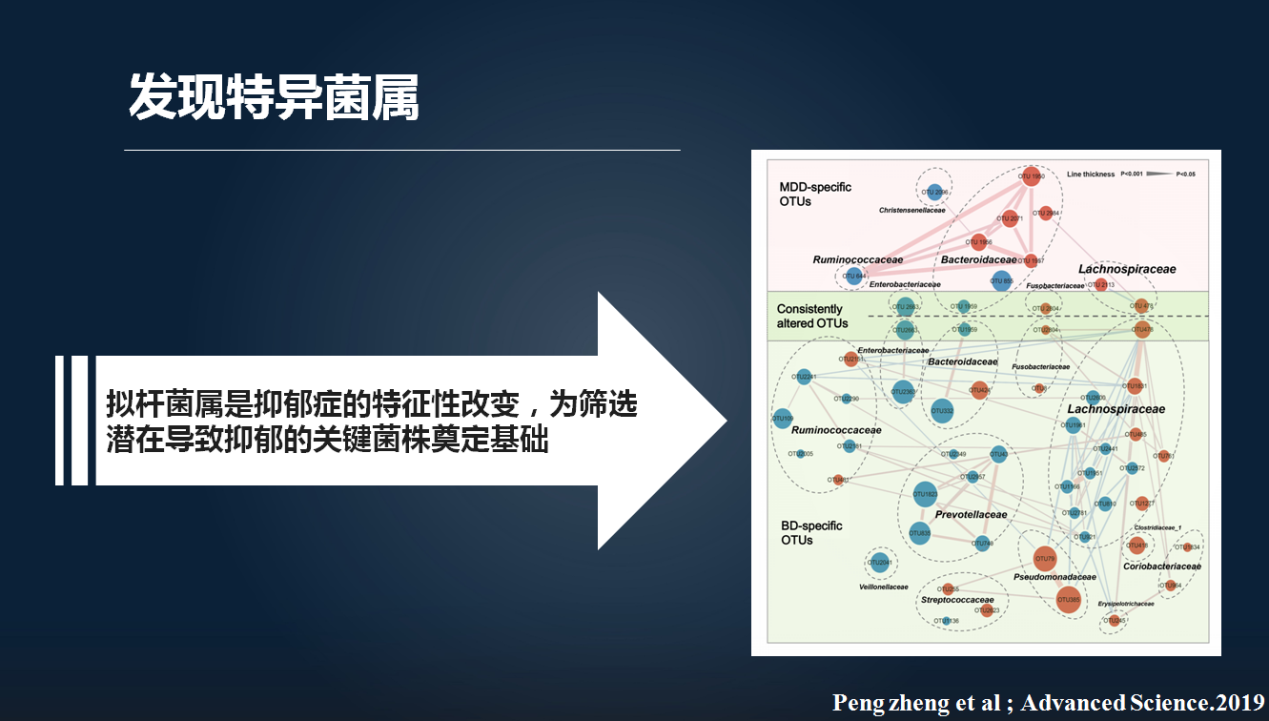
然后进一步的数据分析发现,拟杆菌属是我们抑郁症患者的特征性改变。这为我们下一步锁定抑郁症相关的关键菌株奠定了基础。

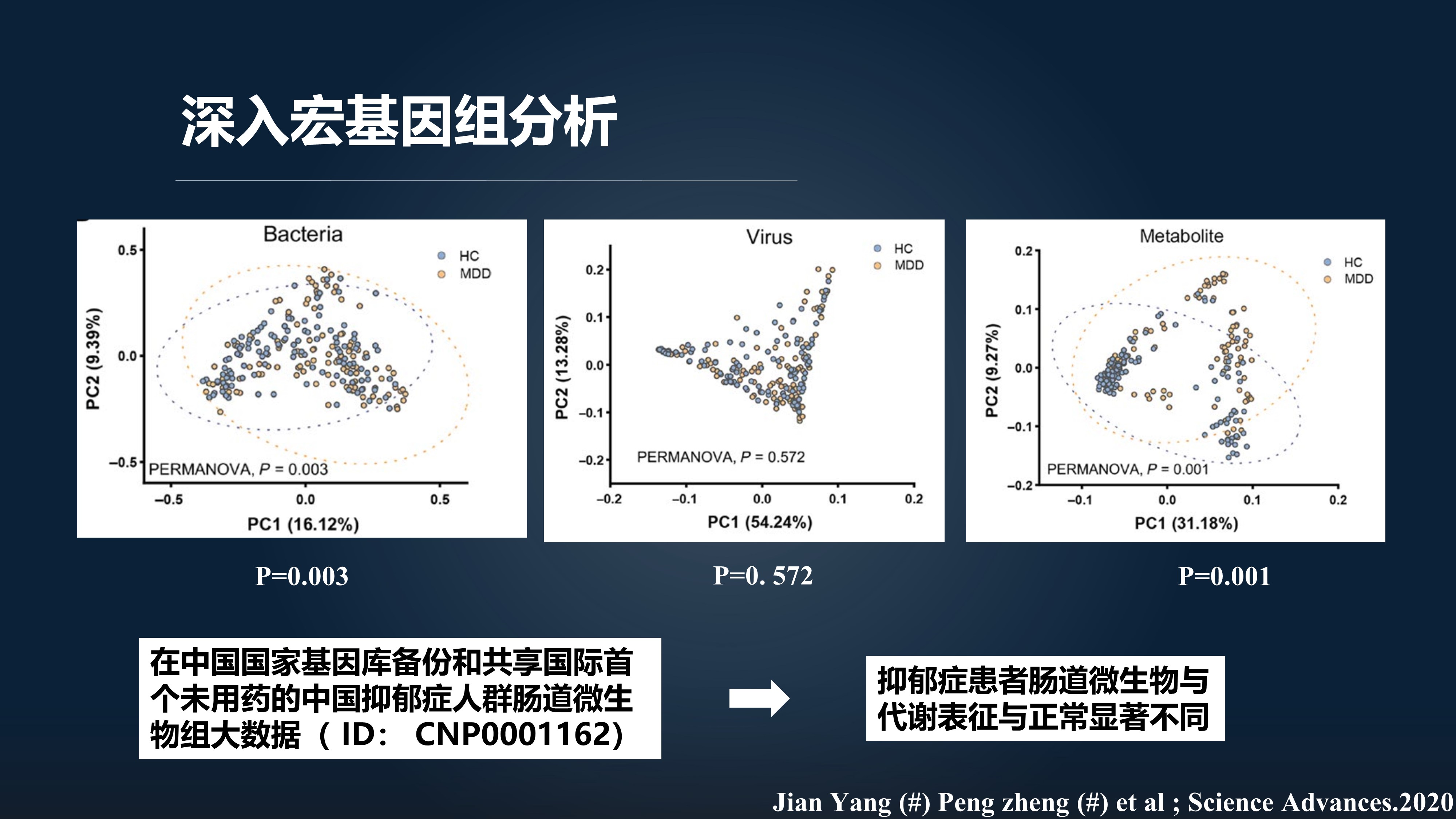
我们前面通过 16S测序初步锁定了拟杆菌属是我们抑郁症的关键菌属,下一步我们就开展了深入的宏基因组分析,旨在明确相关的菌株。
我们发现,首先与前面的研究结果一致,抑郁症患者与健康对照的微生物构成的确显著不同。

抑郁症患者主要伴有 9 株拟杆菌菌株的富集和布劳特氏菌的耗竭,这为我们下一步针对这些候选菌株开发相关的诊断试剂盒奠定了基础。
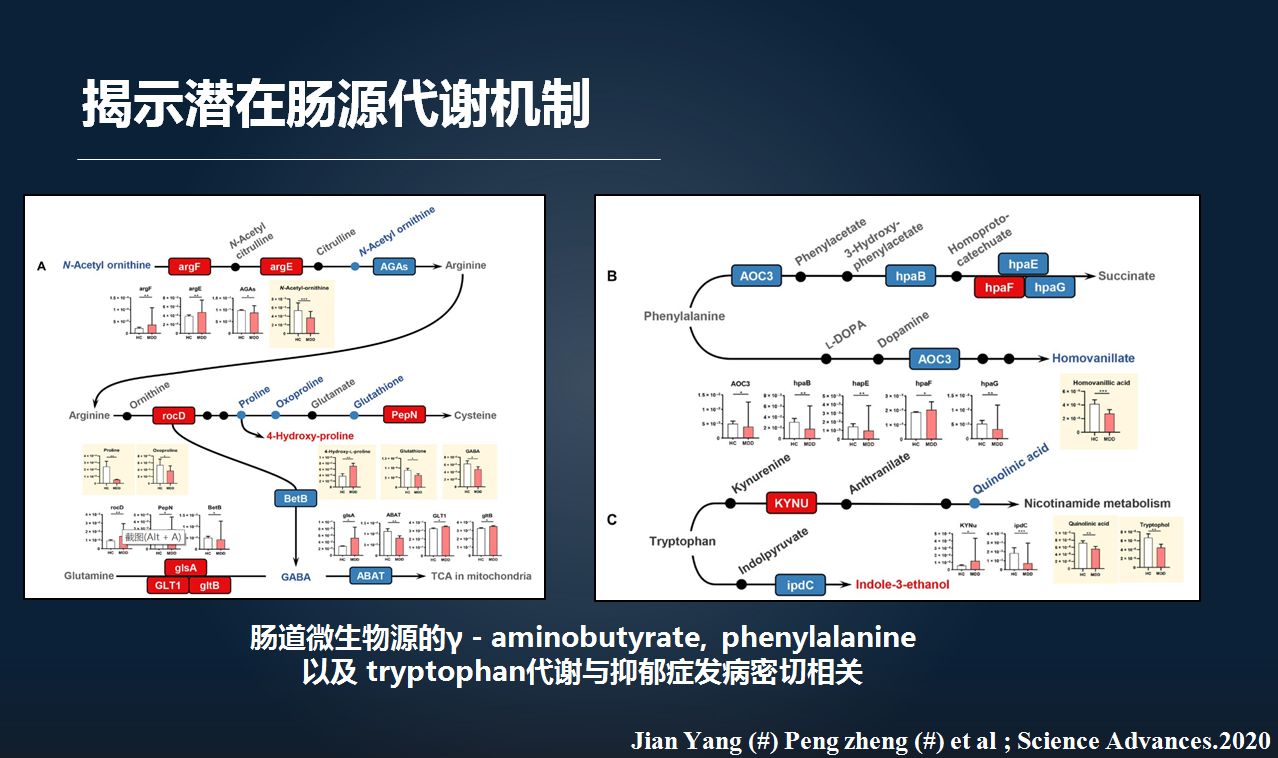
进一步的分子机制研究发现,这些紊乱的肠道微生物可能主要调控的是我们肠源的 γ-氨基丁酸、苯丙氨酸以及色氨酸等与抑郁症密切相关的分子通路。

大家都知道,我们临床的抑郁症研究提供了很好的证据,但是临床的样本往往受我们的药物、饮食等因素的影响。
因此,我们这里进一步地希望去明确,非人灵长类的抑郁猴是否伴有肠-脑轴紊乱。
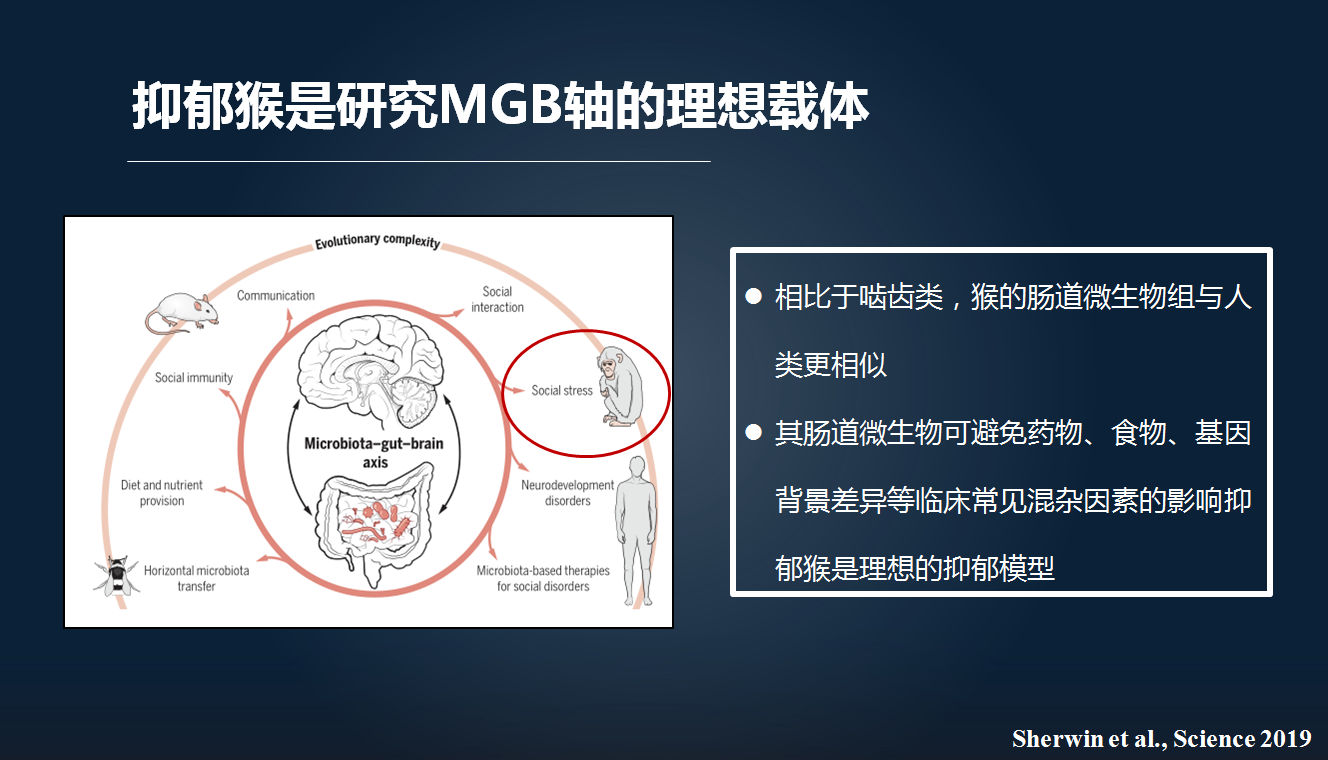
相对于啮齿类,猴的肠道微生物组的构成与我们人体更加接近。此外,它受其他临床上难以排除的混杂因素的影响更加小。
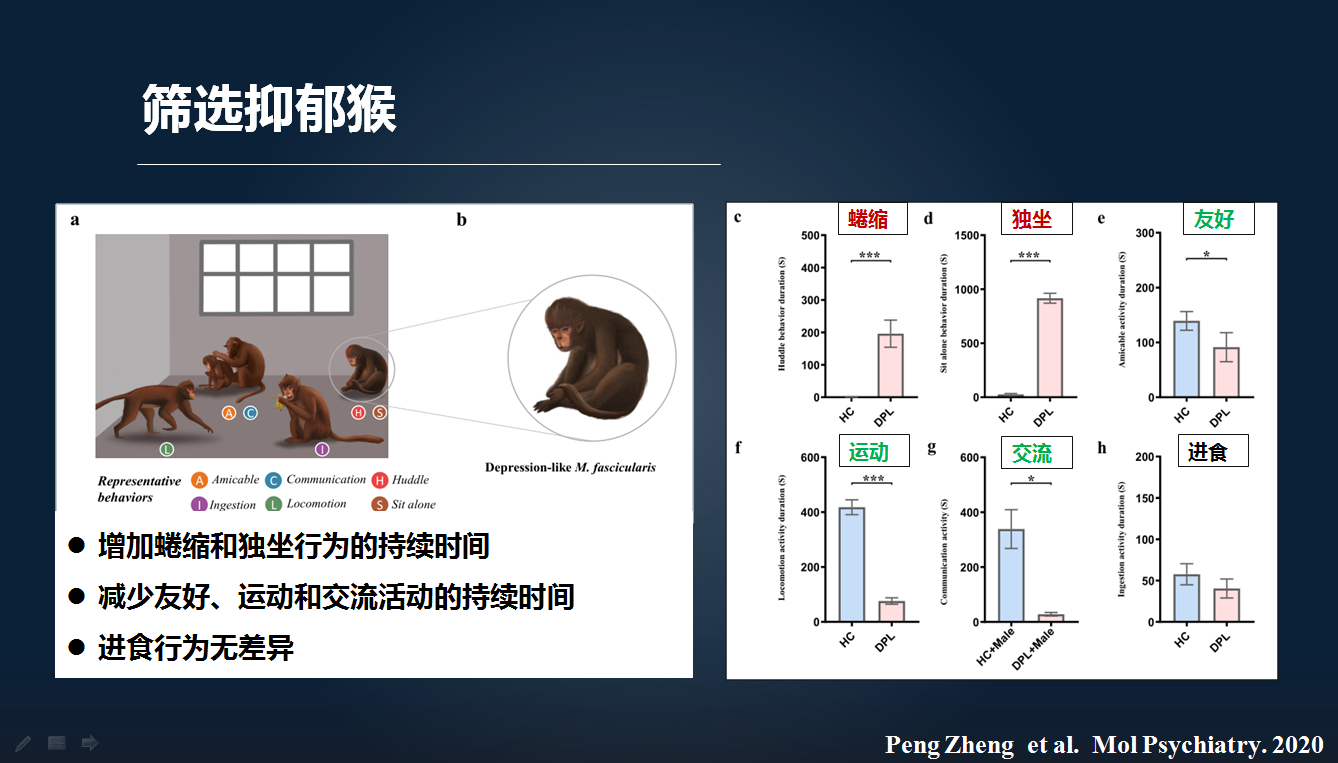
因此,我们根据我们前期课题组所建立的猴的行为编码的方法,从天然笼养状态下的猴里面筛选出了抑郁样猴和正常健康对照猴。
我们发现,这些抑郁猴主要表现为蜷缩和独坐的增加,而友好、运动或交流等行为减少。
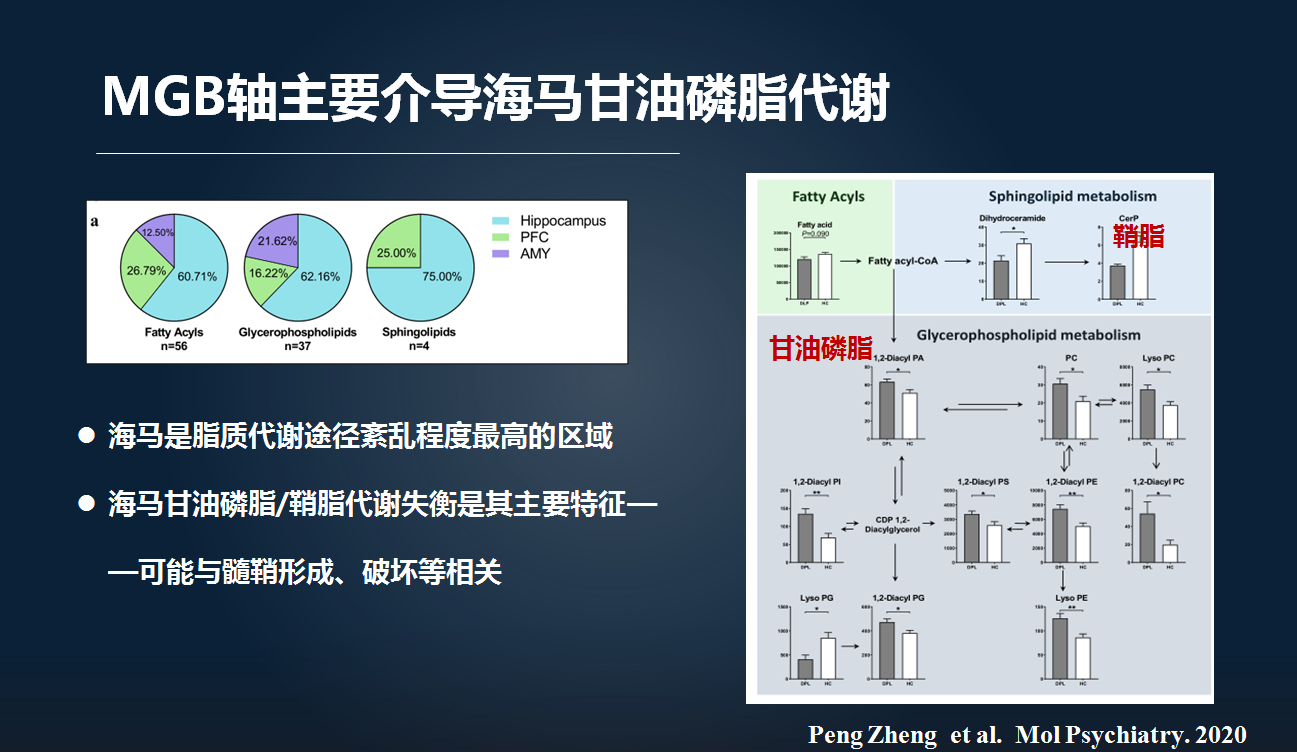
然后,肠-脑轴的代谢模块分析发现,紊乱的肠道微生物主要调控了肠-脑轴的甘油磷脂和鞘脂的代谢,主要影响海马这一关键脑区。

我们通过前面的研究初步明确了,抑郁症患者伴有肠道微生物紊乱,并且紊乱的肠道微生物可能是抑郁症发病的潜在原因,初步探索了其肠道微生物紊乱所介导的肠-脑代谢机制。
但是总体来讲,我们整个领域的研究仍然仅仅起步。我们现在正在聚焦的是进一步明确挖掘出导致抑郁症的关键菌株,明确其肠-脑机制,争取开发出基于关键菌株的一些诊断、鉴别诊断以及与治疗相关的试剂盒。
我们希望的就是,从微生物-肠-脑轴这一个新的领域,为抑郁症的诊治提供新的线索。

我们也希望与全国的同道一起,以微生物-肠-脑轴为切入点,推动我国在肠-脑轴、在以抑郁症为代表的脑重大疾病中的研究。
谢谢大家!



