
南京医科大学刘星吟教授团队
3月19日晚,Cell Host & Microbe 杂志上线了南京医科大学刘星吟教授和团队的最新研究论文,我们在3月20日的热心肠日报中曾专门进行了解读:
在该文章上线之前,我们对刘星吟老师进行了书面专访,请她对这项研究做一下解读。
我们一共提出了4个问题,请刘老师从对新研究的项目由来、意义、应用、模式生物等方面进行了详细介绍。
这个项目来自我在美国爱因斯坦医学院作博士后期间一次意外的观察,大概2013年秋天,我在解剖KDM5突变体的果蝇时,发现很多突变体的果蝇肠道出现了大量的气泡,当时我和我的PI主要在研究KDM5的转录调控的机制基础研究。实验室关注点也不在肠道。
但这个表型,引起了我很大兴趣。我怀疑是产气的肠道病原菌过度繁殖引起的。因为KDM5C的突变位点在智力低下和孤独症病人高频出现,并且这些突变位点在果蝇KDM5蛋白中很保守。而孤独症患儿很多出现肠道问题。

南京医科大学校景
因此2015年10月回国后,我加入南京医科大学病原生物系,组建自己的实验室开始独立的科研工作。
结合自己在微生物和遗传学两个学科的学习和研究经历,我决定将孤独症遗传因素,免疫因素以及肠道菌群之间互作交流的机制作为实验室的主要研究方向之一。
而KDM5 是我在美国一直研究的蛋白,联想到它产气的肠道表型,以及KDM5关联的孤独症以及智力残疾患者的突变位点,因此我想从它入手研究肠-微生物-脑轴,可能更容易有所突破。
人们对孤独症的研究主要集中于寻找与孤独症相关的遗传因素与神经发育异常的机制研究。但是近年来的研究发现环境因素及其免疫因素也是引起孤独症发病的重要原因。
因此深入探究孤独症的发病的遗传、环境因素和免疫因素及其相互作用的机理,对孤独症的预防和干预具有重要的科学意义。
我们的研究结果显示这三者存在密切的联系。
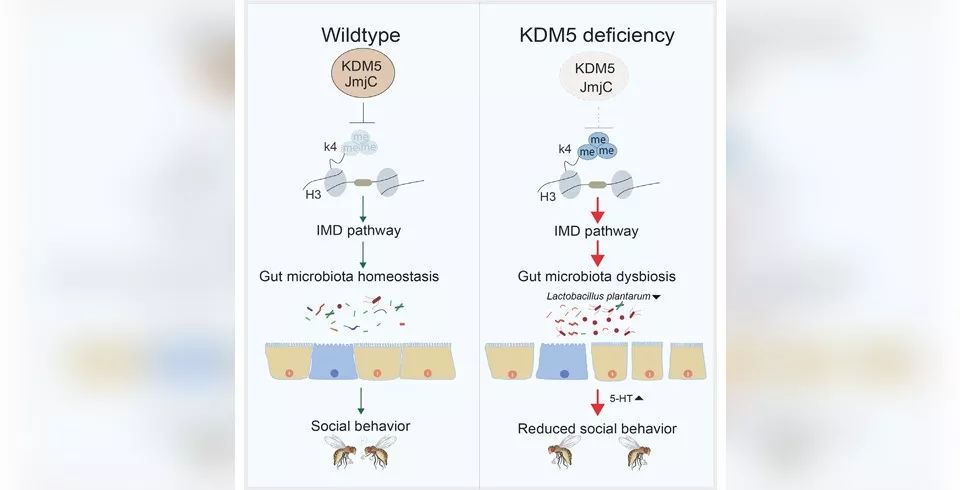
遗传因素调控了固有免疫信号通路相关基因的表达,并进一步导致肠道菌群结构紊乱,肠道微生物的代谢物影响了神经递质5-HT的合成和代谢,从而影响了相关的行为,同时该研究还发现肠道益生菌以及适当的抗生素调整可以改善因遗传因素导致免疫紊乱的情况,并进而改善肠道菌群失调的情况。
这提示即使是遗传因素导致的孤独症以及其他神经发育障碍的疾病可能部分也可以通过改变菌群结构得到改善。
我想这项研究结果将有助于人们从多因素互作的角度认识孤独症的病理机制,为孤独症的发病机理提供新的理论基础,可能也为治疗孤独症疾病的诊疗提供了新的线索吧。
我想主要是提示更加关注肠道的健康,关注饮食。
孤独症孩子除了肠道问题,他们部分还有严重的过敏问题,我们的研究也发现防止固有免疫过度激活也可以部分改善孤独症模式果蝇的社交行为。这些现象以及很多前人的研究都提示这个疾病与免疫功能异常,有很大关系。
因此,调整饮食,改善菌群结构,改善免疫状况对于改善孤独症的行为会有一定的帮助。然而孤独症疾病的发病因素非常复杂,还有很多未知现象需要深入研究。

当前这个疾病在中国发病率越来越高,全球每20分钟就有一个孩子被诊断为孤独症,孤独症已成为危害严重的全球公共健康问题。
另一方面,孤独症给这些患者自己和家人带来长期沉重的生活、经济和精神压力,并日益成为一个社会问题。
当前我们学校的生殖医学国家重点实验室已经联合南京医科大学附属脑科医院儿童心理科成立了孤独症研究中心,成立了多个学科强强联合的研究团队,计划从出生队列,菌群稳态,神经发育,免疫,环境和遗传多个因素角度深入研究孤独症病理机制,希望为孤独症的预防和诊疗提供更多的科学依据。
至于临床方面应用计划,我们正计划通过严格的伦理审查后,将会和临床医生开始临床探索方面的研究。
这个问题很好,黑腹果蝇(Drosophila melanogaster)是生物学研究中最重要,最好的的模式生物之一。主要原因是饲养简单、成本低、生命周期短、繁殖力强。
其肠道的结构其实和哺乳动物很相似。肠道菌群简单,容易得到无菌果蝇,对于研究特定细菌及其代谢物在肠道的功能比较方便和容易。
而且果蝇基因组有超过70% 的人类疾病基因在果蝇中有同源基因,大部分还是单拷贝,这对于揭示遗传对菌群调控,相比小鼠,就更明晰。

更重要的是,我们果蝇科研历史悠久,有很多遗传工具可以应用。这也是很多其他模式生物很难赶超的。
果蝇除了可以建立社交障碍,学习记忆障碍模型外,果蝇还可以建立很多其他疾病模型,如,肿瘤,帕金森病,心血管疾病,相信已有很多科学家在利用果蝇为模型研究肠道菌群与这些疾病的关系。
不足之处:果蝇毕竟不是哺乳动物,肠道微生物复杂性比小鼠低,部分在小鼠和人的肠道能够定殖的细菌,在果蝇的肠道中不易定殖。而且肠道组织小,需要显微操作,比小鼠要麻烦。
在果蝇生物中揭示的部分机制还需要在高等动物验证。它没有适应性免疫系统,不能更全面的揭示菌群与免疫系统的互作的机制。
虽然我实验室也作一部分小鼠的研究,但我个人更爱果蝇。
点评专家:南昌大学食品科学与技术国家重点实验室徐振江教授
孤独症又称自闭症,近年来发病率显著攀升,引起了社会广泛关注。孤独症受环境和遗传多重影响,目前仍缺乏有效的诊断和治疗手段。
孤独症的表现不仅仅是社交障碍和重复刻板行为,在许多病人身上还常常伴随肠道症状(比如便秘、腹胀、腹泻、肠易激综合症等)。
于此相吻合,有不少研究发现,孤独症与肠道微生物群落的失衡密切相关。
刘星吟教授的这项研究以果蝇为模型,从机制上揭示了,宿主自身的基因突变与以肠道微生物为代表的环境因素是如何相互作用,最终在果蝇上引起社交缺陷等类孤独症样的表型。
KDM5 是组蛋白H3K4me3去甲基化酶,可以调控多个信号通路的基因表达,在癌症发生、免疫失调等过程中都有它的身影。而某些孤独症患者身上也携带了KDM5A/KDM5B/KDM5C基因突变。
本文在果蝇的KDM5同源基因上引入类似的Loss of function的突变,导致宿主肠道屏障受损,先天免疫过度激活,5-羟色胺升高,寿命减短,以及社交行为障碍。
而这一切被发现跟肠道微生物群落失衡有关——在突变体宿主体内,Lactobacillus plantarum降低,病原菌过度繁殖。通过饲喂抗生素或者补充Lactobacillus plantarum,可以缓解上述全部症状。
进一步的研究发现,突变的KDM5丢失了去甲基化功能,改变了以IMD/Relish/PGRP-LC为代表的、与先天免疫相关的基因的表达。
这些基因表达的变化改变了肠道免疫环境,导致先天免疫被过度激活,造成了肠道微生物群落的失衡;另一方面,抗生素或Lactobacillus plantarum处理,却能部分恢复免疫基因的正常表达。
这篇文章的研究意味着,在孤独症模型中,肠道微生物群落和宿主免疫系统之间很可能存在一个相互作用的正反馈机制,一方的失调将会导致整个系统的恶化,最终引起以社交障碍为代表的症状。
随着脑肠轴(gut-brain-axis)研究的深入,肠道菌群正在成为成为神经系统的重要调控因子。
刘教授此文中Lactobacillus plantarum调节肠道微生物群落、缓解孤独症表型的作用,并不是孤证。之前加州理工大学Hsiao等人也报道过Bacteroides fragilis 可以在小鼠模型上有类似的效果。
我们可以期望,改善肠道微生物为一种重要的治疗方式,在不久的将来给孤独症患者带来真正的福音。


