
第四章 肠道微生物组研究14个主题方向
4.9 消化道生理
4.9.2 主要认知和研究现状
4.9.2.2 肠道生理环境稳态维持
肠道黏液层对肠道屏障稳态的作用
肠道黏液层不仅是肠道的第一道防线,肠道菌群驻留的主要空间,也是肠道上皮与菌群、菌与菌发生相互作用以调控肠道微环境的重要空间。
肠道黏液层由两类糖基化的黏蛋白组成。不同肠段的黏液层有不同特点,大肠黏液层含内外两层。黏液层被不断消耗和补充,是肠道的第一道免疫防线,其限制了细菌与肠上皮接触,也会为菌群提供营养和黏附位点,黏液层相关菌群与肠腔的不同。黏液层与菌群存在双向互作,一些菌群成员、组分以及炎症因子等能调控黏蛋白的生成和降解。膳食纤维的缺乏和一些食品添加剂可通过菌群削弱黏液层屏障,益生菌、下一代有益菌和微生物产物可用于增强黏液层。[2]
黏液层形成机制、与膳食的关系以及工程化黏液层,是未来研究的主要热点方向。
黏蛋白
肠道黏液层主要黏蛋白MUC2由肽基-GalNAc转移酶进行的第一次糖基化,将N - 乙酰半乳糖胺(GalNAc)残基添加到PTS序列的Ser、Thr上。O- 聚糖链随后延伸和分支,形成GalNAc、半乳糖、N- 乙酰氨基葡萄糖(GlcNAc)、N - 乙酰神经氨酸(NeuAc)和硫酸盐基团。黏蛋白通过糖链间的共价连接形成高度聚集的网状结构。(图4.9.5)

图4.9.5 黏蛋白MUC2 的化学结构与肠道黏液合成[2]
肠道共生菌、病原菌对黏液层和肠屏障的影响
共生微生物群、黏液凝胶双分子层共同保护肠道黏膜,共生菌通过产生短链脂肪酸(SCFA)刺激杯状细胞生成黏蛋白,多样而强大的肠道微生物群对黏液凝胶双分子层起支持作用。其中黏蛋白降解菌嗜黏蛋白阿克曼氏菌可以影响肠细胞的增殖和分化,维持上皮细胞高周转率和分泌细胞系。[3]
病原菌导致宿主系统性影响的途径包括破坏黏膜、黏液屏障结构、功能及完整性,定植上皮细胞,然后进一步内化、劫持上皮细胞通路信号,通过细胞旁、跨细胞路径损毁细胞连接与互作,同时诱导上皮细胞极化失调,引发肠漏并造成共生菌、内毒素等被动通过上皮,引发全身性反应,进而导致过度免疫反应和系统炎症,造成肠道干细胞功能信号受损,阻碍修复、再生过程[3]。(图4.9.6)

图4.9.6 病原菌对肠道黏液层和肠屏障的破坏作用[3]
肠道菌群代谢产物则通过调控上皮细胞紧密连接蛋白、肠道免疫细胞活性,调控肠道屏障功能。未来亟需进一步理解肠道菌群与肠道互作关系如何影响肠屏障功能,并探究多种可调控肠屏障功能的临床技术。
近期代表性研究

宿主和菌群代谢协同调控肠道稳态
宿主肠道生理塑造菌群
除了饮食外,宿主生理因素也是调控肠道菌群组成和功能的一个重要驱动力。
结肠细胞代谢是调控肠道稳态的开关:肠道处于稳态时,结肠细胞代谢趋于氧化磷酸化、脂肪酸氧化,耗氧量高,由此形成的低氧环境利于专性厌氧菌生长,它们可降解纤维生成短链脂肪酸,进而促进宿主健康。但结肠细胞代谢状态改变、肠上皮氧合作用增加,会导致以兼性厌氧菌增殖为特征的菌群失调。(图4.9.7)
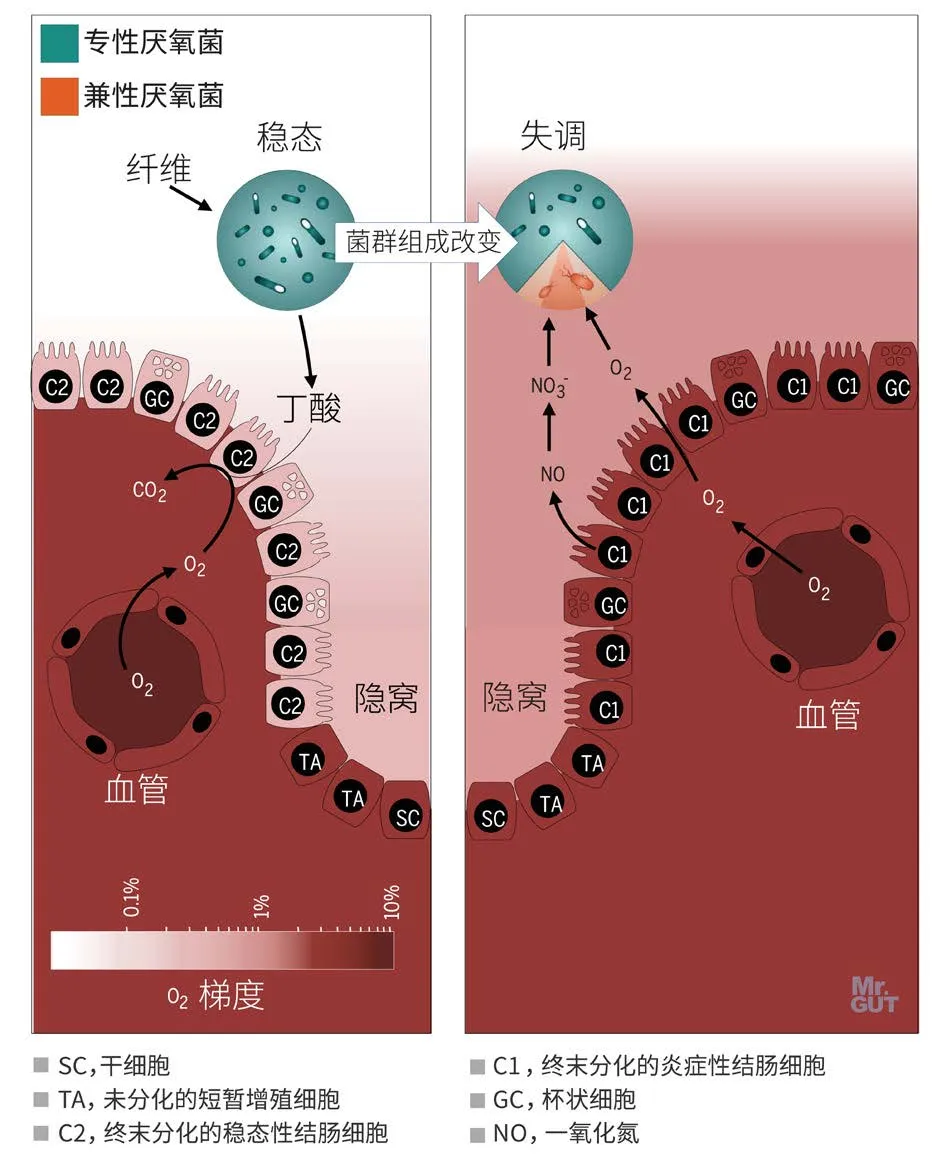
图4.9.7 结肠上皮细胞代谢塑造结肠菌群[4]
宿主通过控制肠腔氧和硝酸盐等电子受体可用性来塑造菌群组成,例如在大肠中,宿主会通过维持肠上皮细胞的生理性缺氧来限制肠腔氧浓度,从而选择专性厌氧菌。在宿主对菌群控制力正常时,尽管不同饮食(如哺乳、成人饮食)塑造的菌群组成有很大差异,但是这些菌群都处于稳态。然而,不健康饮食、抗生素和肠道疾病等因素会削弱宿主对菌群的控制力,使肠腔氧含量增加,驱动菌群失调和有害代谢物生成。(图4.9.8)
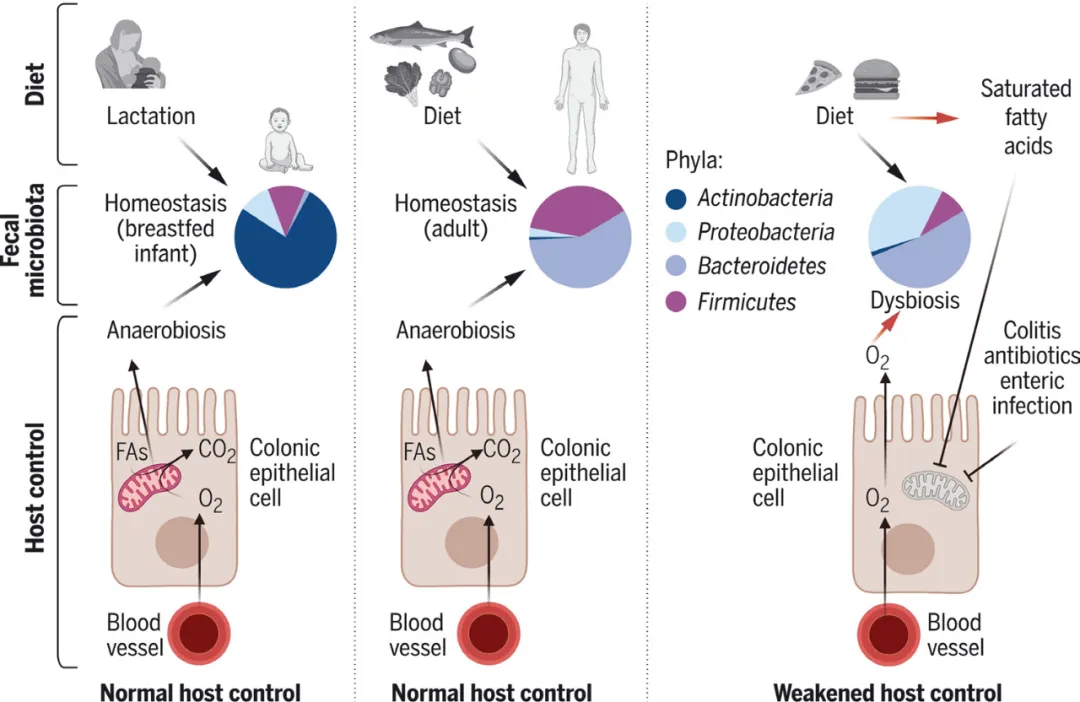
图4.9.8 菌群失调与宿主对微生物生长控制能力减弱有关[5]
量化控制菌群生长的宿主参数,如肠腔氧浓度,可帮助定义菌群的稳态和失调。靶向宿主肠道生理能有效改善肠道菌群,是恢复宿主对菌群的控制、改善菌群失调的新策略。[5]
肠道气体
肠道气体是肠道菌群代谢产物之一,对于肠道环境和菌群有重要的影响,是肠道代谢稳态研究的新方向,肠道气体的组成、分布成为疾病诊断的重要标志物,利用饮食改善气体分布也被认为是胃肠疾病的潜在治疗方向[6]。
CO2是在胃产生,H2、CH4、CO2、含硫化合物则是在小肠和结肠产生,N2来自于吞咽的空气。不被吸收的气体沿着肠道从一段向前推进到下一段。沿着肠道产生的气体要么通过黏膜吸收进入血液循环,要么通过微生物活动转变为化学成分,要么通过胃黏膜释放。氧分压(PO2)沿肠道呈阶梯式减少变化,在结肠时,PO2 处于极低状态。这可能是由于随着肠道变得越来越无氧,肠道微生物数量逐渐增加,PO2 则逐步减少。(图4.9.9)

图4.9.9 沿胃肠道的肠内气体的生理学[6]
肠细胞感知微生物环境信号
肠道菌群通过产生或转化一系列代谢物和分子来影响宿主代谢健康,包括SCFA、胆汁酸、内源性大麻素、TMAO、LPS、多肽等。这些分子可作用于多种宿主细胞受体和通路,如TLR、PPARα/γ、AhR、G蛋白偶联受体(GPR41/43/119 和TGR5)、内源性大麻素受体等,调控宿主信号通路,影响肠腔环境、肠屏障和肠道激素分泌等生理功能。(图4.9.10)

图4.9.10 结肠细胞、肠内分泌细胞表达多种受体,感知并传递来自肠道微生物组的分子信号[7]
近期代表性研究

聚焦:宿主与菌群互作调控肠道稳态
宿主肠道不同细胞与菌群互作、肠道中细菌与真菌、病毒、寄生虫互作均会影响肠道生理稳态,探究不同宿主、不同细胞与菌群,不同类型肠道微生物间的互作对肠道稳态的影响是目前的热点领域之一。
近期代表性研究

4.9.2.3 肠干细胞与肠道微生物组
肠道微生物组、肠干细胞(ISCs)的相互作用对维持肠道稳态和促进疾病恢复起着关键作用,但相关研究尚不充分。ISCs及与肠道微生物组的关系为缓解炎症性肠病等肠道疾病提供了可行的途径。
肠道微生物组可影响黏膜免疫系统并调节肠干细胞,由肠道微生物群调控的模式识别受体,尤其是TLRs、NLRs,能够调节下游的微环境。肠道微生物可通过这些途径参与调控肠道稳态、肠道损伤修复和ISCs状态。(图4.9.11)

图4.9.11 肠道微生物可影响肠干细胞[8]
短链脂肪酸、色氨酸代谢物、肽聚糖、脂多糖等来自肠道微生物的代谢产物和衍生物,可通过作用于特定受体、调节Wnt信号、调控表观遗传等多种机制,影响ISCs的干性、增殖和分化,进而影响肠道健康(图4.9.12)。

图4.9.12 肠道微生物组代谢物和衍生物通过塑造肠干细胞调节肠道健康[8]
4.9.2.4 其他肠道生理因素
肠道转运时间与肠道微生物组及代谢的关系
肠道转运时间影响结肠底物的利用,从而影响糖分解的、蛋白水解发酵等肠道生理过程,肠道菌群对肠道转运时间有重要影响,但目前受关注较少。深入探究肠道转运时间与肠道菌群的关系,可以更准确地阐明饮食- 微生物群相互作用以及疾病相关的微生物群特征。
胃排空时间(GET)、小肠运输时间(SITT)、结肠运输时间(CTT)占整个肠道运输时间的大部分,且个体间差异较大。较长的肠道运输时间与较高的粪便pH值、较低的粪便含水量,较高的微生物细胞密度、多样性,以及微生物代谢从糖水解向蛋白质水解的转变有关,这反映了短链脂肪酸水平的降低、支链脂肪酸(BCFA)水平的增加。很可能一旦容易获得的碳水化合物来源在结肠变得稀缺,肠道微生物就会转向发酵膳食和黏液来源的蛋白质。虽然肠道菌群的糖水解会产生对宿主有益的短链脂肪酸,并为结肠细胞提供能量来源,但蛋白质水解可导致BCFA、酚类、吲哚、铵(NH3)、硫化氢(H2S)等化合物的积累,这些化合物通常被认为对健康有害。氢气(H2)与二氧化碳(CO2)或甲酸盐可以被产甲烷的古细菌转化为甲烷(CH4),这也与较长的传输时间有关。此外,次级胆汁酸的产生、循环以及通过胆汁排泄的宿主来源的葡萄糖醛酸酯的水解,也会受到肠道转运时间改变的影响。微生物衍生的三甲胺(TMA)主要由胆碱和肉碱产生,其是否与转运时间有关尚不清楚。(图4.9.13)
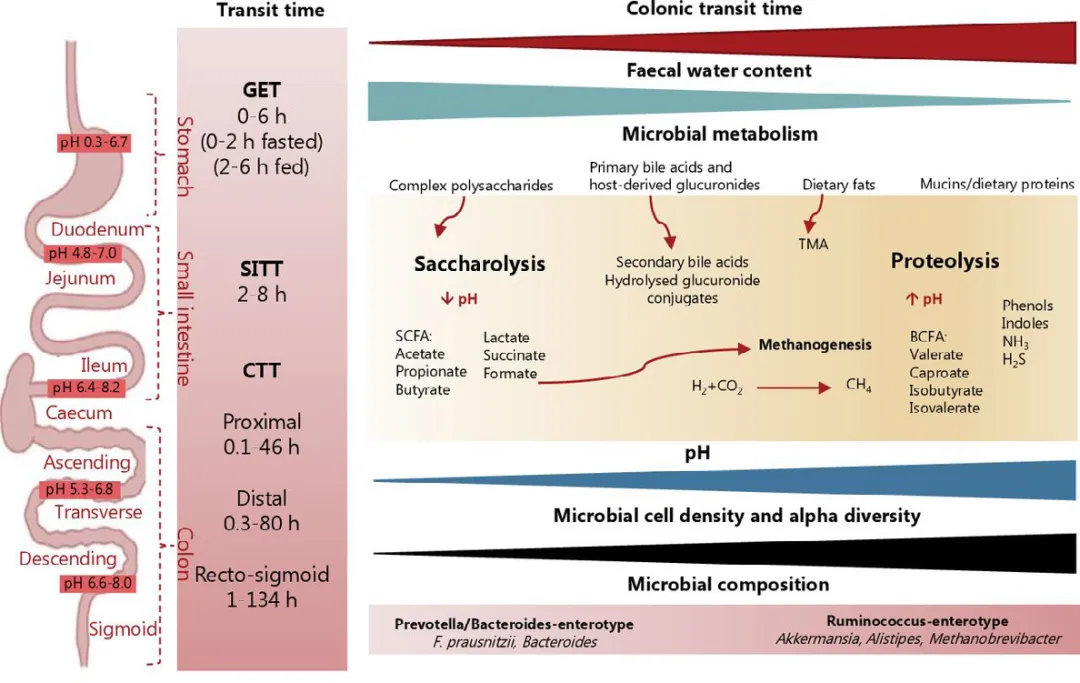
图4.9.13 胃肠道转运时间、pH 值及与肠道环境和肠道微生物代谢的关系[9]
调控肠道生理的其他因素还包括节律、其他相关细胞生理,包括自噬、线粒体等,3D 体外培养被公认为肠道生理研究的重要技术手段。
近期代表性研究

参考文献
2.Paone, P. and P.D. Cani, Mucus barrier, mucins and gut microbiota: the expected slimy partners? Gut, 2020. 69(12): p. 2232-2243.
3.Rogers, A.P., S.J. Mileto, and D. Lyras, Impact of enteric bacterial infections at and beyond the epithelial barrier. Nat Rev Microbiol, 2023. 21(4): p. 260-274.
4.Litvak, Y., M.X. Byndloss, and A.J. Bäumler, Colonocyte metabolism shapes the gut microbiota. Science, 2018. 362(6418).
5.Lee, J.Y., R.M. Tsolis, and A.J. Bäumler, The microbiome and gut homeostasis.Science, 2022. 377(6601): p. eabp9960.
6.Kalantar-Zadeh, K., et al., Intestinal gases: influence on gut disorders and the role of dietary manipulations. Nat Rev Gastroenterol Hepatol, 2019. 16(12): p. 733-747.
7.de Vos, W.M., et al., Gut microbiome and health: mechanistic insights. Gut, 2022.71(5): p. 1020-1032.
8.Ma , N., et al., Gut microbiota-stem cell niche crosstalk: A new territory formaintaining intestinal homeostasis. iMeta, 2022. 1(4): p. e54.
9.Procházková, N., et al., Advancing human gut microbiota research by considering gut transit time. Gut, 2023. 72(1): p. 180-191.



