
第四章 肠道微生物组研究14个主题方向
4.14 同一健康
“同一健康(One Health)”是一个多学科合作的研究和实践框架,致力于通过协调人类、动物和环境健康来应对全球健康挑战。作为新兴的跨学科研究领域,同一健康主要关注抗生素耐药性、新发传染病防控(以虫媒疾病等人畜共患病为主)、环境健康和食品安全等问题。肠道微生物组领域里,“同一健康”主题的研究主要涉及抗生素耐药性、虫媒疾病传播的分子机制及防控方法、污染物(例如微塑料)对肠道菌群和宿主健康的影响等。本文主要围绕这些话题简要介绍相关研究进展。
4.14.1 高影响力研究者
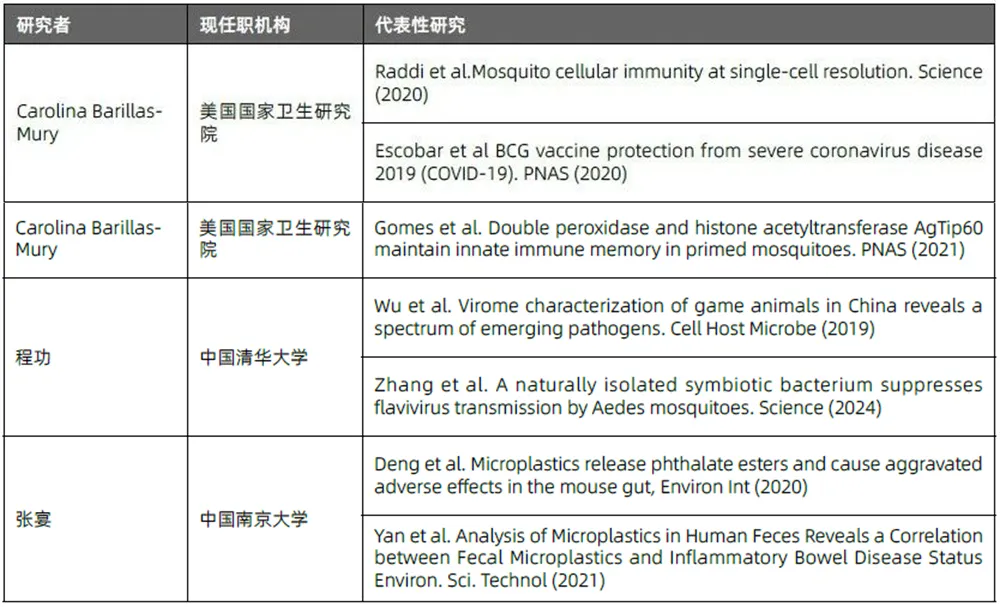
肠道微生物组领域中 “同一健康”主题的高影响力研究论文的作者姓名词云、核心研究团队(以通讯作者为准)及代表性研究,详见图4.14.1、表4.14.1。

图4.14.1 “同一健康”主题的作者姓名词云
表4.14.1 “同一健康”主题的代表性研究者
4.14.2 主要认知和研究现状

图4.14.2 “同一健康”主题高影响力研究论文的关键词词云
4.14.2.1 抗生素耐药性的传播
抗生素的广泛使用导致环境中抗生素抗性基因(ARGs)和抗生素耐药细菌增加。医院、畜牧业和污水处理厂是抗生素抗性研究的热点环境,如何对这些环境中的抗生素抗性基因进行检测、表征和防治,需要进一步研究。抗生素抗性基因、抗生素耐药细菌可以通过多种途径在环境中传播,包括表面水体、空气、动物和人类等。ARGs 在野生动物的出现也需要引起人们的关注,这也会对环境和公共卫生构成威胁。
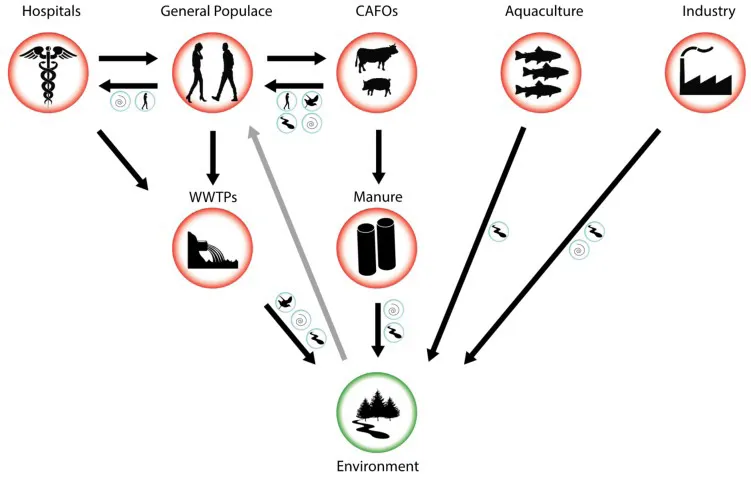
图4.14.3 抗生素耐药菌、抗生素耐药基因从进化、传播热点转移到环境的示意图[1]
红圈:传播热点;绿圈:环境;蓝圈:可能促进在特定环境间传播的媒介,包括空气、地表水、人类和其他动物媒介;黑箭头:已知抗生素耐药菌、抗生素耐药基因流动方向;灰箭头:从污染环境到人群的可能传播途径。
抗生素的滥用或过度使用被认为是导致细菌获得耐药性的主要因素,但研究表明现代社会生活方式相关因素,如长途旅行[2]、食品添加剂(非营养型甜味剂等[3])、垃圾填埋[4]等也能加速ARGs的传播。
细菌产生抗生素耐药性主要有两个途径,一个是自身发生基因突变,另一个是获得其他耐药菌的抗生素耐药质粒能。在抗生素下存活的持留菌是产生抗生素耐药基因突变的主力选手,也是促进耐药质粒传播的“种子”。这说明消灭残存在不同组织的持留菌,是减少抗生素耐药质粒传播的重要策略[5]。
抗生素耐药性的一个主要机制是药物的主动外排,它与外膜的低渗屏障和耐药性突变协同作用。目前克服抗生素耐药机制的策略有两种,分别是促进抗生素穿过细菌外膜、防止细菌外排药物[6]。当前亟需针对这两种机制研发新型抗生素。
聚焦:肠道微生物组抗生素耐药性
抗生素滥用可对肠道微生物组产生巨大影响[7],改变肠道微生物组的多样性和功能,从而可能对宿主健康和疾病风险产生影响。ARGs可通过水平基因转移在肠道微生物中扩散和重组。研究显示,正常人的肠道菌群广泛存在ARGs,但仅有8.9% 的基因组包含高风险ARGs[8]。肠道微生物组的ARGs组成特点及其对生长发育和长期健康的影响,仍需要进一步研究。
近期代表性研究

参考文献
2.D'Souza, A.W., et al., Destination shapes antibiotic resistance gene acquisitions,abundance increases, and diversity changes in Dutch travelers. Genome Med, 2021.13(1): p. 79.
3.Yu, Z., et al., Nonnutritive sweeteners can promote the dissemination of antibiotic resistance through conjugative gene transfer. ISME J, 2021. 15(7): p. 2117-2130.
4.Liu, X., et al., Metagenomic analysis of antibiotic resistance genes (ARGs) during refuse decomposition. Sci Total Environ, 2018. 634: p. 1231-1237.
5.Bakkeren, E., et al., Salmonella persisters promote the spread of antibiotic resistance plasmids in the gut. Nature, 2019. 573(7773): p. 276-280.
6.Zgurskaya, H.I., et al., Multidrug Efflux Pumps and the Two-Faced Janus of Substrates and Inhibitors. Acc Chem Res, 2021. 54(4): p. 930-939.
7.Reyman, M., et al., Effects of early-life antibiotics on the developing infant gut microbiome and resistome: a randomized trial. Nat Commun, 2022. 13(1): p. 893.
8.Zhang, A.N., et al., An omics-based framework for assessing the health risk of antimicrobial resistance genes. Nat Commun, 2021. 12(1): p. 4765.



