
第四章 肠道微生物组研究14个主题方向
4.10 消化系统疾病
“消化系统疾病”主题主要关注肠道微生物组与消化系统疾病的相关研究,主要涉及结直肠癌、炎症性肠病、肠易激综合征、肝病、肠道感染等。我们将基于近期的高影响力综述和研究,简要概述该主题目前的主要认知、研究焦点和未来研究方向。(结直肠癌相关内容详见4.8)
4.10.1 高影响力研究者
“消化系统疾病”主题的高影响力研究论文的作者姓名词云和核心研究团队(以通讯作者为准)及代表性研究,分别详见图4.10.1、表4.10.1。

图4.10.1 “消化系统疾病”主题的作者姓名词云
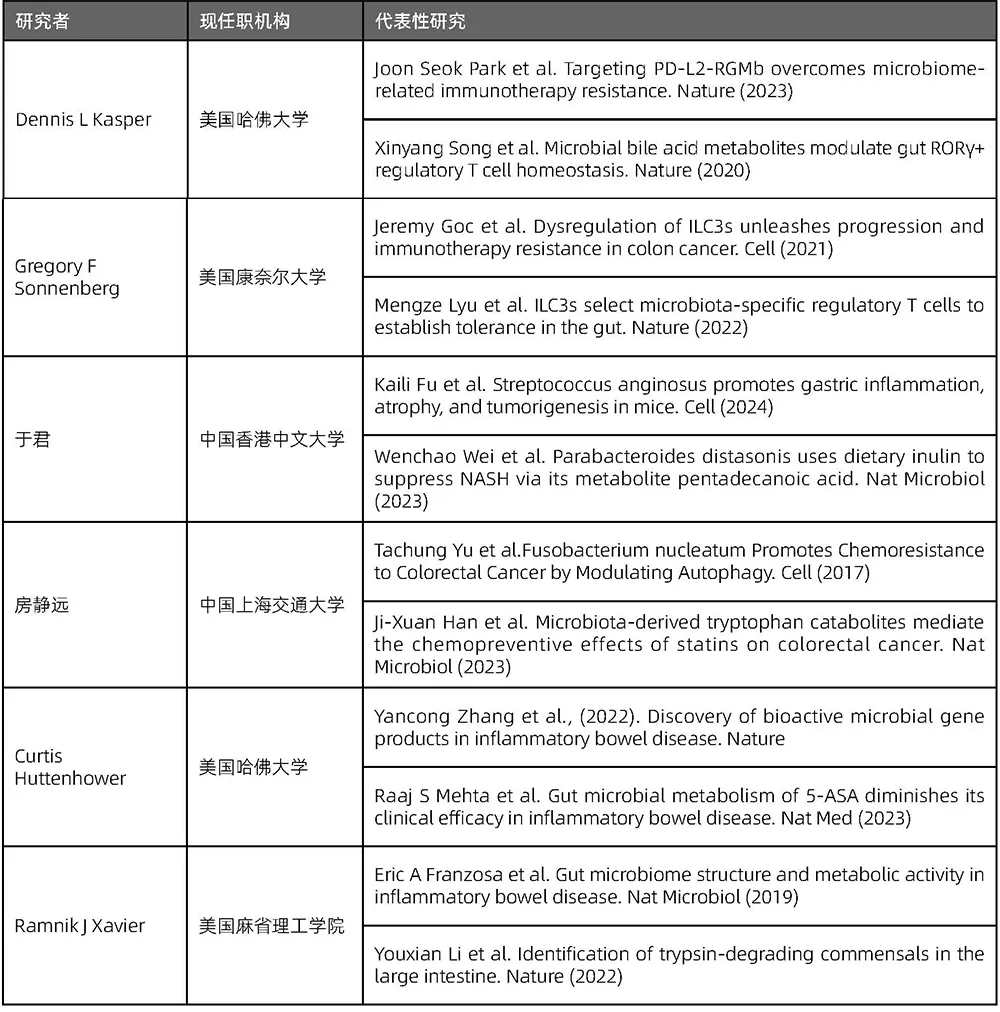
表4.10.1 “消化系统疾病”主题的代表性研究者
4.10.2 主要认知和研究现状
“消化系统疾病”主题高影响力研究论文的关键词词云如图4.10.2所示。通过Citespace文本挖掘,该主题的常见名词(term)包括炎症性肠病(inflammatory bowel disease)、结直肠癌(colorectal cancer)、溃疡性结肠炎(ulcerative colitis)、克罗恩病(crohns disease)、肠道炎症(intestinal inflammation)、非酒精性脂肪性肝病(non-alcoholic fatty liver disease)、粪菌移植(fecal microbiota transplantation)、短链脂肪酸(short-chain fatty acids)、具核梭杆菌(Fusobacterium nucleatum)、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、胆汁酸(bile acids)、肠易激综合征(irritable bowel syndrome)、肠屏障功能(gut barrier function)等。

图4.10.2 “消化系统疾病”主题高影响力研究论文的关键词词云
4.10.2.1 炎症性肠病
近年来,关于肠道微生物组与炎症性肠病(IBD)的研究取得了显著进展,强调了微生物组、肠屏障和肠道免疫反应的相互作用在IBD发生发展中的机制。
稳态情况下,肠道黏膜屏障将共生菌群与肠道上皮分隔,黏膜处的免疫细胞抑制共生菌群的积累及易位,而一些IBD相关基因突变可导致黏膜屏障或免疫应答受损,引起肠道菌群及免疫平衡的失调。共生菌群可帮助宿主维持肠道免疫平衡,例如分节丝状菌(SFB)通过促进辅助性T细胞17(Th17)分化、3型固有淋巴细胞(ILC3)活化等增强黏膜免疫应答。共生菌群还在调节性T细胞(Treg)诱导上发挥重要作用,促进肠道免疫稳态。IBD发病常伴有致病菌的积累与易位,进展过程中炎症驱动菌群组成进一步改变,伴随菌群多样性降低、有益菌减少、致病菌扩增,菌群代谢产物改变,菌群失调进一步加剧肠道炎症。靶向肠道微生物组的疗法对治疗IBD具有潜力,例如粪菌移植可诱导部分患者的疾病缓解。[1, 2]
图4.10.3列举了肠道共生菌在维持肠道稳态、增强宿主免疫防御中的多种机制。其中, SFB附着在肠上皮细胞,触发血清淀粉样蛋白A(SAA)的释放,激活Th17细胞、ILC3释放IL17和IL22等细胞因子,从而促进肠上皮分泌抗菌肽(AMPs)并招募中性粒细胞,以增强黏膜免疫应答。共生菌还通过Toll样受体(TLR)通路促进IgA的分泌,增强肠道屏障功能。嗜黏蛋白阿克曼菌等共生菌可诱导特异性IgG反应,抑制病原菌入侵上皮屏障。
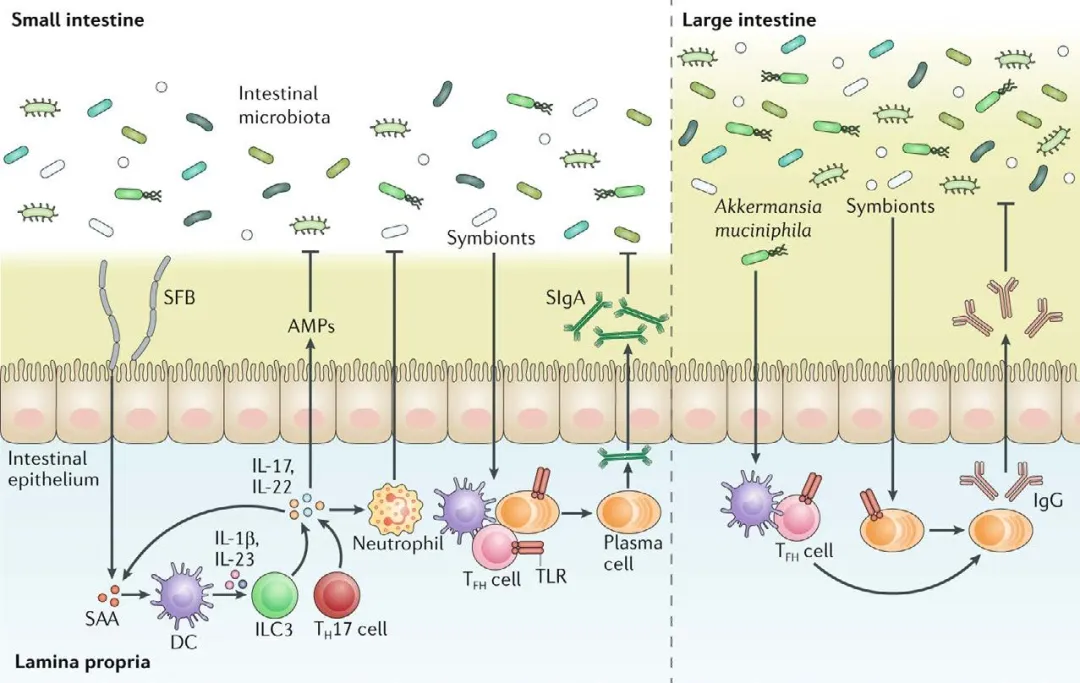
图4.10.3 肠道共生菌的有益作用[1]
此外,共生菌还可通过抗原依赖、抗原非依赖过程促进Treg细胞的分化,而短链脂肪酸(SCFAs)可通过直接(表观遗传修饰)或间接(增强树突状细胞生成维甲酸)机制促进Treg细胞扩增。
IBD相关微生物组失调主要表现为多样性降低以及某些细菌、真菌等微生物的丰度改变,图4.10.4展示了IBD相关菌群失调的早期、晚期阶段及各自特征。早期菌群失调常表现为遗传、环境因素导致致病共生菌积累并穿过肠屏障移位,可能在临床疾病发生前出现。随后肠道炎症环境中氧气和硝酸盐含量的增加,促进驱动菌群组成进一步变化,肠杆菌科细菌等致病共生菌过度生长并移位,而有益共生菌减少,伴随菌群代谢物的变化,如SCFA、胆汁酸和色氨酸代谢物等,反过来加剧了慢性炎症。
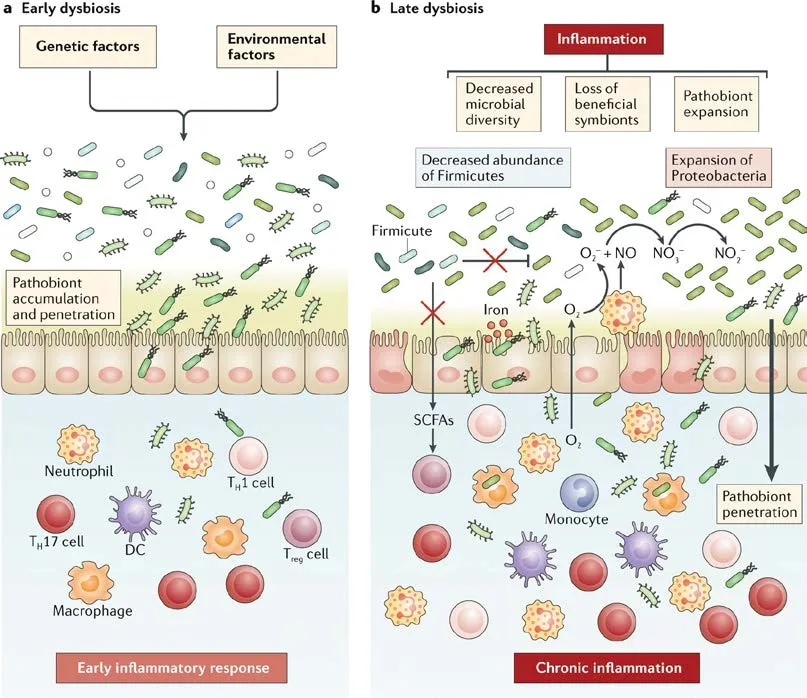
图4.10.4 炎症性肠病相关菌群失调[1]
粪菌移植(FMT)、抗生素、益生菌、益生元、药物、工程菌、饮食等靶向肠道微生物组的干预方法,可通过直接或间接的机制,调节肠道屏障功能和炎症反应,为IBD治疗提供新手段(图4.10.5)。
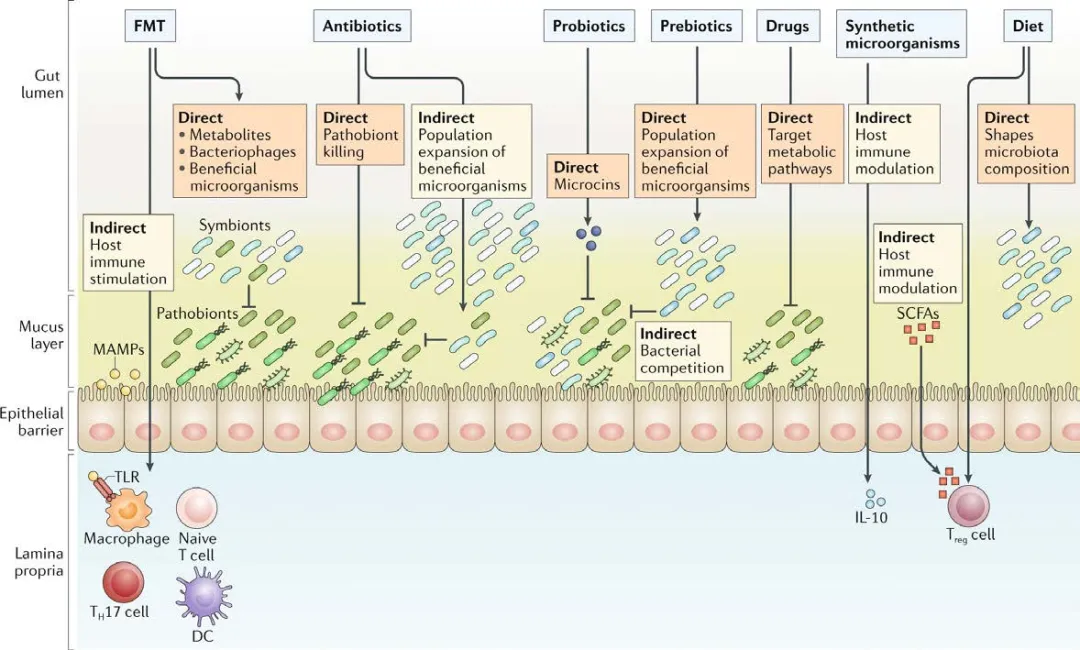
图 4.10.5 基于微生物组治疗炎症性肠病[1]
近期代表性研究

参考文献
1.Caruso, R., B.C. Lo, and G. Núñez, Host-microbiota interactions in inflammatorybowel disease. Nat Rev Immunol, 2020. 20(7): p. 411-426.
2.Lavelle, A. and H. Sokol, Gut microbiota-derived metabolites as key actors ininflammatory bowel disease. Nat Rev Gastroenterol Hepatol, 2020. 17(4): p. 223-237.



