
第四章 肠道微生物组研究14个主题方向
4.10 消化系统疾病
4.10.2 主要认知和研究现状
4.10.2.2 肠易激综合征
肠易激综合征(IBS)是最常见的肠脑互作疾病(DGBI)之一,导致IBS患者关键症状、腹痛和排便习惯改变的病理生理机制尚不完全清楚,这阻碍了有效治疗方案的研发。
动物研究表明,肠道微生物组的变化会导致与IBS相关的宿主功能改变,涉及肠道蠕动、内脏疼痛反应、肠道通透性以及大脑功能和行为等。IBS患者的肠道微生物组稳定性降低,部分患者的微生物组成发生改变,例如肠杆菌科、乳杆菌科和拟杆菌属增加,而不可培养的梭菌目I、粪杆菌属(包括普氏粪杆菌)和双歧杆菌属减少,相关影响因素包括饮食、压力、感染、抗生素使用、免疫激活和低度炎症等(图4.10.6)。IBS患者的肠道菌群可在小鼠中诱导产生类似IBS的肠道功能紊乱,表明菌群参与促进IBS症状。肠道菌群可能通过产生与宿主互作的特定代谢物(如SCFAs、色氨酸代谢物和神经递质GABA),影响肠屏障、免疫活化、神经反应等机制,进而影响肠道和大脑功能。包括菌群在内的肠道微环境与神经免疫的相互作用,在IBS和其他 DGBI中扮演关键角色。益生菌、益生元、饮食干预、抗生素治疗、粪菌移植等微生物组相关疗法治疗IBS颇具前景,但仍需深入研究。[3-6]

图4.10.6 导致炎症性肠病菌群失调的因素[3]

图4.10.7 炎症性肠病的肠道微环境和神经免疫互作[4]
近期代表性研究

4.10.2.3 肝病
肝脏和肠道通过胆管(胆汁分泌)、门静脉、体循环完成双向交流。肝脏产物可影响肠道微生物组组成和屏障完整性,肠道因子可调控肝脏的胆汁酸合成和糖脂代谢,从而影响肝脏健康。非酒精性脂肪性肝病(NAFLD)、酒精性肝病(ALD)、肝硬化、肝癌等肝脏疾病均存在肠道菌群失调、肠屏障功能障碍及肠道微生物移位。乙醇、胆汁酸、SCFAs、脂多糖(LPS)、氧化三甲胺(TMAO)及微生物源肝毒素等代谢物具有调节免疫和代谢的功能,参与肝病的发生发展。通过粪菌移植、噬菌体、益生菌、益生元、工程菌、后生元等微生物组干预方法恢复肠-肝平衡,是治疗肝病的新策略。[7, 8]

图4.10.10 靶向微生物组的肝病治疗方法[7]
研究发现不同病因所致肝病的肠道微生物组变化各异,其中NAFLD、ALD 常表现为肠道细菌、真菌、病毒和代谢物组成的不同变化(图4.10.8)。肝病进展为肝硬化、肝癌或与肠道微生物组及代谢物的进一步变化有关。
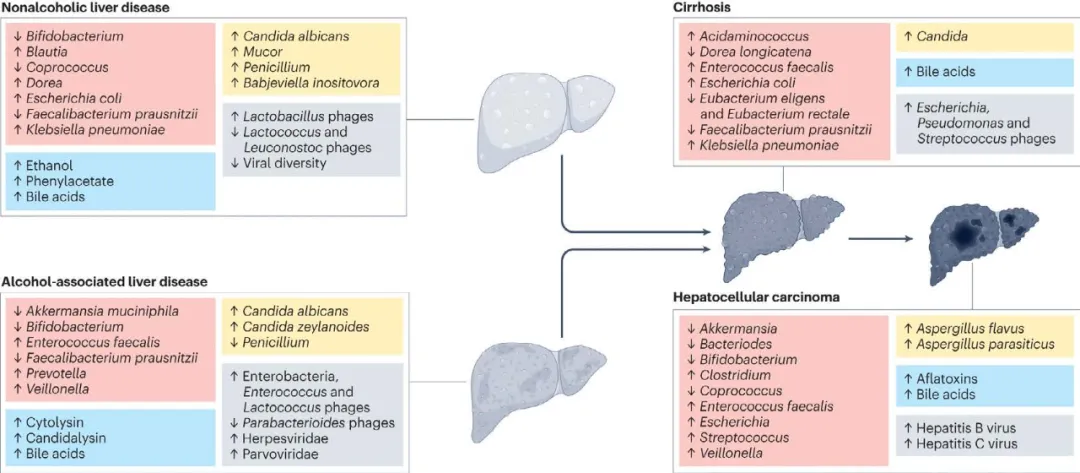
图4.10.8 不同病因所致肝病的肠道微生物组特征[7]
图4.10.9 总结了ALD和NAFLD相关肝脏- 肠道微生物组相互作用。ALD和NAFLD可见肠道细菌过度生长导致刺激胆汁酸增多,通过法尼醇X 受体(FXR)信号增加肝脏的胆汁酸合成,肝脏磷脂酰胆碱减少导致甘油三酯积累。ALD相关菌群失调表现为乳杆菌属减少、念珠菌属过度生长,而NAFLD患者可见乳杆菌属丰度较高。ALD和NAFLD均可见肠腔乙醇及代谢产物乙醛增多,削弱了肠上皮屏障功能,导致微生物相关分子模式(MAMPs)和肠道代谢物(如乙醛、乙酸和三甲胺)移位,引起肠道和肝脏炎症反应,加剧肝脏损伤。

图4.10.9 酒精性肝病和非酒精性脂肪性肝病相关肝脏- 肠道菌群互作[8]
近期代表性研究

4.10.2.4 艰难梭菌感染
艰难梭菌感染是抗生素使用造成的肠道感染、腹泻的主要原因,与肠道菌群失调密切相关。近年研究者在艰难梭菌感染的生理学特征方面取得了长足进步,尤其揭示了肠道微生物组及宿主如何共同提供定植抵抗的机制。
研究表明,艰难梭菌进化出多种独特的生存机制可促进肠道定植,包括产生孢子、分泌毒素、适应不同肠道环境及与其他肠道微生物互作等。肠道微生物之间、微生物与宿主之间的相互作用,如通过抗菌肽、噬菌体、胆汁酸代谢、SCFAs、营养竞争以及营养免疫等机制,共同抑制艰难梭菌在肠道定植。FMT是预防和治疗复发性艰难梭菌感染(rCDI)的有效疗法,可通过恢复微生物组稳态、促进胆汁酸和SCFAs生成、免疫调控以及表观遗传等机制发挥作用。近期,商业化的菌群衍生药品也获批用于预防rCDI。未来应针对艰难梭菌与肠道环境的相互作用,开发基于精准医学治疗的艰难梭菌感染的新方案。[9-11]
近期代表性研究

参考文献
3.Collins, S.M., A role for the gut microbiota in IBS. Nat Rev Gastroenterol Hepatol,014. 11(8): p. 497-505.
4.Simrén, M., Targeting the gut microenvironment in IBS to improve symptoms. Nat Rev Gastroenterol Hepatol, 2023. 20(2): p. 69-70.
5.Pittayanon, R., et al., Gut Microbiota in Patients With Irritable Bowel Syndrome-A Systematic Review. Gastroenterology, 2019. 157(1): p. 97-108.
6.Mars, R.A.T., M. Frith, and P.C. Kashyap, Functional Gastrointestinal Disorders and the Microbiome-What Is the Best Strategy for Moving Microbiome-based Therapies for Functional Gastrointestinal Disorders into the Clinic? Gastroenterology, 2021.160(2): p. 538-555.
7.Hsu, C.L. and B. Schnabl, The gut-liver axis and gut microbiota in health and liver disease. Nat Rev Microbiol, 2023. 21(11): p. 719-733.
8.Tripathi, A., et al., The gut-liver axis and the intersection with the microbiome. Nat Rev Gastroenterol Hepatol, 2018. 15(7): p. 397-411.
9.Schnizlein, M.K. and V.B. Young, Capturing the environment of the Clostridioidesdifficile infection cycle. Nat Rev Gastroenterol Hepatol, 2022. 19(8): p. 508-520.
10.Yadegar, A., et al., Beneficial effects of fecal microbiota transplantation inrecurrent Clostridioides difficile infection. Cell Host Microbe, 2023. 31(5): p. 695-711.
11.Benech, N., et al., Update on microbiota-derived therapies for recurrent Clostridioides difficile infections. Clin Microbiol Infect, 2024. 30(4): p. 462-468.



