
第四章 肠道微生物组研究14个主题方向
4.6 代谢
4.6.2 主要认知和研究现状
4.6.2.2 肠道微生物代谢产物
短链脂肪酸(SCFAs)肠道菌群代谢产物作为宿主与微生物互作的媒介,影响人类生理、病理。尤其是短链脂肪酸、次级胆汁酸、色氨酸代谢物三类微生物代谢产物,已有大量研究揭示它们在调节宿主健康中的作用。
SCFAs是微生物发酵膳食纤维的主要产物,乙酸、丙酸、丁酸是主要的SCFAs,由特定肠道微生物酶介导产生(图4.6.6)。SCFAs在盲肠和近端结肠浓度最高,随着在肠道被吸收和利用,SCFAs浓度在向远端结肠和直肠的方向逐渐降低。[2]

图4.6.6 肠道微生物的SCFAs生物合成途径[2]
SCFAs调节许多生理和生化功能,包括维持肠道屏障功能、肠道运动、肠激素分泌、染色质、肠- 脑轴和免疫功能,对动脉粥样硬化、肥胖、代谢综合征和2型糖尿等心血管代谢疾病,帕金森病、阿尔茨海默病、自闭症谱系障碍、焦虑和抑郁等神经精神疾病,以及肿瘤和哮喘等疾病都有潜在影响[3]。
SCFAs是结肠细胞的能量来源,能通过激活G蛋白偶联受体( 如GPR41、GPR43) 促进GLP-1和PYY分泌,调节能量代谢、食欲和胰岛素敏感性,有助于控制体重和改善葡萄糖代谢。SCFAs还可通过抑制脂肪细胞的脂解作用(尤其是乙酸),改善脂肪组织的代谢功能,从而增加胰岛素敏感性。同时SCFAs能直接改善骨骼肌的功能,通过增加脂质氧化能力,减少肌内脂质积累,防止胰岛素抵抗。此外,丙酸、丁酸可以增强胰岛β细胞的功能,提高胰岛素分泌。[4]
SCFAs还具有显著的抗炎作用,通过抑制组蛋白脱乙酰酶(HDACs),减少炎症因子的表达,促进调节性T细胞(Tregs)生成,维持肠道免疫稳态。丁酸通过抗炎和抗增殖特性可能发挥抑制结肠癌发生发展的作用。此外,乙酸可以穿过血脑屏障,调节下丘脑的食欲控制机制,并通过肠- 脑轴对神经信号传导产生影响。总体上,SCFAs可通过多种机制促进宿主健康。[2]
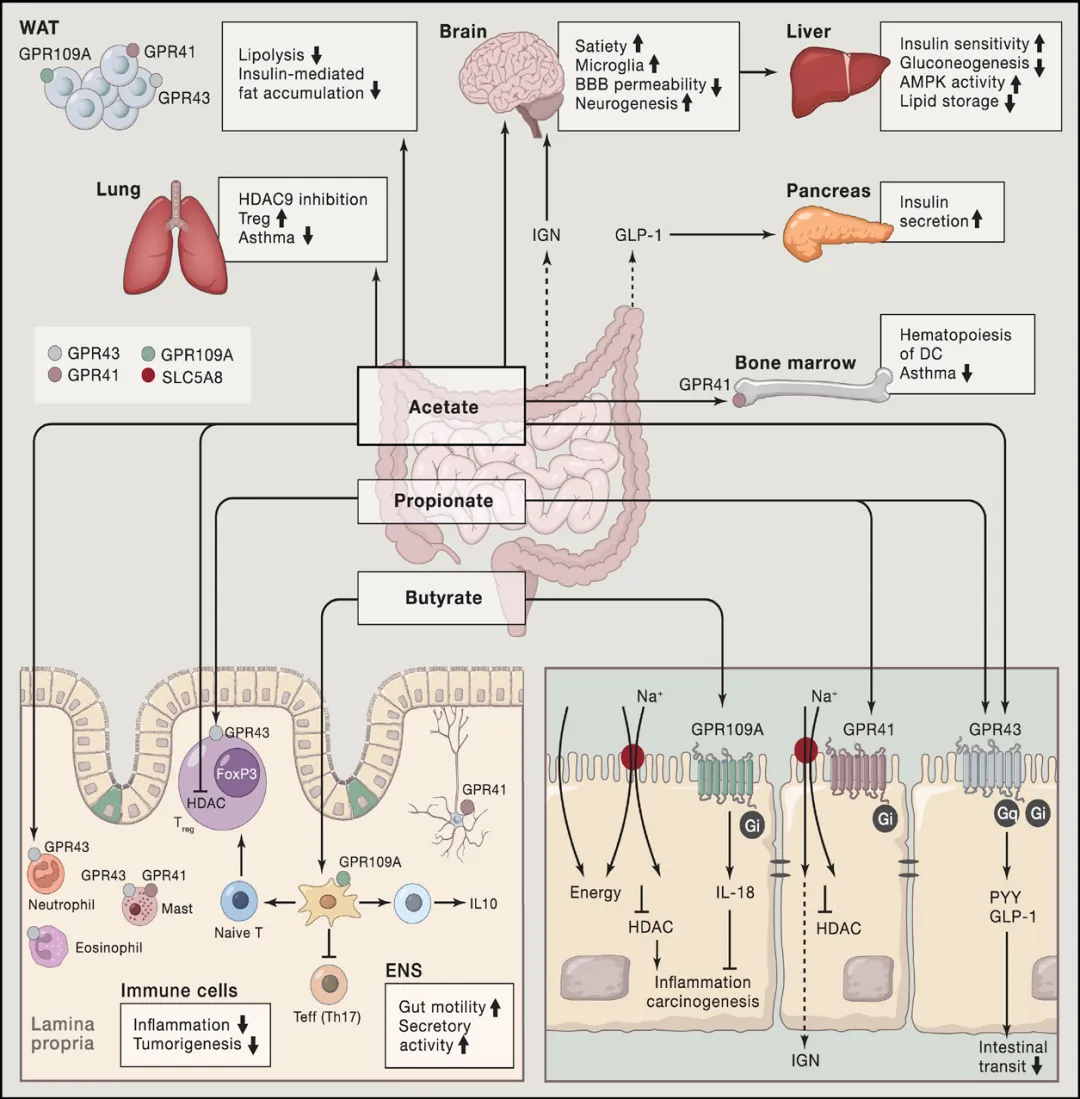
图4.6.7 短链脂肪酸的作用机制[2]
近期代表性研究

胆汁酸
在肠道微生物代谢物中,胆汁酸具有非常重要的生理功能,既在小肠内促进脂质的吸收或排泄,又能够作用于多个器官影响个体的代谢、免疫等功能[5]。
胆汁酸分为初级胆汁酸、次级胆汁酸。初级胆汁酸由肝细胞合成,如胆酸(CA)和鹅脱氧胆酸(CDCA),这些胆汁酸与甘氨酸或牛磺酸结合后储存在胆囊。进餐时,胆汁酸被释放到十二指肠,延着肠道被微生物代谢生成次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。约95%的胆汁酸在到达回肠末端之前通过被动和主动运输被重吸收,并通过肝肠循环再利用。图4.6.8展示了人类胆汁酸在肝肠循环的合成、转化和循环过程。[5]

图4.6.8 人类胆汁酸的肠肝循环[5]
抗生素使用等因素引起的菌群失调、体育运动对胃肠蠕动的影响、饮食中胆固醇和纤维等因素,都会直接或间接影响菌群对胆汁酸的代谢和转化,胆汁酸反过来也可影响肠道菌群的组成、丰度和代谢活性[5]。
胆汁酸通过与肠道微生物的相互作用,对多种疾病产生影响。例如,初级胆汁酸促进艰难梭菌孢子萌发,次级胆汁酸能抑制艰难梭菌及其毒性,且次级胆汁酸通过多种机制与致癌作用相关。细菌转化胆汁酸过程中释放的牛磺酸可进一步代谢为致癌的硫化氢(H2S)。
次级胆汁酸插入细胞膜,不仅可激活磷脂酶A2(PLA2)促进生成损伤DNA 的活性氧(ROS), 还可通过核因子κB(NF-κB)介导的促炎细胞因子表达,抑制细胞凋亡和由p53介导的细胞周期停滞。在代谢综合征中,特定胆汁酸通过活化受体TGR5,促进肠内分泌细胞生成GLP1,进而诱导胰岛素分泌。肠道微生物组还与食欲调节、饮食能量摄取和胰岛素敏感性密切相关。在炎症性肠病,胆汁酸激活核受体PXR、FXR和受体TGR5,通过抑制NF-κB,减少促炎性细胞因子生成、降低肠道通透性。(图4.6.9)

图4.6.9 微生物组、胆汁酸与人类疾病[5]
操控微生物组的胆汁酸代谢有望用于改善疾病,相关干预方法包括改变微生物群的组成、调节微生物代谢某些胆汁酸的能力,或直接将次级胆汁酸作为治疗药物[5]。
近期代表性研究

色氨酸代谢产物
肠道微生物组相关的色氨酸代谢产物,是微生物组- 宿主互作的一个重要方式。色氨酸是一种必需氨基酸,广泛存在于多种食物。它在小肠被吸收,部分到达结肠,可被肠道菌群直接转化生成色胺、吲哚及衍生物(如吲哚乙酸、吲哚丙酸、吲哚乳酸等)。肠道微生物组还可参与或调控色氨酸代谢的另两条主要途径,犬尿氨酸途径和5-羟色胺(即血清素,5-HT)途径。[3]
肠道微生物组相关的色氨酸代谢物可作为信号分子和毒素,调控神经系统、免疫反应、肠道蠕动、黏膜稳态等多种生理功能[6, 7]。例如,犬尿氨酸及衍生物可通过作用于GPR35和芳香烃受体(AhR)等受体,在神经毒性、黏膜稳态和宿主- 微生物组免疫耐受方面发挥作用。吲哚及衍生物可通过作用于AhR、孕烷X 受体(PXR)等机制,影响黏膜稳态,调节免疫(如促进肠道免疫细胞释放IL-22)和代谢(如诱导GLP-1生成以调节胰岛素胰岛素分泌)。吲哚可被肝脏转化为硫酸吲哚酚,具有肾毒性。菌群生成的色胺可诱导肠嗜铬细胞产生5-H,在中枢神经系统和外周组织中发挥多种生理功能,包括调节情绪、睡眠和食欲等,在外周则参与调节肠道蠕动、血小板功能和血管张力。[3]
近期代表性研究

聚焦:肠道微生物组与宿主代谢组关联研究
通过多组学手段揭示肠道微生物组与宿主代谢组的关联,为理解微生物组对宿主健康的影响提供了新视角。
近期代表性研究

4.6.2.3 肠道微生物组与代谢性疾病
大量研究表明,肠道微生物组与肥胖、2型糖尿病、代谢性肝病、心血管代谢疾病等代谢性疾病密切相关。在本节中我们重点关注肥胖和2型糖尿病相关研究,代谢性肝病和心血管疾病相关内容在4.10和4.11探讨。
肥胖
肠道微生物组在肥胖和体重管理中发挥着关键作用,受膳食宏量营养素、微量营养素、纤维、膳食组成、特定药物和减肥手术等多种因素的影响[9]。
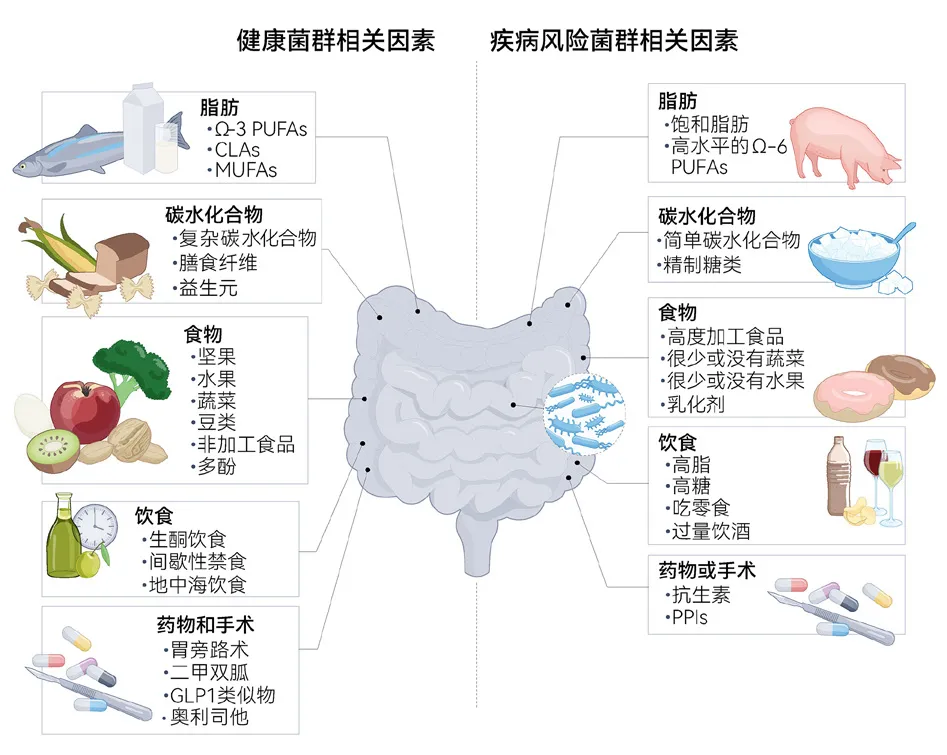
图4.6.11 影响肠道微生物组的肥胖相关因素[9]
肥胖的形成与肠道微生物组的组成和功能密切相关。研究表明,肥胖个体肠道菌群的厚壁菌门比例增加,而拟杆菌门比例减少,这种变化可能促进能量代谢失衡。此外,肠道微生物组通过其代谢产物SCFAs、胆汁酸、内源性大麻素、色氨酸代谢物等影响肠道激素分泌,进而调节多种宿主功能,影响食欲、糖脂稳态、炎症、饱腹感等。微生物组还参与调控肠屏障功能,影响代谢疾病相关的内毒素血症和低度炎症。[9]

图4.6.13 微生物组与减重干预[9]
运动、饮食和禁食、药物、手术(如胃旁路手术)、粪菌移植等肥胖干预措施可改变肠道微生物组的组成和功能,进而通过调节菌群、饮食或宿主衍生的化合物,来影响宿主代谢,实现减重[9]。肠道微生物组的复杂性和个体间的差异性对干预措施的效果具有重要影响,未来的研究需要进一步探讨个性化微生物组调控策略,以实现更有效的肥胖管理。

图4.6.12 肥胖患者肠道微生物组与宿主代谢作用机制[9]
近期代表性研究

2 型糖尿病
肠道微生物组与2型糖尿病(T2DM)的关系主要体现在3个方面。首先,肠道微生物通过发酵膳食纤维产生SCFAs,在调节能量代谢、炎症和胰岛素敏感性方面具有重要作用。其次,由于结肠远端缺乏可发酵碳水化合物,微生物转而利用蛋白质进行发酵,这会产生一些有害代谢物,如氨、酚类化合物和支链脂肪酸(BCFAs),这些代谢物可能损害肠道完整性和代谢健康。此外,慢性低度炎症是另一重要机制,肠道菌群失调与肥胖相关的慢性低度炎症有关,这种炎症状态可以促进胰岛素抵抗的发展,从而导致T2DM。一些初步干预研究已显示,靶向肠道微生物组在改善T2DM方面具有前景。[4]
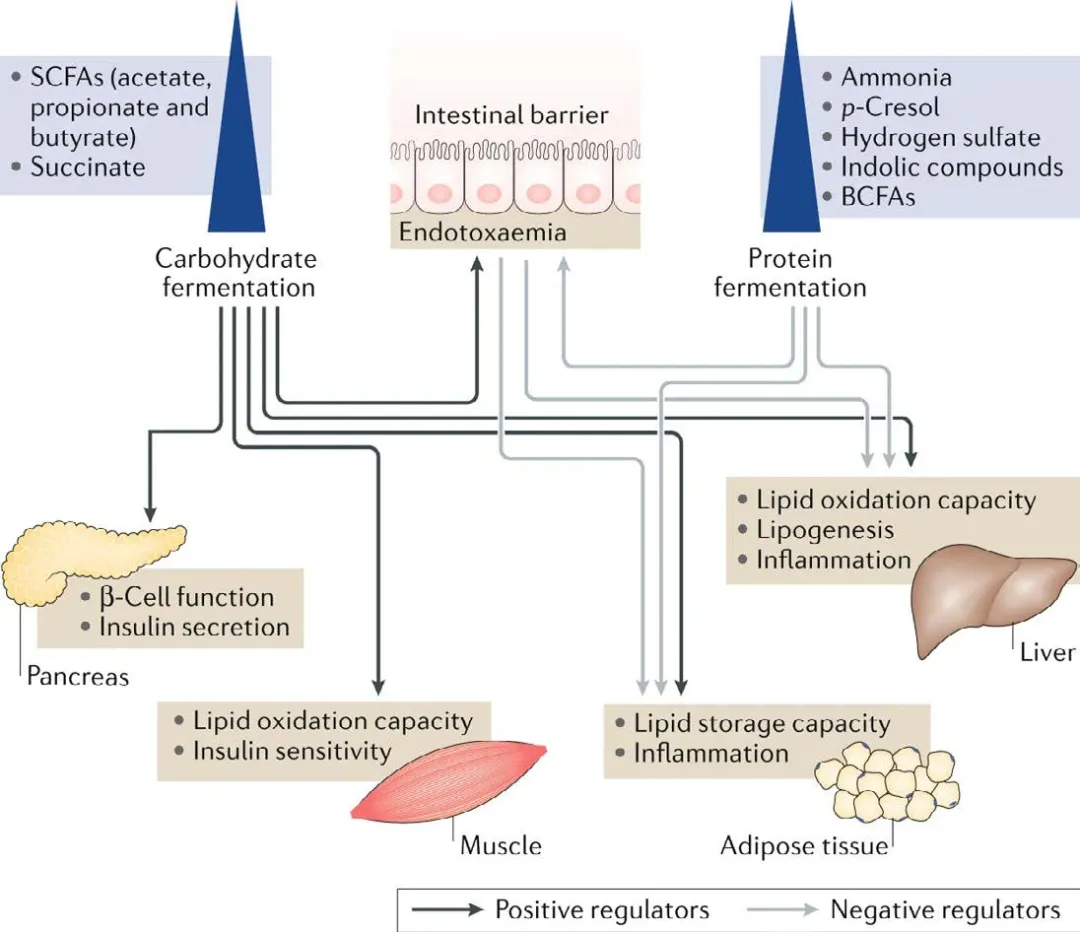
图4.6.14 碳水化合物和蛋白质的微生物组代谢物与2型糖尿病[4]
通过深入解析肠道微生物与宿主代谢的复杂相互作用,评估饮食等不同干预方法对肠道微生物组及代谢健康的长期影响,开发个性化饮食和营养干预策略,人们将进一步揭示肠道微生物组对T2DM的作用机制,并为临床防治提供新的科学依据和干预策略[4]。
近期代表性研究

参考文献
2.Koh, A., et al., From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids asKey Bacterial Metabolites. Cell, 2016. 165(6): p. 1332-1345.
3.Krautkramer, K.A., J. Fan, and F. Bäckhed, Gut microbial metabolites as multikingdom intermediates. Nat Rev Microbiol, 2021. 19(2): p. 77-94.
4.Canfora, E.E., et al., Gut microbial metabolites in obesity, NAFLD and T2DM. Nat Rev Endocrinol, 2019. 15(5): p. 261-273.
5.Collins, S.L., et al., Bile acids and the gut microbiota: metabolic interactions and impacts on disease. Nat Rev Microbiol, 2023. 21(4): p. 236-247.
6.Agus, A., J. Planchais, and H. Sokol, Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease. Cell Host Microbe, 2018. 23(6): p. 716-724.
7.Roager, H.M. and T.R. Licht, Microbial tryptophan catabolites in health and disease.Nat Commun, 2018. 9(1): p. 3294.
9.Van Hul, M. and P.D. Cani, The gut microbiota in obesity and weight management:microbes as friends or foe? Nat Rev Endocrinol, 2023. 19(5): p. 258-271.



