
第四章 肠道微生物组研究14个主题方向
4.4 动物
“动物”主题主要涵盖动物模型、养殖动物、野生动物和宠物等领域的研究,主要涉及肠道微生物组的组成、多样性和功能,肠道免疫系统的结构、功能和调节机制,营养代谢,环境影响、肠道健康管理。我们将简要概述该主题目前的主要认知、研究焦点和未来研究方向,重点关注以动物肠道微生物组为主体的研究。
4.4.1 高影响力研究者
“动物”主题高影响力研究论文的作者姓名词云、核心研究团队(以通讯作者为准)及代表性研究,分别详见图4.4.1、表4.4.1。

图4.4.1 “动物”主题的作者姓名词云
表4.4.1 “动物”主题的代表性研究者

4.4.2 主要认知和研究现状
通过Citespace提取高影响力研究关键词和名词(term),可见高频关键词包括微塑料(microplastics)、(growthperformance)等。

图4.4.2 “动物”主题高影响力研究论文的关键词词云
研究动物肠道微生物组具有重要意义。第一,增加对肠道微生物组多样性的认知可揭示微生物对宿主健康和疾病的作用,为开发微生物组相关的治疗和预防策略提供基础。第二,探索肠道微生物组的传播规律和动态变化有助于理解微生物在不同环境和生理状态下的变化,为预防和控制微生物相关疾病提供参考。第三,了解肠道微生物组与宿主的共演化关系有助于揭示微生物对宿主生理功能和免疫系统的调节作用,为深入理解宿主- 微生物相互作用提供线索。第四,通过在动物模型进行遗传操纵和分子机制研究,可以揭示肠道微生物组与宿主的因果关系和作用机制,为开发微生物组调控的治疗方法提供理论基础。第五,研究动物肠道微生物组有助于改善养殖动物的饲料效率、健康状况和生长性能,提高养殖效益和动物福利。第六,从动物肠道微生物组发现具有特殊功能的微生物,如能降解塑料的细菌,有助于开发环境友好的生物技术和解决环境污染问题。第七,通过研究动物肠道微生物组对环境污染物的响应,可以评估环境污染对动物健康的影响,为环境保护和动物健康提供科学依据。
4.4.2.1 动物模型
哺乳动物
小鼠
小鼠是研究哺乳动物的重要模式生物,其肠道微生物组组成会因个体、品系、环境等因素有所差异,其中肠道细菌主要来自厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),见(图4.4.3)。

图4.4.3 小鼠肠道细菌组成分类学[1]
相比于其他动物,小鼠与人类在基因水平有较高的相似性,且繁殖周期短,易饲养、管理,对实验室条件要求不高,有多种品系和基因编辑技术可供选择,并且小鼠的饲养和实验成本较低,在微生物组研究领域发挥重要作用。
根据微生物状态和来源可将小鼠分为不同类型。①无菌小鼠:在无菌条件下培养和繁殖的小鼠,肠道内没有任何微生物群落。②悉生小鼠:用与无菌动物相同的方法取得饲养,但定植了已知的特定微生物的小鼠。③抗生素处理小鼠:通过抗生素处理改变或减少小鼠肠道微生物组。④ SPF小鼠:为特定病原体无菌小鼠,在培养过程中排除了特定的病原微生物,但仍保留其他正常微生物群落。⑤人源化小鼠:是指将人类组织、细胞或微生物移植到小鼠体内,使其具有类似人类的生理特征或微生物组成。近期Cell发表的一项研究报道成功构建了一个人肠道微生物来源、物种组成明确、结构复杂的群落hCom2,定植hCom2或人类粪便菌群的小鼠具有相似的表型[2]。
大鼠
大鼠是生命科学研究的最常用模式动物之一,其肠道菌群组成与品系和环境等因素相关。大鼠和小鼠的肠道微生物存在一定程度的一致性,肠道细菌主要来自厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),见图4.4.4。
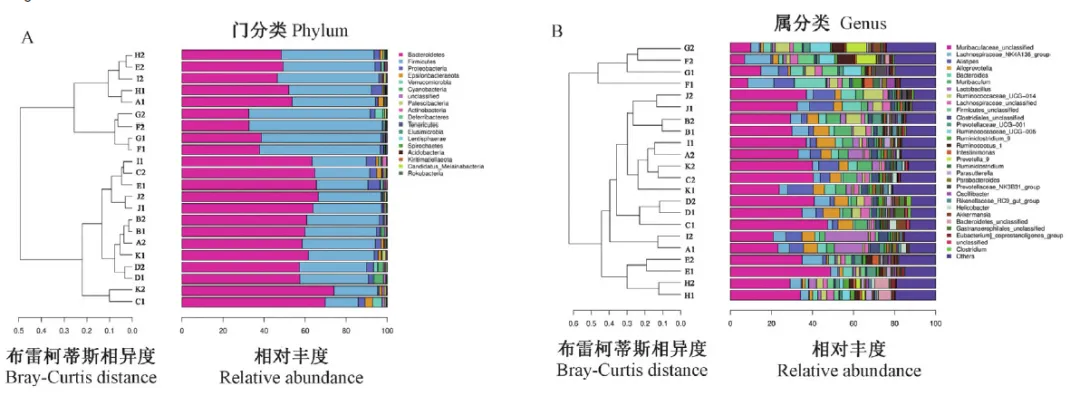
图4.4.4 大鼠肠道细菌组成分类学[3]
猪
近年科研人员发现相较于小型动物模型,大型动物模型在功能、结构、反应等方面更接近人类,也能够更好地模拟人类疾病特征。猪与人类的解剖学尺寸、结构、生理学、免疫学以及基因组等相似性高,可作为优质的动物模型。猪肠道微生物的优势菌门为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),见图4.4.5;优势菌属为普雷沃氏菌属(Prevotella)和罗氏菌属(Roseburia),见图4.4.6。

图4.4.5 猪肠道细菌组成门水平[4]

图4.4.6 猪肠道细菌组成属水平[4]
猴
猴为重要的非人类灵长类模式动物之一,与人类有较接近的进化关系、类似的生理学特征和行为表现,肠道细菌大多来自厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),见图4.4.7。

图4.4.7 恒河猴肠道细菌组成[5]
猴类动物与人类在解剖结构、生理学方面有较高相似性,使得研究结果更接近人类情况。猴类动物的行为表现复杂,有助于研究认知功能、情感反应等高级神经功能。而且猴类动物具有较高的训练度和合作性,适合进行复杂的实验操作。在肠道微生物组研究中,猴模型主要用于感染类疾病、神经科学和行为学方面的研究。
鱼类
斑马鱼是一种常见的模式生物,肠道内存在多种微生物,主要包括变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes) 和厚壁菌门(Firmicutes),见图4.4.8。在肠道微生物组研究中,斑马鱼在微塑料等环境污染物相关研究中较为常用。

图4.4.8 斑马鱼肠道细菌组成[6]
无脊椎动物
果蝇
果蝇隶属双翅目果蝇科果蝇属,是一种常见的模式生物,它的基因组较小,仅为人类基因组的1/25, 的常见肠道菌属包括乳酸菌属(Lactobacillus)和醋酸杆菌属(Acetobacter)[7]。作为经典的模式生物,果蝇在遗传学、发育生物学、神经生物学、免疫学等领域具有独特的研究价值。作为经典的模式生物,果蝇在遗传学、发育生物学、神经生物学、免疫学等领域具有独特的研究价值。
蜜蜂
蜜蜂是全球农作物的主要传粉媒介,具有高度复杂的社会性行为,是一种理想的模式生物。蜜蜂的肠道微生物组成非常简单,仅存在几个核心菌种, 肠道细菌主要包括Snodgrassella alvi、Gilliamella spp、Lactobacillus spp、Bombilactobacillus spp、Bifidobacterium spp、Bartonella apis、Frischella perrara,近年越来越多地被用作菌群的研究模型(图4.4.9)。

图4.4.9 蜜蜂的核心肠道菌种[8]
目前蜜蜂微生物组研究方法包括减菌蜜蜂、特定人工群落定植蜜蜂、抗生素扰动、荧光标记工程菌株、异源表达菌群来源酶、标记重捕、测序和体外实验等。基于这些研究方法,人们逐渐丰富了对蜜蜂菌群的认知:①蜜蜂菌群的空间分布、微生物动力学、以及菌群- 宿主- 营养互作机制;②蜜蜂微生物组存在代谢交叉互养,也存在直接拮抗(如T6SS),菌群介导对蜜蜂病原体的定植抗性包括免疫激活、营养/ 空间竞争、活性抑菌物质分泌和肠屏障维持;③菌群参与蜜蜂的发育和行为调节,同时介导营养代谢和解毒,农用化学品或抗生素施用会对蜜蜂及共生菌群产生直接的负面影响[8]。
线虫
近20年来,由于遗传易操作性的特点,低等模式生物秀丽隐杆线虫已成为良好的动物模型。线虫及其细菌饮食模型可用于研究宿主- 微生物组相互作用,为理解微生物组如何影响生理和疾病提供重要见解[9]。通过大规模和高通量的遗传筛选,可以深入了解微生物对宿主生理的影响。
虽然由于环境和品系等因素,秀丽隐杆线虫的微生物群的组成存在差异,优势微生物也不完全相同,但仍具有一定程度的一致性。在门水平,秀丽隐杆线虫的主要门有变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),见图4.4.10;科水平丰度较高的有肠杆菌科(Enterobacteriaceae)、假单胞菌科(Pseudomonadaceae)、黄单胞菌科(Xanthomonadaceae)和鞘氨醇杆菌科(Sphingobacteriaceae)。

图4.4.10 秀丽隐杆线虫的肠道细菌组成[9]
聚焦:野化小鼠有助于提高临床前研究转化应用
常规实验小鼠不具备“正常”的共生菌群,可能影响实验结果的可重复性,甚至转化应用价值。与人工饲养的实验小鼠相比,自然环境中的野生小鼠表现出更高的免疫激活能力,有利于免疫应答研究。多项有关小鼠菌群野化的研究成功促进了人们对宿主-菌群互作的理解[10-14]。
近期代表性研究

聚焦:蜜蜂肠道微生物组
脊椎动物的肠道菌群,来自较少数量的门的细菌占据了大多数,而蜜蜂肠道菌群组成则更简单且非常一致。近期关于蜜蜂肠道微生物组的研究取得了诸多进展,回答了蜜蜂共生菌群的进化、功能作用、共生菌定植机制菌群与觅食强度,以及菌群如何影响蜜蜂行为、对抗致病性感染等问题[15-19]。
近期代表性研究

聚焦:微塑料对肠道微生物组的不良影响
微塑料是近年在大多数环境和生物系统中检测到的新兴污染物,它可以直接进入水和土壤,也可以随风和雨进入不同环境区域。许多鱼类的消化道都可检测到微塑料,近年相关研究揭示了微塑料对鱼肠道微生物组的影响[20-24],为深入理解微塑料污染对水生生态系统和生物健康的影响提供了宝贵信息。
近期代表性研究

聚焦:从无脊椎动物肠道寻找降解塑料的细菌
塑料废物对环境造成的影响日益引起人们的关注,有效处理塑料废物成为当今社会面临的一项重要环境挑战。传统的塑料处理方式存在许多不足之处,因此迫切需要采用创新的生态环境技术克服这些问题。近期研究发现了一些细菌具有降解塑料的能力,对探索生物降解塑料的机制、开发环保塑料降解方法具有重要意义[25-28]。
近期代表性研究

参考文献
1.Beresford-Jones, B.S., et al., The Mouse Gastrointestinal Bacteria Catalogue enables translation between the mouse and human gut microbiotas via functional mapping. Cell Host & Microbe, 2022. 30(1): p. 124-138.e8.
2.Cheng, A.G., et al., Design, construction, and in vivo augmentation of a complex gut microbiome. Cell, 2022. 185(19): p. 3617-3636.e19.
3. 黄树武, et al., 常用小鼠, 大鼠肠道菌群比较研究. 中国实验动物学报, 2021. 29(6): p. 777-784.
4.Ramayo-Caldas, Y., et al., Phylogenetic network analysis applied to pig gut microbiota identifies an ecosystem structure linked with growth traits. Isme j, 2016. 10(12): p. 2973-2977.
5.Yang, S., et al., Assembly of novel microbial genomes from gut metagenomes of rhesus macaque (Macaca mulatta). Gut Microbes, 2023. 15(1): p. 2188848.
6.Wang, A., et al., Intestinal Cetobacterium and acetate modify glucose homeostasis via parasympathetic activation in zebrafish. Gut Microbes, 2021. 13(1): p. 1-15.
7.Han, G., et al., Comparative Analysis of Drosophila melanogaster Gut Microbiota with Respect to Host Strain, Sex, and Age. Microb Ecol, 2017. 74(1): p. 207-216.
8.Motta, E.V.S. and N.A. Moran, The honeybee microbiota and its impact on health and disease. Nat Rev Microbiol, 2024. 22(3): p. 122-137.
9.Zhang, J., A.D. Holdorf, and A.J. Walhout, C. elegans and its bacterial diet as a model for systems-level understanding of host-microbiota interactions. Curr Opin Biotechnol, 2017. 46: p. 74-80.
10.Yeung, F., et al., Altered Immunity of Laboratory Mice in the Natural Environment Is Associated with Fungal Colonization. Cell Host Microbe, 2020. 27(5): p. 809-822.e6.
11.Arnesen, H., et al., Naturalizing laboratory mice by housing in a farmyard-type habitat confers protection against colorectal carcinogenesis. Gut Microbes, 2021. 13(1): p. 1993581.
12.Lin, J.D., et al., Rewilding Nod2 and Atg16l1 Mutant Mice Uncovers Genetic and Environmental Contributions to Microbial Responses and Immune Cell Composition. Cell Host Microbe, 2020. 27(5): p. 830-840.e4.
13.Ma, J., et al., Laboratory mice with a wild microbiota generate strong allergic immune responses. Sci Immunol, 2023. 8(87): p. eadf7702.
14.Rosshart, S.P., et al., Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science, 2019. 365(6452).
15.Wu, Y., et al., Genetic divergence and functional convergence of gut bacteria between the Eastern honey bee Apis cerana and the Western honey bee Apis mellifera. J Adv Res, 2022. 37: p. 19-31.
16.Quinn, A., et al., Host-derived organic acids enable gut colonization of the honey bee symbiont Snodgrassella alvi. Nat Microbiol, 2024. 9(2): p. 477-489.
17.Vernier, C.L., et al., Gut microbiota contribute to variations in honey bee foraging intensity. Isme j, 2024. 18(1).
18.Zhang, Z., et al., Honeybee gut Lactobacillus modulates host learning and memory behaviors via regulating tryptophan metabolism. Nat Commun, 2022. 13(1): p. 2037.
19.Lang, H., et al., Identification of peptides from honeybee gut symbionts as potential antimicrobial agents against Melissococcus plutonius. Nat Commun, 2023. 14(1): p. 7650.
20.Kang, H.M., et al., Different effects of nano- and microplastics on oxidative status and gut microbiota in the marine medaka Oryzias melastigma. J Hazard Mater, 2021. 405: p. 124207.
21.Liao, X., et al., Network analysis reveals significant joint effects of microplastics and tetracycline on the gut than the gill microbiome of marine medaka. J Hazard Mater, 2023. 442: p. 129996.
22.Huang, J.-N., et al., Micro/nano-plastics cause neurobehavioral toxicity in discus fish (Symphysodon aequifasciatus): Insight from brain-gut-microbiota axis. Journal of Hazardous Materials, 2022. 421: p. 126830.
23.Teng, M., et al., Polystyrene Nanoplastics Toxicity to Zebrafish: Dysregulation of the Brain–Intestine–Microbiota Axis. ACS Nano, 2022. 16(5): p. 8190-8204.
24.Guo, X., et al., The distinct toxicity effects between commercial and realistic polystyrene microplastics on microbiome and histopathology of gut in zebrafish. J Hazard Mater, 2022. 434: p. 128874.
25.Zhang, Z., et al., Polyvinyl chloride degradation by a bacterium isolated from the gut of insect larvae. Nat Commun, 2022. 13(1): p. 5360.
26.De Filippis, F., et al., Plastics shape the black soldier fly larvae gut microbiome and select for biodegrading functions. Microbiome, 2023. 11(1): p. 205.
27.Mamtimin, T., et al., Gut microbiome of mealworms (Tenebrio molitor Larvae) show similar responses to polystyrene and corn straw diets. Microbiome, 2023. 11(1): p. 98.
28.Zhang, J., et al., Biodegradation of polyethylene microplastic particles by the fungus Aspergillus flavus from the guts of wax moth Galleria mellonella. Sci Total Environ, 2020. 704: p. 135931.



