
第四章 肠道微生物组研究14个主题方向
4.5 免疫
“免疫”主题主要关注免疫相关的肠道微生物组研究,是肠道微生物组领域持续的研究焦点。我们基于近期的高影响力综述和研究,简要概述关于肠道微生物组与宿主免疫的相互作用和机制,肠道微生物组在免疫相关疾病中的作用,肠道微生物组与宿主免疫发育和衰老等研究话题的主要认知、研究焦点和未来研究方向。肿瘤免疫治疗和炎症性肠病相关内容,请见4.8和4.10。
4.5.1 高影响力研究者
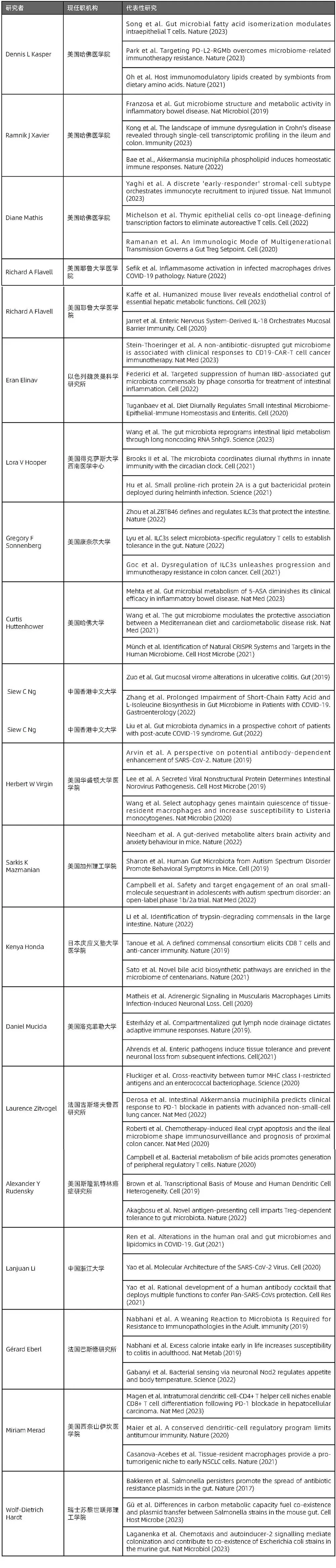
“免疫”主题的高影响力研究论文的作者姓名词云、核心研究团队(以通讯作者为准)及代表性研究,详见图4.5.1、表4.5.1。

图4.5.1 “免疫”主题的作者姓名词云
表4.5.1 “免疫”主题的代表性研究者
4.5.2 主要认知和研究现状
“免疫”主题高影响力研究论文的关键词词云如图4.5.2所示。通过Citespace文本挖掘,该主题的常见名词(term)包括炎症性肠病(inflammatory bowel disease)、T细胞(T cells)、免疫反应(immune responses)、免疫系统(immune system)、肠道炎症(intestinal inflammation)、调节性T细胞(regulatory T cells)、短链脂肪酸(short-chainfatty acids)、溃疡性结肠炎(ulcerative colitis)、克罗恩病(Crohn’s disease)、Toll样受体(toll-like receptor)、免疫检查点阻断(immune checkpointblockade)、淋巴细胞(lymphoid cells)、树突状细胞(dendritic cells)等。

图4.5.2 “免疫”主题高影响力研究论文的关键词词云
4.5.2.1 稳态下微生物组- 免疫互作
微生物组与宿主免疫系统存在多种方式的互作,微生物组在宿主的先天性、适应性免疫系统的训练与发育中发挥关键作用,免疫系统也在宿主- 微生物组共生稳态的维持中扮演了重要角色[1]。
肠道微生物组及代谢产物通过影响肠上皮细胞、免疫细胞(树突状细胞、天然淋巴细胞、T细胞亚型等),调节肠道免疫稳态,同时免疫细胞可影响肠道微生物组组成(图4.5.3)。

图4.5.3 免疫稳态下免疫- 微生物组互作机制[1]
4.5.2.2 微生物组与免疫细胞互作
巨噬细胞
肠道微生物组通过调控肠道黏膜或产生短链脂肪酸、芳烃受体激动剂代谢物等可直接对巨噬细胞的表型和功能产生影响,而巨噬细胞可清除入侵的病原体、调节炎症反应,从而维持肠道稳态[5, 6]。
近期代表性研究

树突状细胞
肠道树突状细胞表现出独特的功能特性,既涉及维持对无害抗原的耐受性,又涉及产生针对病原体的保护性免疫反应[7]。树突状细胞能够将树突发送到上皮细胞之外,直接捕获细菌,进而激活下游免疫反应[1]。
近期代表性研究

天然淋巴细胞
天然淋巴细胞(ILC)在调节组织稳态、免疫防御方面具有重要作用,其中3 型天然淋巴细胞(ILC3)与肠道其他细胞密切互作,在肠道淋巴组织发育、屏障完整性、耐受微生物组和饮食抗原等方面有关键作用[8]。
微生物代谢产物、营养物质可调控肠道与其他免疫/ 非免疫细胞的相互作用,以及调节肠道屏障完整性、抗微生物反应、免疫耐受或炎症(图4.5.4)。

图4.5.4 ILC3对肠道组织生理和免疫耐受起协调作用[8]
近期代表性研究

粒细胞
肠道微生物通过多种方式影响粒细胞,如中性粒细胞、嗜酸性粒细胞、嗜碱性粒细的发育、招募和功能,包括直接调控和间接调控。中性粒细胞也通过吞噬作用、产生ROS等途径影响肠道微生物的组成和功能[9]。

图4.5.5 中性粒细胞与微生物组对话概述[9]
近期代表性研究

T 细胞
特定的肠道微生物组成分能够诱导T细胞分化为不同的亚群,其中调节性T细胞(Treg)可通过免疫细胞中的抗炎细胞因子、小分子调控肠道的黏膜免疫,还可通过促进上皮屏障功能、组织修复维持肠道的生理功能,是肠道稳态和损伤修复过程的重要参与者[10, 11]。

图4.5.6 肠道调节性T细胞亚群的影响因素和功能[11]
近期代表性研究

B 细胞
肠道微生物组可影响B细胞相关的IgA应答以及调节性B细胞的功能,肠道B细胞反应在有组织的肠道相关淋巴组织(GALT)启动,肠道微生物组可能通过影响B细胞,从而影响系统性自身免疫疾病的发生发展[12]。
黏膜表面的体液免疫反应主要集中于免疫球蛋白(IgA),分泌型IgA(sIgA)是主要的肠道抗体,可通过影响细菌的定植、基因表达和功能来维持肠道微生物的稳态,同时受宿主遗传、细菌遗传和环境因素的影响[13,14]。
IgA可影响肠道微生物的定植和功能,可直接阻止侵袭性病原体定植,通过调节黏膜黏附影响细菌定植,同时能调节细菌基因表达,影响其运动和代谢(图4.5.7)。

图4.5.7 IgA在胃肠道发挥作用[15]
近期代表性研究

疫苗反应
肠道微生物组差异与免疫状态、疫苗免疫原性的差异相关,微生物组的鞭毛蛋白、肽聚糖等分子以及微生物组代谢产物(如短链脂肪酸)可调节免疫细胞,影响疫苗效果[4]。

图4.5.8 微生物组调节疫苗免疫原性和效力的潜在机制[4]
a:微生物通过模式识别受体,影响T细胞和B细胞调节抗体产量;b:微生物组调节浆细胞样树突状细胞产生的Ⅰ型干扰素,影响经典树突状细胞介导的抗原呈递及T细胞激活;c:微生物代谢产物可增强B细胞代谢和抗体生产;d:微生物编码的表位可能与疫苗或病原体表位交叉反应,进而影响疫苗反应。
近期代表性研究

参考文献
1.Zheng, D., T. Liwinski, and E. Elinav, Interaction between microbiota and immunity in health and disease. Cell Res, 2020.30(6): p. 492-506.
4.Lynn, D.J., et al., Modulation of immune responses to vaccination by the microbiota: implications and potential mechanisms.Nat Rev Immunol, 2022. 22(1): p. 33-46.
5.Na, Y.R., et al., Macrophages in intestinal inflammation and resolution: a potential therapeutic target in IBD. Nat Rev Gastroenterol Hepatol, 2019. 16(9): p. 531-543.
6.Garrett, W.S., Immune recognition of microbial metabolites. Nature Reviews Immunology, 2020. 20(2): p. 91-92.
7.Coombes, J.L. and F. Powrie, Dendritic cells in intestinal immune regulation. Nature Reviews Immunology, 2008. 8(6): p. 435-446.
8.Horn, V. and G.F. Sonnenberg, Group 3 innate lymphoid cells in intestinal health and disease. Nat Rev Gastroenterol Hepatol,2024.
9.Danne, C., et al., Neutrophils: from IBD to the gut microbiota. Nat Rev Gastroenterol Hepatol, 2024. 21(3): p. 184-197.
10.Brown, E.M., D.J. Kenny, and R.J. Xavier, Gut Microbiota Regulation of T Cells During Inflammation and Autoimmunity. Annu Rev Immunol, 2019. 37: p. 599-624.
11.Ramanan, D., et al., Regulatory T cells in the face of the intestinal microbiota. Nat Rev Immunol, 2023. 23(11): p. 749-762.
12.Spencer, J. and M. Bemark, Human intestinal B cells in inflammatory diseases. Nat Rev Gastroenterol Hepatol, 2023. 20(4): p.254-265.
13.Chen, K., et al., Rethinking mucosal antibody responses: IgM, IgG and IgD join IgA. Nature Reviews Immunology, 2020.20(7): p. 427-441.
14.Huus, K.E., C. Petersen, and B.B. Finlay, Diversity and dynamism of IgA - microbiota interactions. Nature Reviews Immunology, 2021. 21(8): p. 514-525.
15.Huus, K.E., C. Petersen, and B.B. Finlay, Diversity and dynamism of IgA-microbiota interactions. Nat Rev Immunol, 2021.21(8): p. 514-525.



