
第四章 肠道微生物组研究14个主题方向
4.5 免疫
4.5.2 主要认知和研究现状
4.5.2.3 微生物组代谢产物与黏膜免疫
肠道微生物组代谢产物是微生物与宿主免疫互作之间的关键分子信使,直接调节黏膜免疫信号,影响宿主生理功能,对于肠道黏膜免疫稳态具有重要作用,热门研究物质有短链脂肪酸、胆汁酸和色氨酸代谢物等[17]。

图4.5.9 短链脂肪酸(SCFAs)及其对宿主的影响[17]
a:短链脂肪酸(如乙酸、丙酸和丁酸)在宿主体内增加饱腹感、促进脂肪组织棕化、参与肠葡萄糖生成,并增加PYY和GLP1的分泌;b:在免疫方面,短链脂肪酸支持B细胞和调节性T细胞(Treg)的发育,通过抑制HDAC、调节炎症小体和影响结肠免疫细胞,维持黏膜完整性并促进Treg细胞分化(b)。
近期代表性研究

4.5.2.4 微生物组与免疫发育和免疫衰老
肠道微生物组可传递环境信号、调控疾病风险,并随宿主年龄而变化[2]。生命早期是微生物与免疫系统相互作用的关键时期,此时肠道微生物组的建立受到多种因素的影响,如分娩方式、抗生素暴露和配方喂养,肠道微生物组的发育对免疫系统成熟具有重要作用[3]。

图4.5.10 婴儿、年轻人和老年人肠道微生物群差异的影响因素[4]

图4.5.11 促进特应性免疫发育的早期因素[3]
近期代表性研究

4.5.2.5 微生物组与免疫相关疾病
肠道微生物组及相关的代谢物可通过循环系统从肠腔转移到多个远端器官,随后诱发特异性局部免疫反应,对肠外免疫稳态起着重要作用[1, 16]。例如致病菌鹑鸡肠球菌(E. gallinarum)可通过增加屏障通透性和运动易位至肝脏,通过DNA或RNA等诱导肝脏自身抗原并激活自身免疫性肝病,甚至系统性自身免疫性疾病(图4.5.12)。

图4.5.12 微生物群与多种免疫介导疾病的联系(以致病菌E. gallinarum 为例)[16]
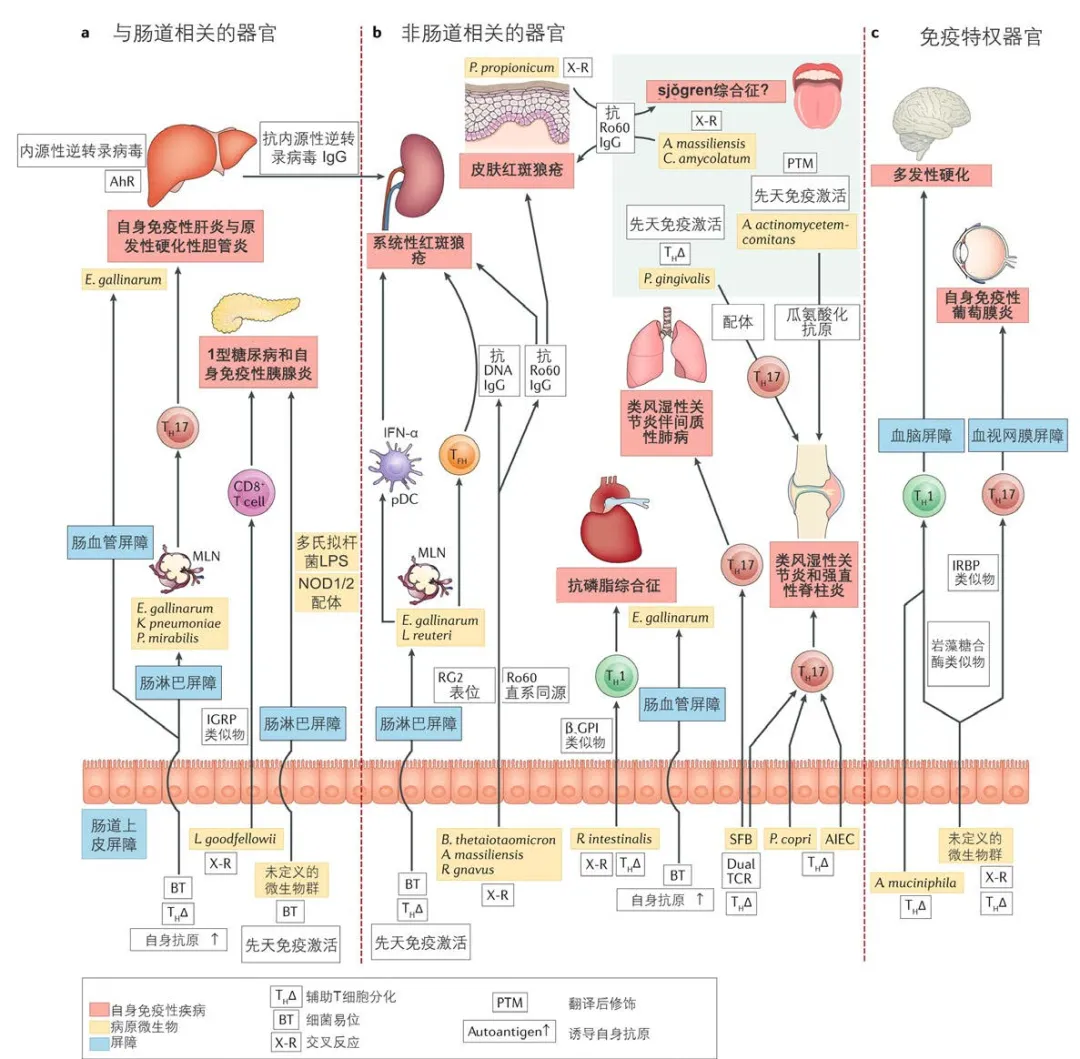
图4.5.13 致病共生菌与自身免疫性疾病[18]
自身免疫疾病可分为肠道相关、非肠道相关和免疫特权器官三种类型,图中总结了多种细菌通过易位、影响免疫细胞甚至交叉反应等机制参与自身免疫疾病的发生发展。
在环境因素与遗传因素的影响下,微生物组- 免疫互作的失调促进多种免疫相关疾病的发生发展及药物治疗效果,包括炎症性肠病、类风湿关节炎、心血管代谢疾病、癌症等,靶向肠道微生物组或代谢产物是防治免疫相关疾病具有极大潜力的研究方向[1]。
近期代表性研究

定植抵抗与肠道感染
肠道微生物通过直接和间接机制介导定植抗性,直接机制包括营养竞争、抗菌肽、接触依赖性抑制等,间接机制主要是通过增强黏液屏障、降低肠腔氧含量、诱导宿主免疫反应[20]。
近期代表性研究

新冠肺炎
新冠肺炎与胃肠道关系密切,不仅新冠病毒能感染肠道细胞,而且许多新冠患者出现胃肠道症状,表现为肠道微生物组成变化。肠道微生物变化可能与新冠肺炎的严重程度、宿主免疫反应异常相关,新冠病毒还可能对人类微生物组产生长期影响[19]。

图4.5.14 肠道微生物群对免疫功能失调、新冠严重程度的影响[19]
新冠病毒感染可能通过激活免疫细胞的模式识别受体、改变肠道上皮细胞功能或直接感染细菌,导致肠道微生物组失调。特定的微生物特征可能通过加剧肠道促炎反应、引起菌血症或影响免疫细胞招募,影响新冠肺炎的严重程度和宿主免疫应答。
近期代表性研究

参考文献
1.Zheng, D., T. Liwinski, and E. Elinav, Interaction between microbiota and immunity in health and disease. Cell Res, 2020.30(6): p. 492-506.
2.Ghosh, T.S., F. Shanahan, and P.W. O’Toole, The gut microbiome as a modulator of healthy ageing. Nature Reviews Gastroenterology & Hepatology, 2022. 19(9): p. 565-584.
3.Donald, K. and B.B. Finlay, Early-life interactions between the microbiota and immune system: impact on immune system development and atopic disease. Nat Rev Immunol, 2023. 23(11): p. 735-748.
4.Lynn, D.J., et al., Modulation of immune responses to vaccination by the microbiota: implications and potential mechanisms.Nat Rev Immunol, 2022. 22(1): p. 33-46.
16.Miyauchi, E., et al., The impact of the gut microbiome on extra-intestinal autoimmune diseases. Nat Rev Immunol, 2023.23(1): p. 9-23.
17.Lavelle, A. and H. Sokol, Gut microbiota-derived metabolites as key actors in inflammatory bowel disease. Nat RevGastroenterol Hepatol, 2020. 17(4): p. 223-237.
18.Ruff, W.E., T.M. Greiling, and M.A. Kriegel, Host–microbiota interactions in immune-mediated diseases. Nature Reviews Microbiology, 2020. 18(9): p. 521-538.
19.Zhang, F., et al., Gut microbiota in COVID-19: key microbial changes, potential mechanisms and clinical applications. Nat Rev Gastroenterol Hepatol, 2023. 20(5): p. 323-337.
20.Caballero-Flores, G., J.M. Pickard, and G. Núñez, Microbiota-mediated colonization resistance: mechanisms and regulation.Nature Reviews Microbiology, 2023. 21(6): p. 347-360.



