
今天,非常高兴能够来到“肠·道”的现场,非常感谢蓝灿辉先生的邀请,我也很荣幸能够在这里和大家进行交流。
我是来自南方医科大学的陈鹏,今天我的题目是:菌群代谢物——肠道微生物调控肠外器官损伤的一只“手”。
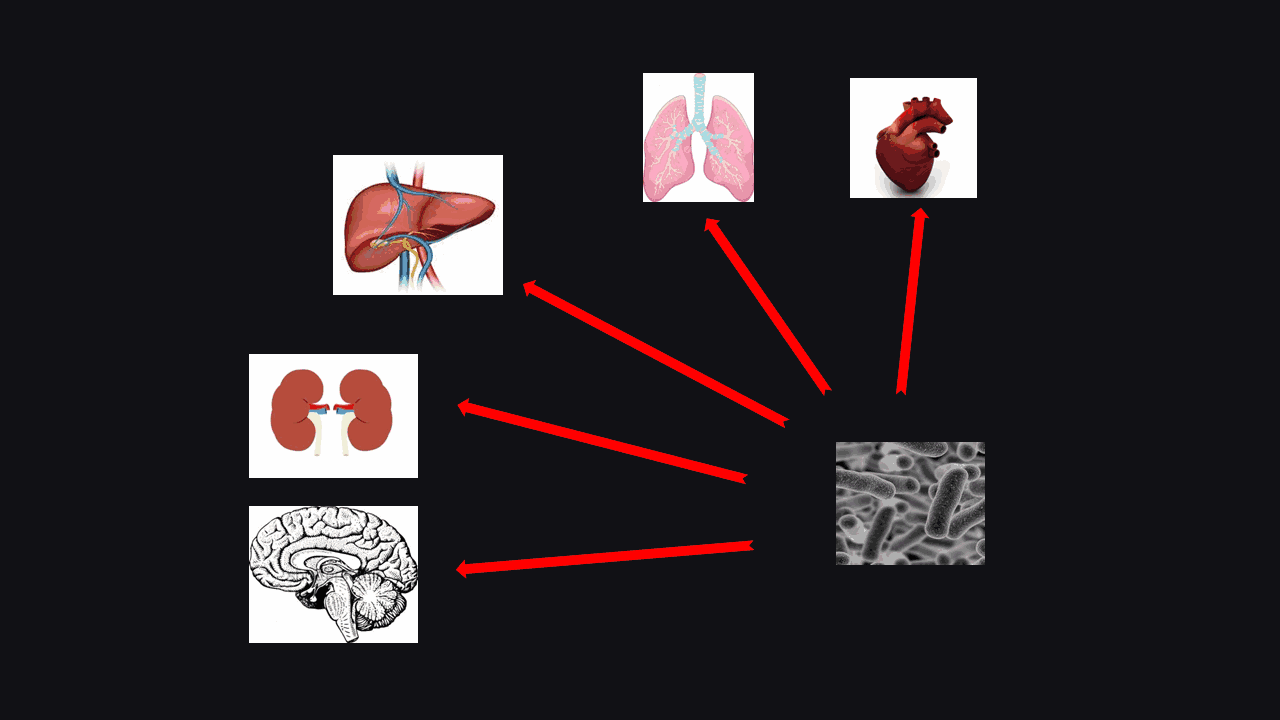
众所周知,肠道微生物的研究现在是基础医学、临床医学研究中非常热的一个点。
这是因为它被证明不仅可以调控肠道自身的损伤,比如说肠道微生物和IBD(炎症性肠病)、CRC(结直肠癌)等有紧密联系;同时,也有越来越多的证据表明,肠道微生物还可以调控肠外众多脏器的损伤,比如说有实际的证据表明肠道微生物可以调控心脏、肺脏、肝、肾、脑等肠外多脏器的疾病的发生。
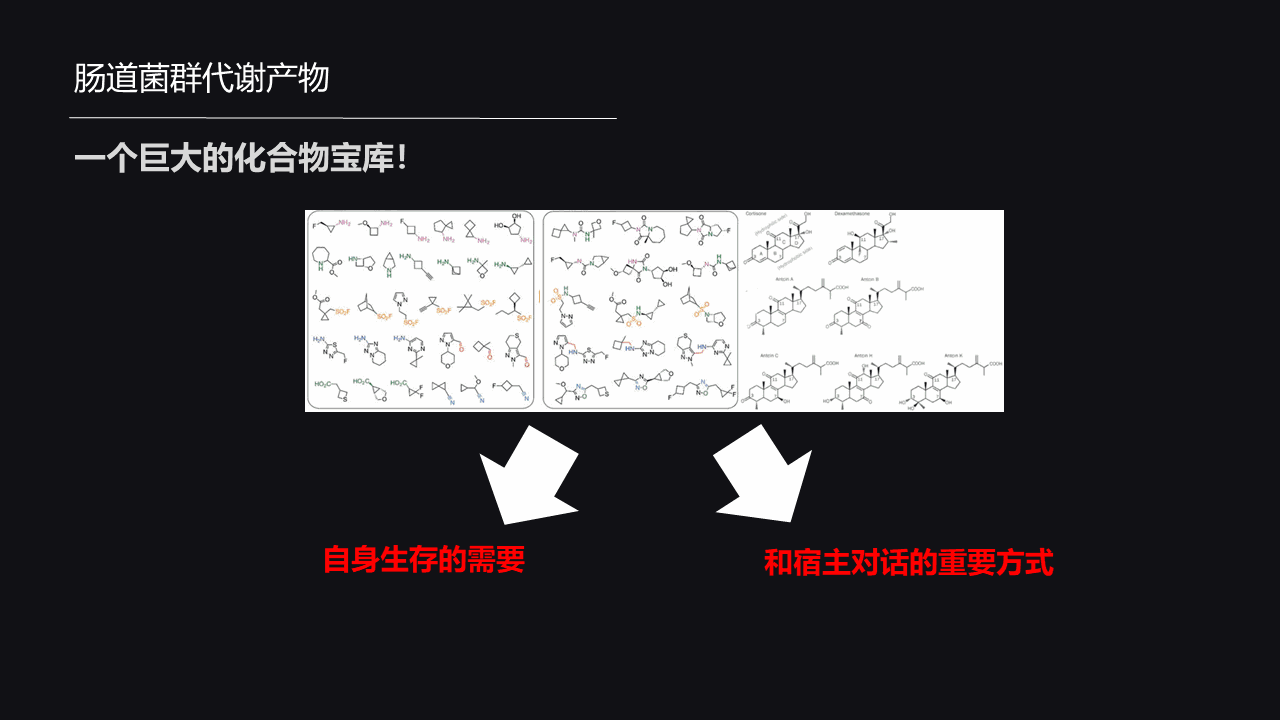
那么我们现在就有疑问,寄居在肠道中的微生物如何把手伸到肠外去调控肠外多脏器损伤呢?经过多年的研究,我们发现,代谢产物很可能就是这只隐形的手。
可以试想一下,现在我们已知的在肠道里面寄居的菌株超过了上千种,而每一种菌株因为生存的需要它又可以产生成百上千种的代谢物,如此排列组合,肠道微生物的代谢产物将是非常丰富多彩的。
它是一个非常巨大、有价值的宝库,它肯定有自己的意义。我个人认为,它主要意义有以下两个地方。
首先,正如我之前所说的,它是为了自身生存所需要把从食物中的一些物质代谢成一些有利于它生存的物质。
除此之外,还有一个更重要的意义,它产生的这些代谢产物可以作为它和宿主相互对话的一个重要的媒介。它一旦产生这个物质之后,这个物质可以被它释放出来进入肠腔,穿过屏障进入循环系统,抵达远端脏器,和我们整个宿主的各个器官、各个组织、各个细胞都有可能亲密接触。
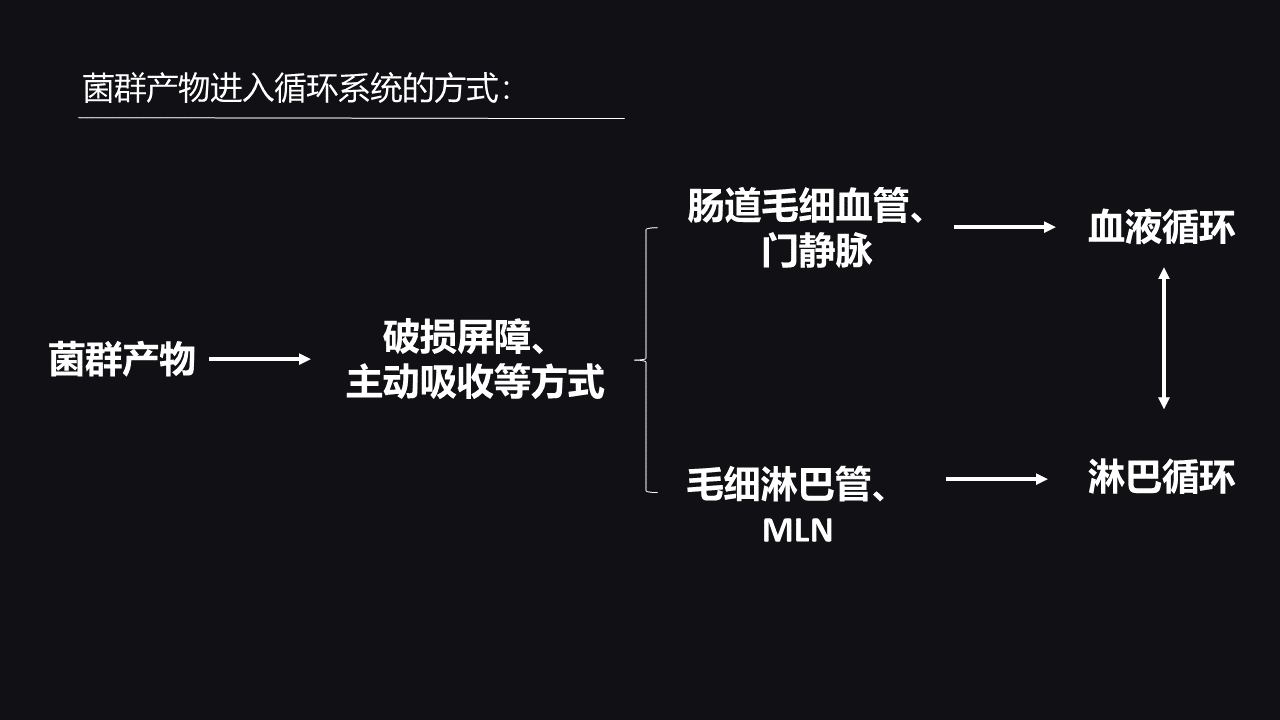
那么,下面我想通过这张片子给大家简单介绍一下肠道菌群代谢产物这只“手”是怎么伸出去的。
目前来说,我们知道,菌群一旦产生它的代谢产物之后,就可以分泌出来进入肠腔,然后它可以通过破损的肠道屏障或者被肠上皮主动吸收的方式进入我们的肠道毛细血管,在肠道毛细血管中它就可以汇集,通过门静脉进入肝脏、进入体循环,这样就可以进入我们的血液循环系统。
肠道菌群的产物还可以进入我们的肠道的毛细淋巴管,被转运到肠系膜淋巴结,然后进入淋巴循环。淋巴循环和血液循环之间还可以互相的对话、互相的传递。
因此,通过这两种方式,肠道菌群的代谢产物可以相对轻松的进入我们的循环系统,从而抵达我们身体的几乎每个地方。
下面我就给大家介绍两个经典的案例,让大家更熟悉我们肠道菌群的产物是如何调控我们肠外脏器损伤的。
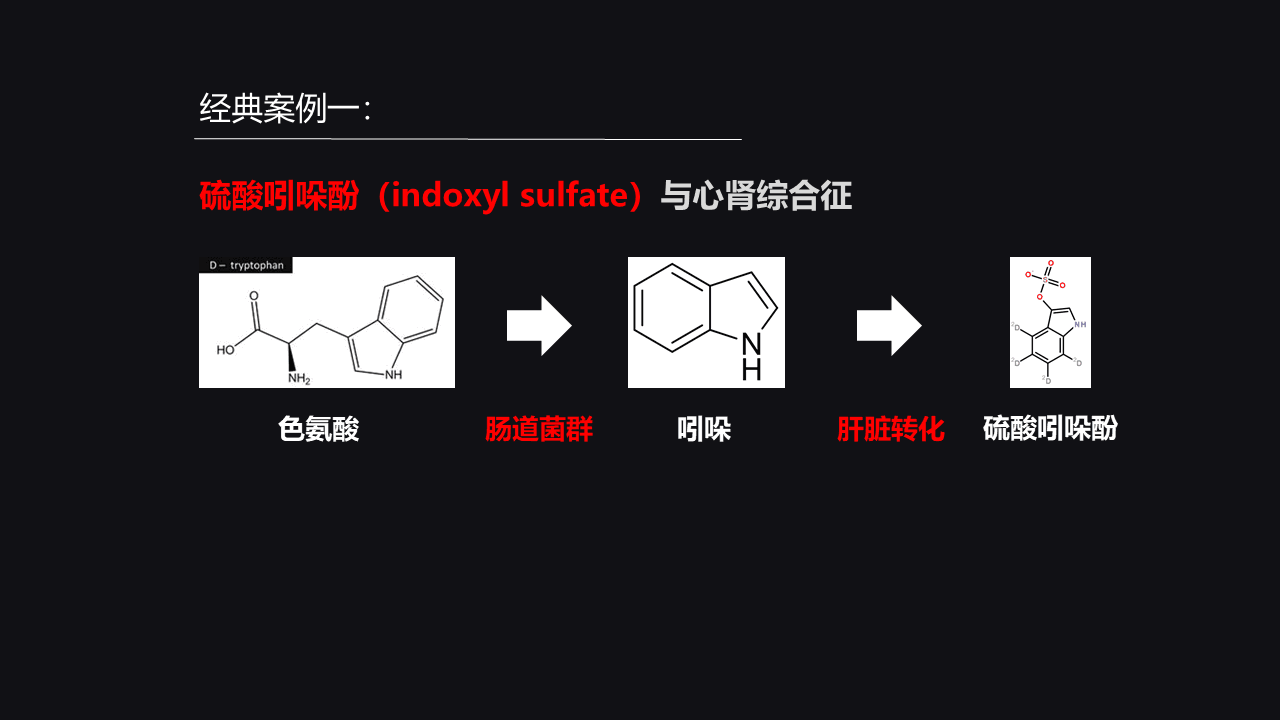
首先,我们第一个经典案例就是硫酸吲哚酚和我们的心肾综合征。硫酸吲哚酚简称IS,它在心肾综合征中起着非常关键的作用。
长期以来,临床医生,尤其是肾内科的医生,还有心内科的医生他们发现心肾综合征的患者的发病和一个非常关键的化合物有关,这个化合物就是硫酸吲哚酚。
那么,首先,我们看硫酸吲哚酚是怎么来的。在肠道中无论是食物摄取还是我们自己的肠道菌群,产生的一些色氨酸会被肠道菌群降解代谢成吲哚,在肝脏中,它就会被转化成硫酸吲哚酚。

硫酸吲哚酚一旦在体内积聚,长时间累积之后它就会产生一些负面的效应,比如说它可以损伤肾小管的上皮细胞、诱导肾脏纤维化,同时它还可以损伤我们血管内皮细胞以及心肌细胞,慢慢的诱导心脏肥大甚至心脏衰竭。
所以硫酸吲哚酚这个肠道菌群来源的代谢产物,它是一个在心肾综合征之中非常不好的分子。
其实我们还可以举出一个更有名的,那就是氧化三甲胺这个分子。
氧化三甲胺它也是有类似的一个途径,也就是说食物中的一些胆碱它可以被菌群转化成TMA,即所谓的三甲胺,而三甲胺也可以经过肝脏加氧氧化之后变成氧化三甲胺而堆积在体内,从而可以促进动脉粥样硬化的形成。
那是不是所有的菌群产物都是有害的呢?其实完全不是这样,还有一些有益的分子也会对肠外脏器损伤有所保护。
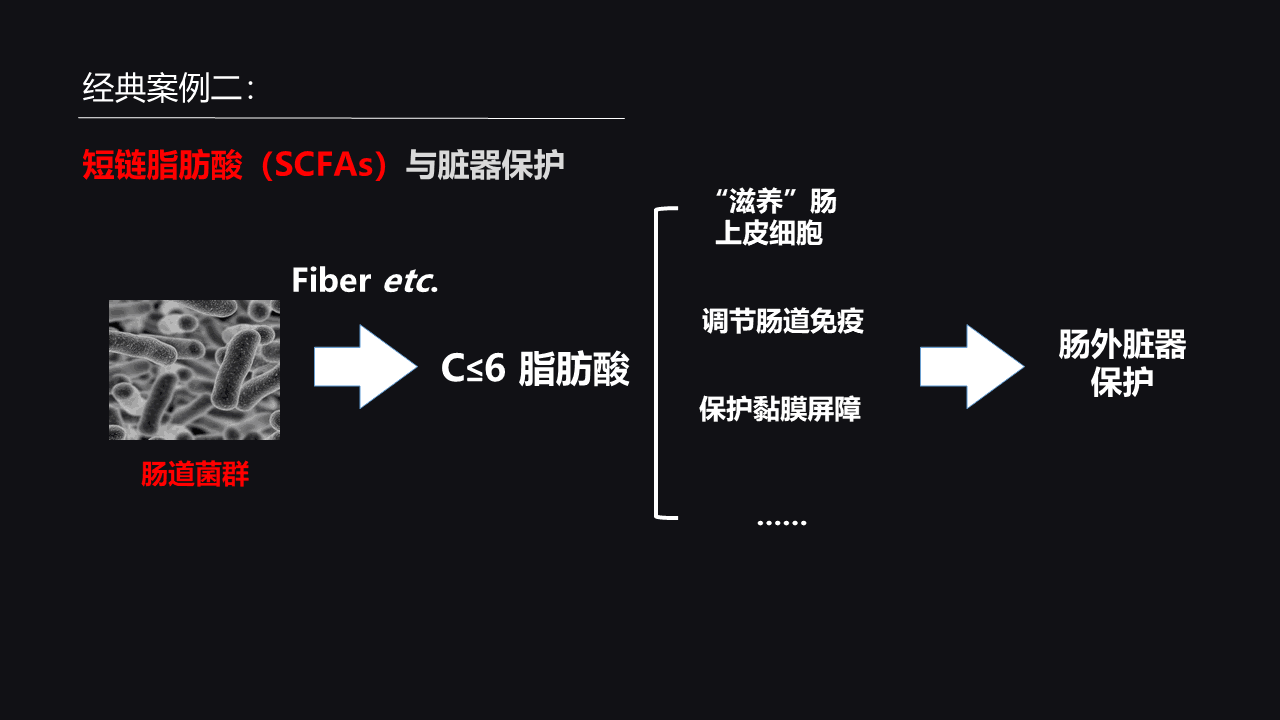
这里第二个案例就是短链脂肪酸和我们的脏器损伤。
短链饱和脂肪酸可能会因为肠道菌群代谢纤维等一些物质而产生,那么短链饱和脂肪酸的累积被证明是很有益处的。
比如说,它可以滋养肠道上皮细胞,除此之外,也有证据表明短链饱和脂肪酸还可以调节免疫细胞,比如说T辅助细胞的功能,维持肠道免疫系统的一个正常运转。同时,短链脂肪酸还可以有利于保护肠道黏膜屏障的完整性。
所以,肠道里面所产生的短链饱和脂肪酸可以对我们肠胃脏器产生一个很好的保护作用。
那么下面呢,我想就我们实验室自己的工作,向各位交流一下肠道菌群的产物对肠外器官损伤的一些其它的影响。
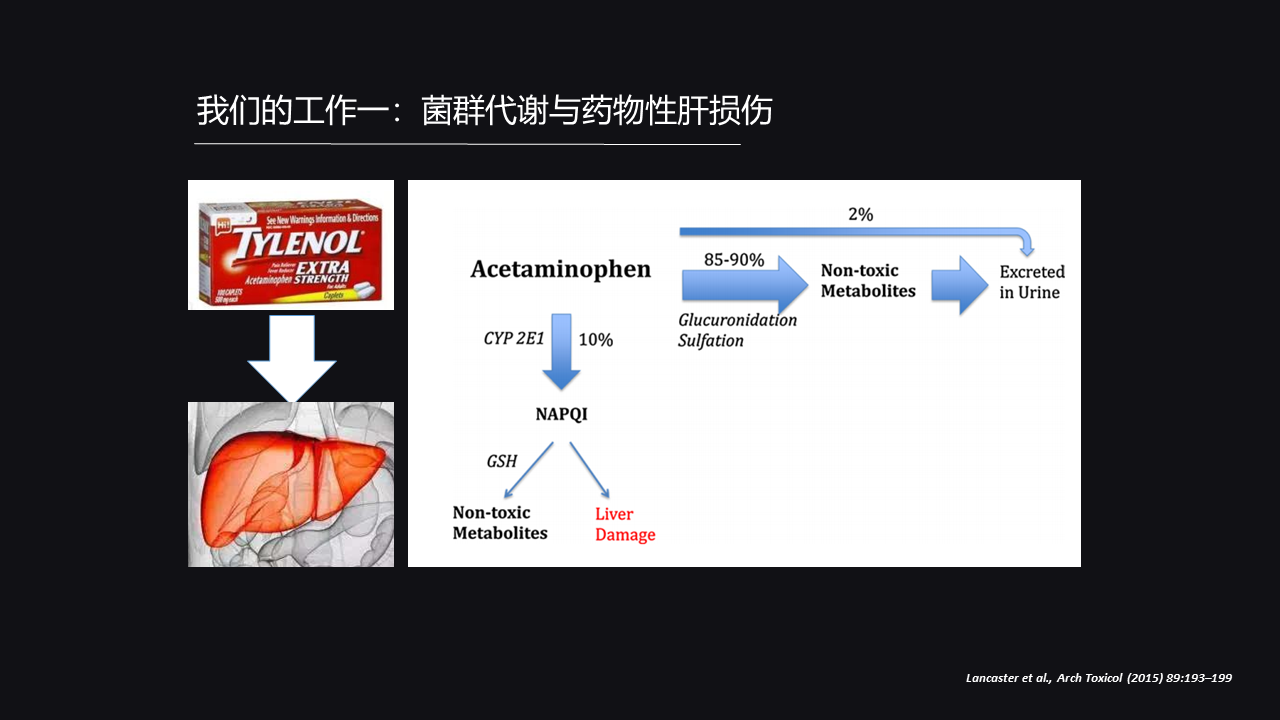
首先,我们的第一个工作是肠道菌群的产物和我们药物性肝损伤的关系,这里我们运用的模型是对乙酰氨基酚导致的肝脏损伤。
各位肯定都吃过对乙酰氨基酚,因为对乙酰氨基酚是目前全世界用的最多的解热镇痛药,感冒药里面退烧药里面一般都会含有。
它有个特点就是如果你正常服用其实不会产生很多的负面效应,因为机体有足够的抗氧化能力、防御能力抵消它的毒性。但是如果你服用过量将会导致严重的肝脏损伤甚至衰竭和死亡。
那么它的毒理其实到目前来说还是比较清楚的。
我们可以看到,当你服用对乙酰氨基酚之后,80%-95%的对乙酰氨基酚将会在肝脏硫酸化或葡萄糖酸化之后以无毒的形式排出。
还有大概10%的对乙酰氨基酚将会被肝脏里面的细胞色素P450酶系(主要是CYP 2E1)转化成NAPQI,就是氮乙酰对苯醌亚胺,这是一个活性中间体,它是有毒性的,它可以攻击大分子DNA等等,体现毒性。
但是,即使它生成了之后也没有太大关系,因为我们机体有谷胱甘肽这个抗氧化的分子存在,它可以还原NAPQI,让它形成无毒的形式,然后随我们的尿液排出。
但是,我们可以试想一下,你如果服用过多的对乙酰氨基酚,当还原性谷胱甘肽被消耗完了之后,就没有这样的防御分子来保护我们,就会导致它大量的损伤我们肝脏细胞,所以这就是对乙酰氨基酚导致我们肝脏损伤的一个毒理。
长期以来,在临床上我们发现一个现象:那就是对乙酰氨基酚导致的肝脏损伤,它存在一个昼夜节律的特征,总结起来就四个字“晨轻暮重”。
同样一个人,服用等量的对乙酰氨基酚,可能早晨相对来说肝损伤不是很严重,但是晚上,肝损伤可能会非常严重。那么这样的一个昼夜节律的肝毒性的差异一直以来都没有很好的被解释。
我们就想通过肠道菌群的角度去试着解释一下是不是肠道菌群参与了这么一个过程,那么我们在动物水平上做了一系列的实验。
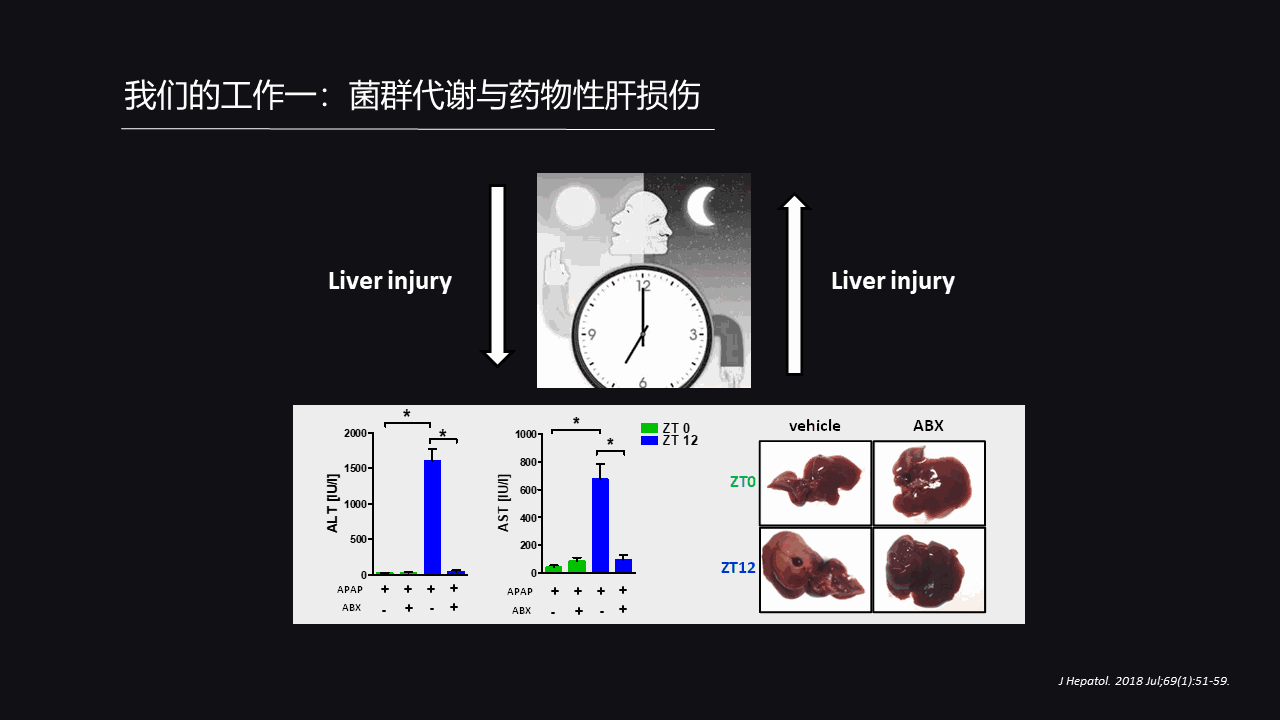
首先,我们把动物分为四组,每组老鼠都处理等量的对乙酰氨基酚,两组在早晨处理,两组在晚上处理,ZT0代表的就是早晨八点,而ZT12代表就是晚上八点。
我们可以看到,在早上处理对乙酰氨基酚它的损伤是比较低的,那么它转氨酶就很低,所以肝损伤就比较低;而在晚上处理对乙酰氨基酚之后,它的转氨酶迅速升高、非常高,这就证实了“晨轻暮重”的这样的一个现象。
有意思的是当我们处理抗生素把肠道菌群去除之后,它晚上的损伤也不高了,这就意味着“晨轻暮重”的肝毒性依赖于肠道菌群存在的。
那下面我们进一步的看一看它到底为什么会出现这样的一个差异。
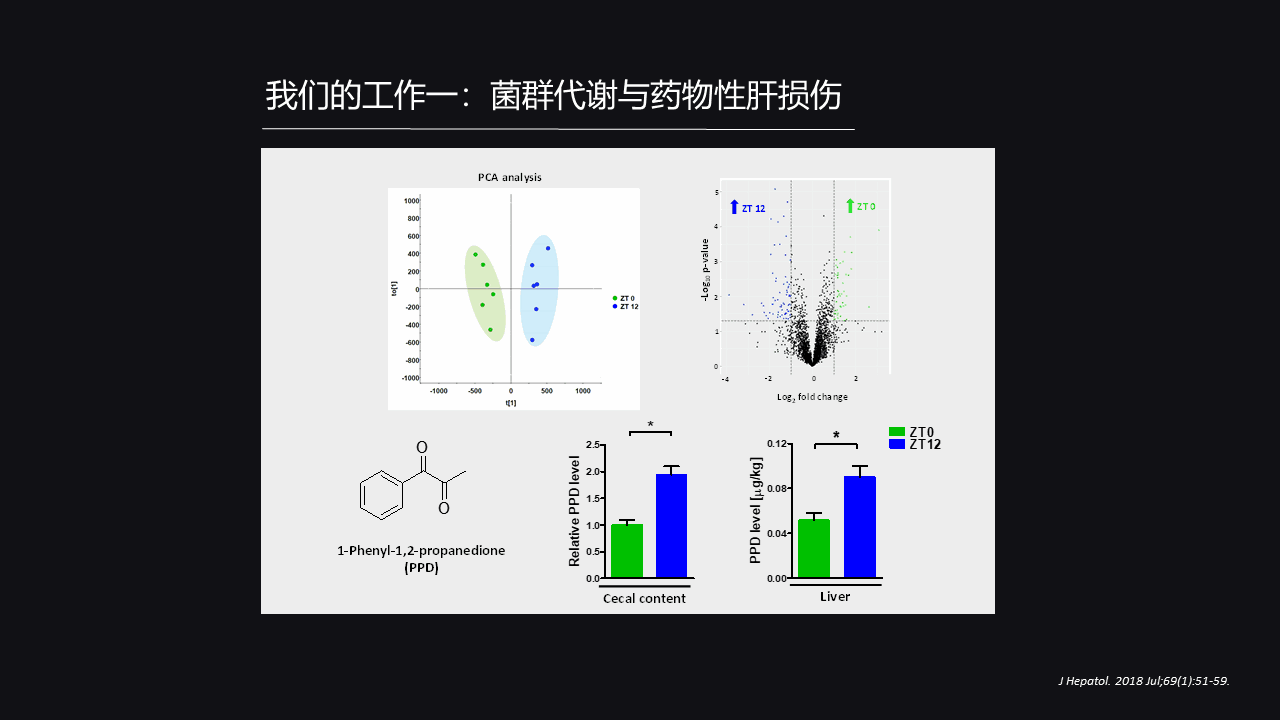
我们比较了早晚肠道菌群的代谢组,发现它们的代谢产物的谱是不一样的,有些在早上很高,有些在晚上很高。
我们就在众多的差异化合物中,选择了一个分子,这个分子我们在(上图中)左下角可以看到它的名字叫1-苯基-1,2-丙二酮,简称PPD。
这个分子它有几个特点,第一个特点就是它的含量也存在着“晨轻暮重”的情况,它早晨比较低而晚上比较高,无论是在肠道中还是肝脏中。
第二个特点就是它是一个邻二羰的化合物,我们可以看到它两个羰基是邻在一起的,那这类化合物一般来说是不友好的,而且这类化合物需要被我们肝脏转化,而转化的过程正是加氢还原,而这个过程和对乙酰氨基酚的那个毒物被解毒的过程很像。
我们就猜想PPD这个分子是不是就有可能参与了对乙酰氨基酚早晚毒性的差异。
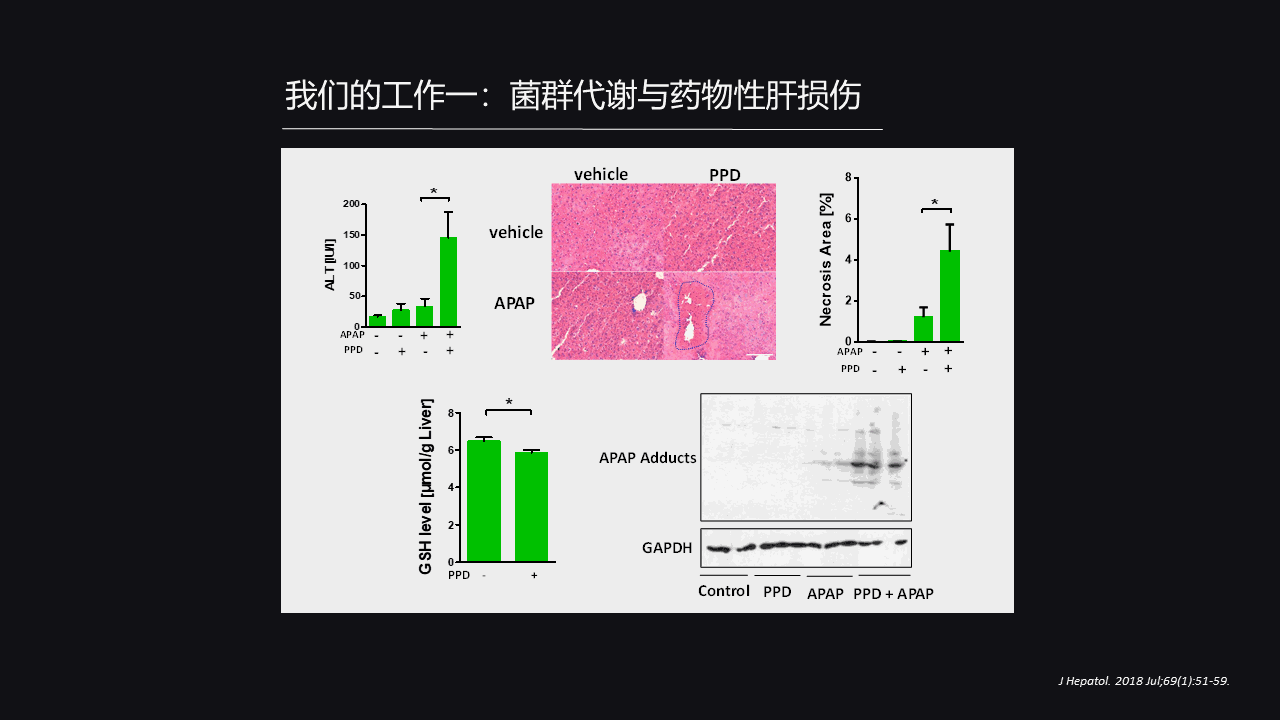
那么带着这个问题,我们又做了进一步的实验。
我们发现单独处理PPD之后,并不会产生很明显的损伤。这个很好理解,因为我们机体有足够的防御能力、防御分子去抵御它的毒性。
但是可以看到当它和APAP(对乙酰氨基酚)共同处理的时候,肝损伤明显加强,那就意味着PPD可以协同性的增强对乙酰氨基酚导致的肝脏损伤。
它的机制其实就是因为PPD可以直接消耗肝内的谷胱甘肽,而这是我们肝脏抗氧化的一个非常关键的分子,所以我们就把PPD认为是我们昼夜节律损伤差异的一个关键分子。
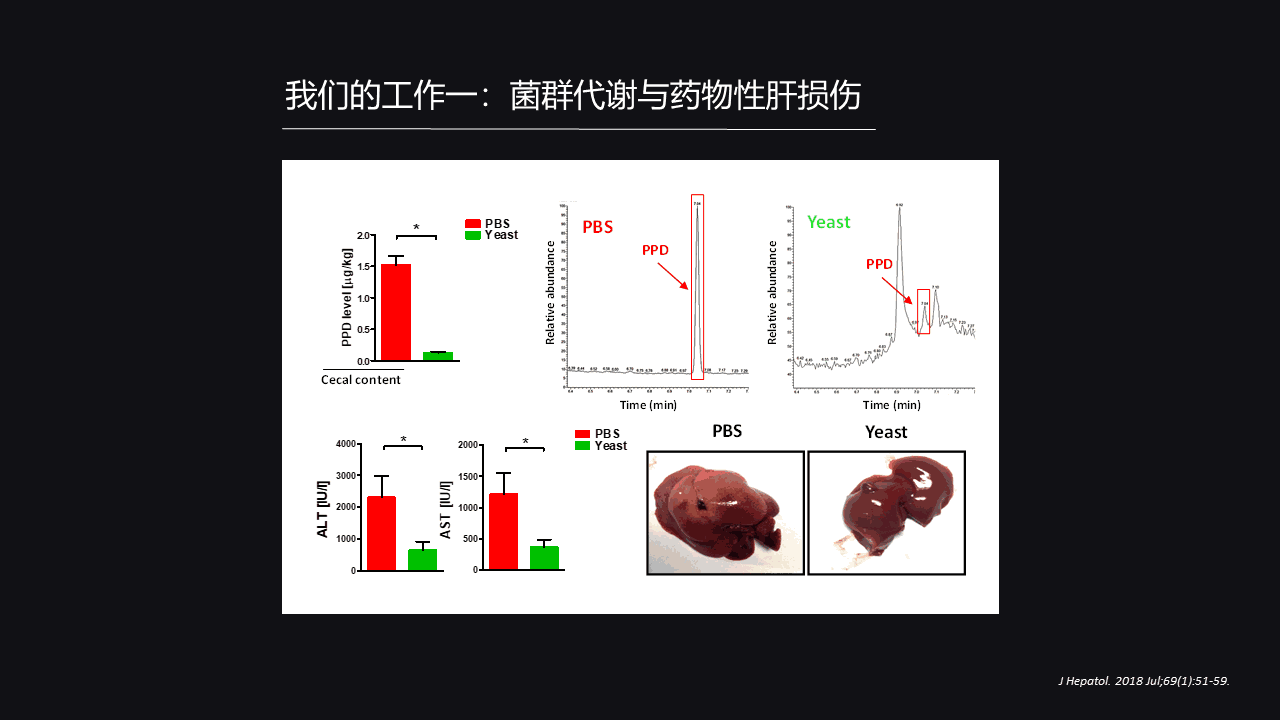
最后,我们又做了一个干预,我们很有幸的查阅到文献,表明PPD这个分子它可以被活性的酵母生物转化,而转化的基础其实也是加氢还原。
那么我们就猜想是不是我们可以给小鼠先预处理活酵母把它的PPD给降下来,然后我们再建立对乙酰氨基酚导致的肝脏损伤模型。
很有意思的发现是,在降低了PPD的同时,对乙酰氨基酚导致的肝脏损伤也得到明显的缓解。
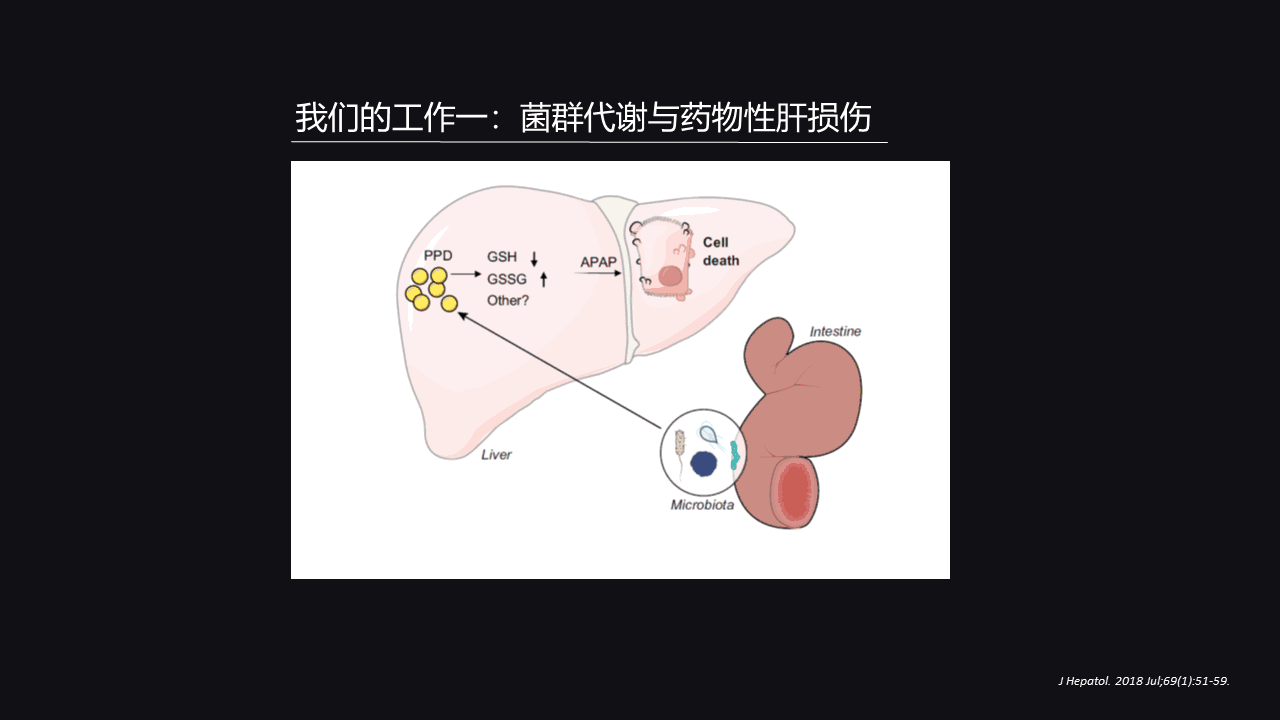
所以我们得出的结论是肠道菌群它会产生PPD这种化合物,而这种化合物它存在着“晨轻暮重”的现象。
当你晚上出现PPD的时候,你单独出现PPD并没有对乙酰氨基酚处理的时候是没有问题,因为我们有足够的GSH(谷胱甘肽)可以把它给还原掉。
但是如果这时候你再来对乙酰氨基酚导致的药物性肝损伤打击,两者齐下的话那么肝脏的负担就会非常严重,导致肝脏损伤更加严重。
第二个例子就是一个保护的例子,这个例子我们的模型是在脓毒症,也可以叫败血病,它导致的多器官损伤。
我们大家都知道,脓毒症是重症医学中最主要的疾病,它的死亡率大概在30%左右,死亡率非常的高,花费也特别高,愈后也比较差。
它是由细菌或者其它微生物所引起的多器官功能衰竭甚至死亡的疾病,它可以损伤肺脏、肝脏、肾、脑循环系统等等,因此它是一个非常严重的多器官损伤的典型代表。
那么长期以来我们在临床也好,基础试验也好,都发现了一个现象,那就是不同个体对于脓毒症造成的器官损伤差异和死亡率差异都是有明显不同的。
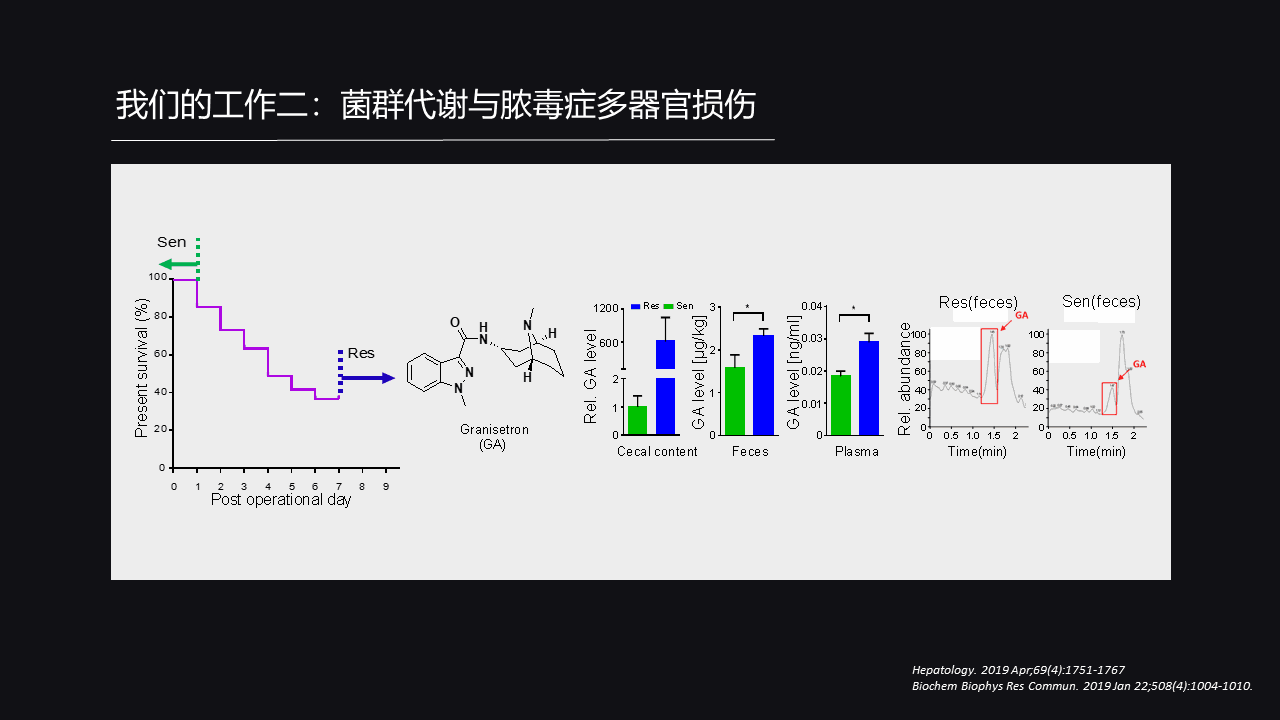
那么我们就在这个基础上,进行进一步探索。我们在一批老鼠上同时建立CRP,就是所谓的盲肠结扎穿孔模型,实际上就是实验室里面诱导脓毒症的经典模型。
建立这个模型之后,我们可以看到,小鼠的死亡率它不是统一的,它是一个阶梯性的变化,有的小鼠死的早,有的小鼠死的晚,甚至可以彻底活过来。
所以这样的敏感性是有差异的,那我们就自己定义在CRP手术24小时之内死亡的老鼠,我们称为脓毒症敏感型老鼠。
与此相对照的是,在脓毒症手术之后能存活一周以上的老鼠,我们称为脓毒症抵抗型老鼠。那这部分老鼠它是可以对脓毒症导致的死亡,还有多器官损伤有明显的抵抗作用。
这两部分老鼠是两个极端,下面我们就想去猜测这样的差异是由什么因素所导致的。
那么我们就往肠道菌群上面去解释,我们比较了脓毒症敏感型老鼠和脓毒症抵抗型老鼠肠道菌群代谢组,发现了一个分子名叫Granisetron(格拉司琼),这个分子在脓毒症抵抗型老鼠的肠道粪便里面以及血浆里面都明显的高于脓毒症敏感型小鼠。
这就意味着这个分子是不是有可能有保护作用呢?
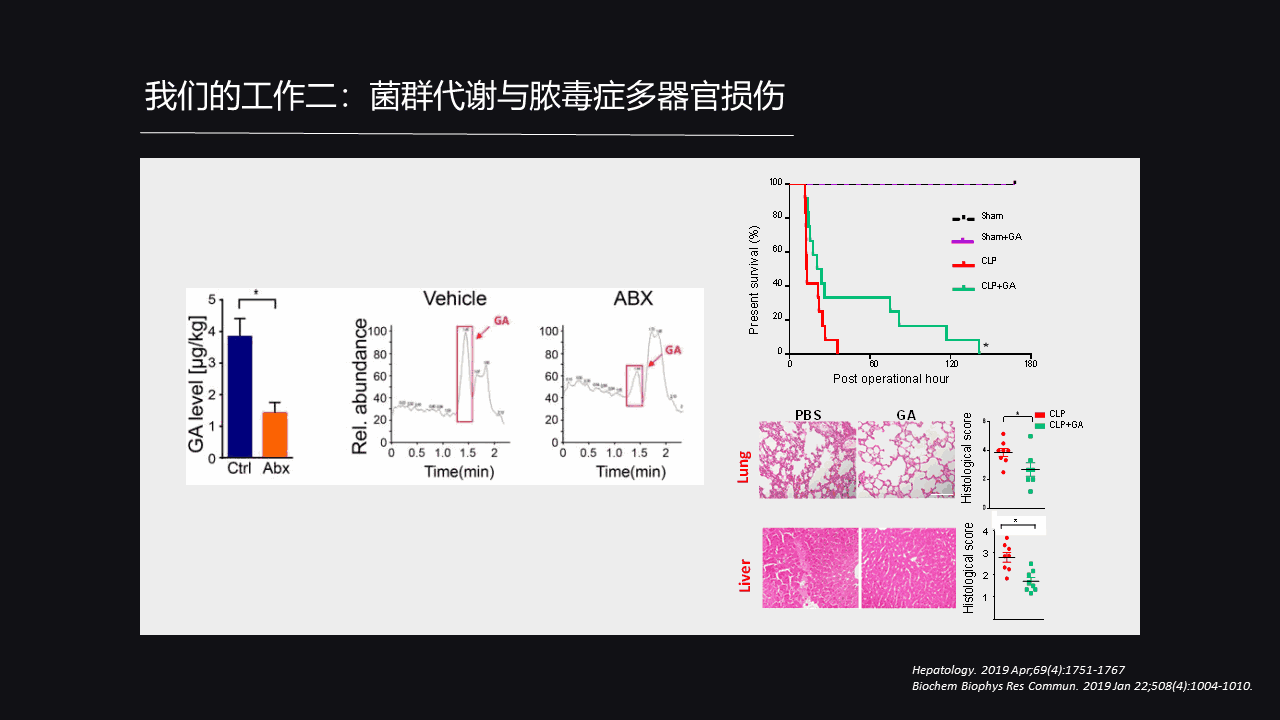
带着这个问题,我们进一步做了功能性试验。我们发现,处理Granisetron之后小鼠的生存时间就是绿色这条线,相比于红色没有处理Granisetron这条线有明显的缓解。
也就是说Granisetron可以很好地延长脓毒症导致的生存时间,同时脓毒症导致一些多脏器损伤,比如说肺脏、肝脏的损伤也因Granisetron的处理而得到很好的缓解。
这是个很鼓舞人心的结果,这证明了Granisetron的确是可以保护我们脓毒症导致的多脏器损伤延长脓毒症导致的死亡时间。
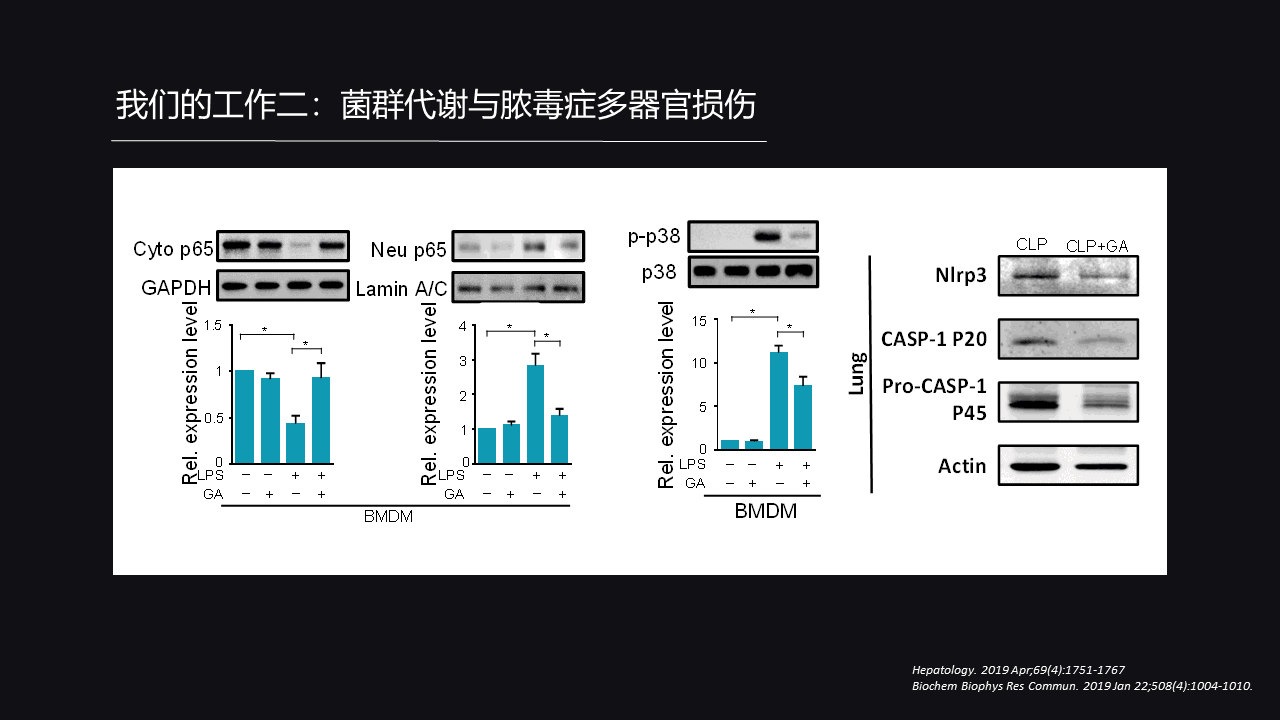
那它的机制是什么?
脓毒症导致的多脏器损伤严重依赖于宿主机体的免疫活力的异常,具体表现在一些炎症因子风暴的形成过度免疫炎症反应的激活。那下面我们就看一看Granisetron是不是有保护我们炎症反应免于过度激活的作用。
然后我们就做了一系列实验,我们发现Granisetron可以抑制由LPS导致的NF-κB的激活入核,还可以抑制P38的磷酸化,同时在肺脏中我们还证明它还可以削弱Nlrp3炎症小体的激活,所以Granisetron的抗炎作用是一个全面的作用。
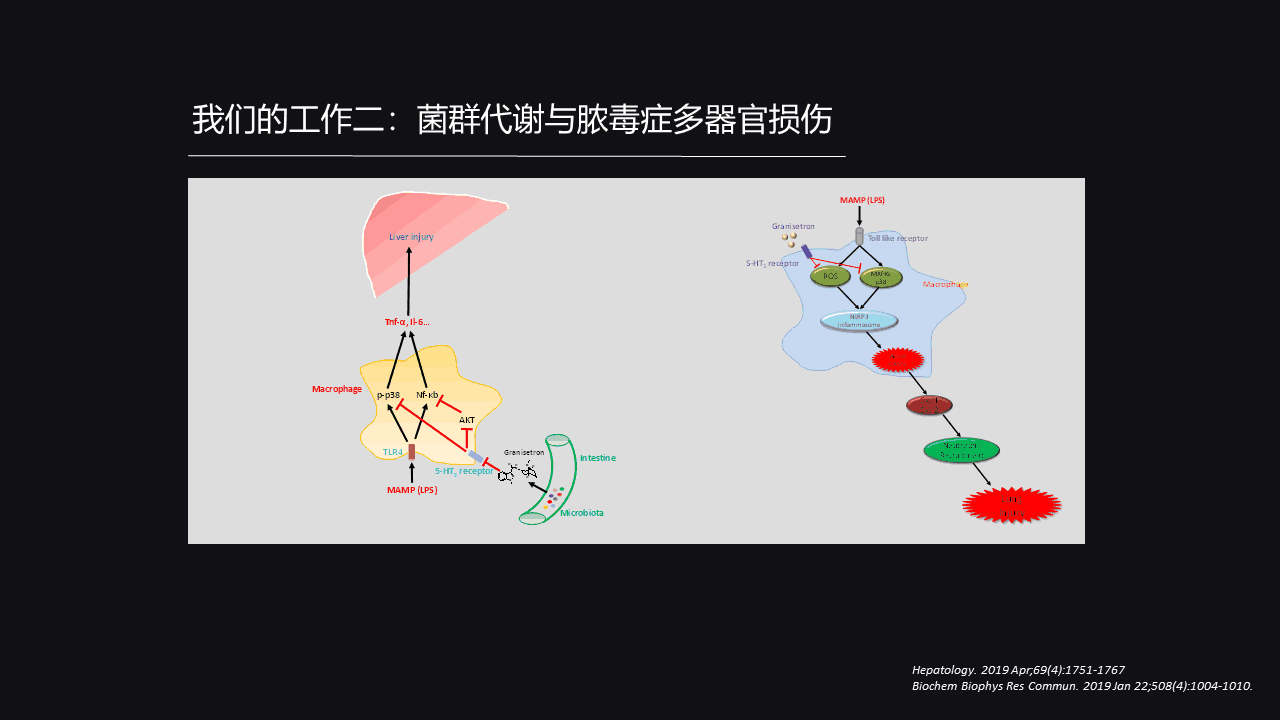
因此,我们得出一个初步的结论,那就是Granisetron这个分子它从肠道中来,可以很好的削弱巨噬细胞里面NF-κB的激活,P38的磷酸化,还有Nlrp3炎症小体的激活,从而缓解脓毒症过程中免疫细胞对于炎症因子的过度释放,最终保护我们的器官,包括肝脏、肾脏等等。
我们现在正在临床上开展针对Granisetron治疗脓毒症多器官损伤的一个临床试验,希望我们能在临床上能够得到验证。那这样也是从微生物研究翻译到临床的一个直接的转化例证。

最后,我想和大家交流一下肠道菌群代谢产物对于我们基础和临床研究的一些展望。
我想先谈一谈好的一面,就是积极的机遇一面。
首先代谢组学的研究,目前是比较成熟的,LC-MS(液相色谱-质谱联用)、GC-MS(气相色谱-质谱联用)的技术越来越成熟,分辨率越来越高,我们可以检测到非常微量、痕量的物质,而且我们的库也越来越大,我们可以检测到很多物质,这是我们一个极大的进步。
同时,很多化合物相对来说获取难度比较低,它相对于其它的组学,比如说针对微生物,还有基因组学研究、转录组学研究、蛋白质组学研究,这些组学的研究它翻译的物质相对来说不是那么容易获取。
比如说我得到了一个细菌来的蛋白,那这个蛋白我想得到它一个原体我很难得到,但是如果化合物我可以通过合成的形式得到,所以这些是我们肠道微生物代谢组学研究的一个很便利的条件。
第二,菌群代谢产物它非常的丰富、多样,研究潜力非常巨大。正如我一开始说的,我们有上千种的菌株,而且每一种细菌都可以产生各种不同的化合物,这样的排列组合给我们带来了无限种可能,这样的一个宝库是我们基础研究里面的一个金矿。
第三,代谢产物翻译到临床的门槛相对较低,如果说我们能够获得一个有益的化合物,如果在动物水平上、毒理上没有明显的毒副作用,那我们就有可能把它作为临床上治疗疾病的一个方式。那这样的话代谢产物是我们肠道微生物转化研究的一个宝库。

虽然说我们肠道微生物的代谢组学研究有这么多好处,但是我们也必须要冷静、理性的考虑它的一些挑战,这里我也列举了三个可能的挑战。
第一点,微生物代谢网络的研究还没有很好的跟进,上游的基础研究还有瓶颈。例如,我们得到了某一个分子是由微生物产生的,但是我们很难知道微生物的哪些通路、哪些酶、哪些基因参与了这个代谢物的合成,所以这个基础研究还有待我们进一步的去研究和挖掘。
我们现在的工作更多的是得到了这个化合物,然后把这个化合物进行下游的验证,而再往上走这个化合物怎么干预它,可能还存在一些问题。
第二点,如果遇到了有害化合物,干预手段相对来说比较困难,如果是有益的,很简单,我们就把它拿过来,直接给动物上去做,但如果是有害的,直接把它去除的方式,目前来说还比较困难。
第三点,我觉得很重要,也是我们不得不重视的问题,那就是代谢产物在体内的含量相对较低,因此它的生理作用,是不是真的那么重要,还受到质疑。
那这样的一个情况其实很好理解,因为微生物代谢产物本身含量就非常的低,那么我们宿主这么多细胞,这么多功能细胞还有组织器官,你如何四两拨千斤,目前来说,还会有人质疑这方面作用。
所以我觉得我们肠道微生物代谢组学研究前景非常广阔,虽然说路上还有一些挑战,但是总之我觉得这个方向是一个非常光明的方向。我觉得从这个方向上,我们终将能够为我们基础医学、包括临床医学,最后为疾病的治愈、包括诊断提供不可估量的潜在的候选分子。
我的讲座就到这里,谢谢大家。


