
大家好,我是来自军事医学研究院的毕玉晶。
首先感谢热心肠先生的邀请,特别荣幸和大家分享活体生物药的一些研究进展。也特别高兴能把我们在前期的一些研究成果和研究经验与大家一起分享。

如果关注活菌药物及相关产业的朋友,前一段时间一定会被一条消息刷屏,那就是知易公司的SK08项目获得临床试验通知书。但是对这一领域不太熟悉的人士可能就有些困惑:为什么一株药物获批临床实验会引起如此大的关注呢?

如果想解决这个问题,我们就需要从一个关键词说起,那就是活体生物药。

什么是活体生物药呢?活体生物药的英文名称是Live Biotherapeutic,美国FDA药品评估研究中心对活体生物药已经有一个比较明确的定义,并且对于活体生物药早期临床研究也给出了指南。
在指南中FDA明确指出,活体生物药是指含有活的微生物(如细菌)的药物,可以用于预防、处理、治疗人类疾病和适应症。但是它不是疫苗,也不是可过滤的病毒,一般来说是不会通过注射方式给药的。
FDA举了两个例子,一个例子是用一株或多株乳杆菌治疗消化性疾病;另一个例子是通过阴道给药来治疗细菌性阴道炎。
此外重组活体生物药也是被FDA接受的。重组活体生物药主要是指通过有目的的增加、删减或改变遗传物质方式获得的微生物来构成的一个药物剂型。
但是考虑到重组活体生物药的特殊性,FDA也特别强调,如果研究机构或者药企想提交重组活体生物药,特别建议这些公司要与FDA进行额外的交流。

有研究者将活体生物药也看作是二代益生菌。那么想了解活体生物药,就让我们先从益生菌说起。
早在19世纪50年代,就有法国著名的微生物学家——巴斯德发现了乳酸菌,随后有研究者从牛奶中分离得到了乳酸菌,继而双歧杆菌和嗜酸乳杆菌也陆续被报道。
在20世纪,人们普遍认识到,实际上这一类细菌对人类健康是有好处的,并且给了它Probiotic也就是益生菌这样一个统称。
直到2001年,FAO和WHO 给了益生菌一个比较明确的定义,那就是——活的微生物,适量服用对人体健康有益。
2003年的时候,第一株益生菌(植物乳杆菌)的全基因组测序完成了,标志着益生菌的基因组时代的到来。
而就像前面我们提到的,2016年FDA给了活体生物药一个明确的临床指南。

一代益生菌有哪些特点呢?首先它来源于有限的种属,最常见的就是双歧菌属和乳酸菌属。
了解肠道微生物的人都知道,我们的肠道中大部分细菌来自于四个菌门,分别是厚壁菌门、拟杆菌门、变形菌门和放线菌门。双歧杆菌属于放线菌门,乳杆菌和乳酸菌属于厚壁菌门。
在肠道微生物中占有非常大比重的是拟杆菌门,然而在一代益生菌漫长的应用过程中,是没有一株细菌来自于拟杆菌门的。
此外,一代益生菌应用历史尽管很长,但目前来看它主要还是作为食品和膳食补充剂。
可能有人会说,我们现在去医院的时候,医生会以药品的形式给我们开出一些益生菌。但实际上,这些早期以药品形式存在的益生菌,在源头并没有严格按照药物进行开发。
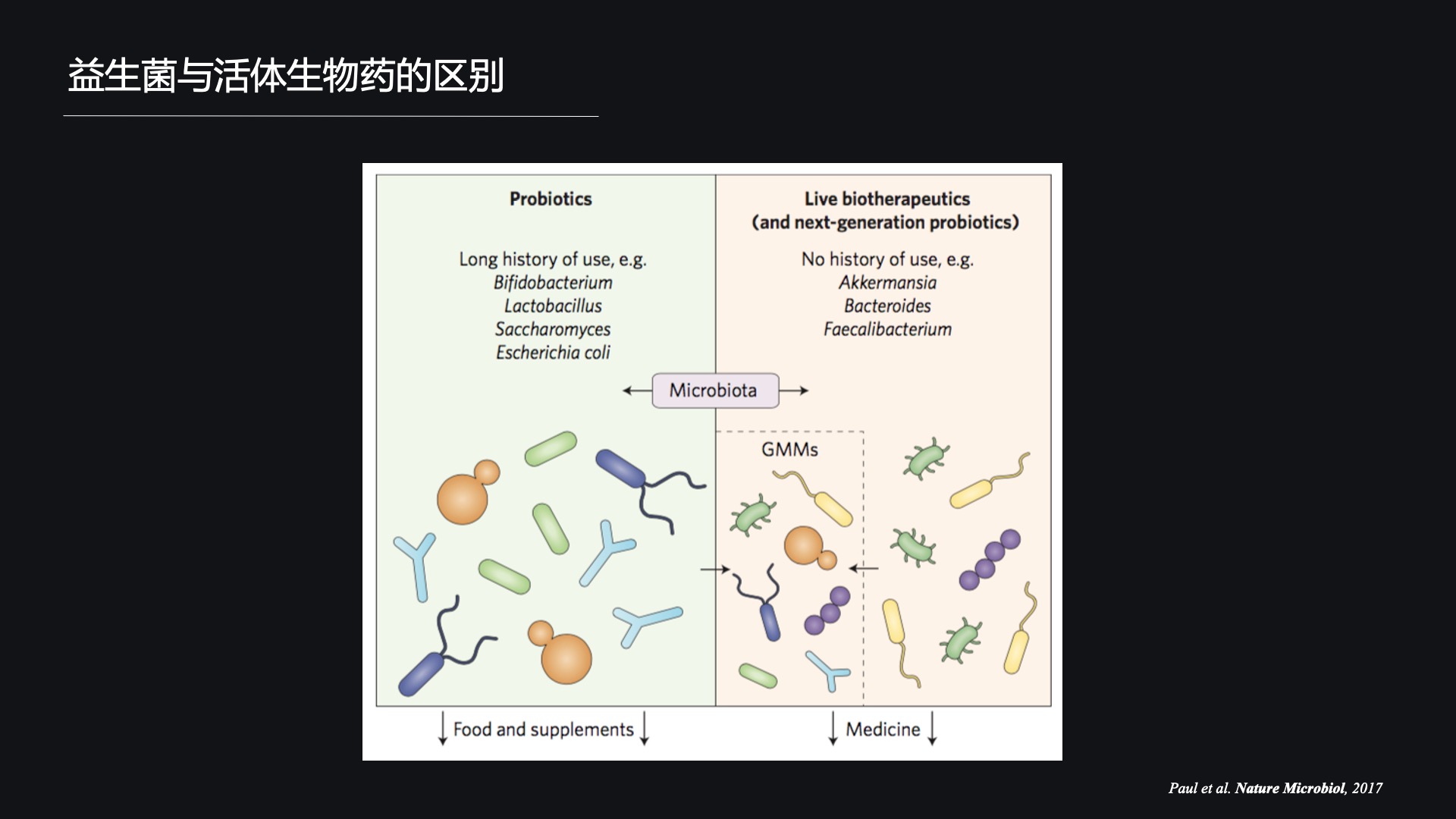
那么一代益生菌和二代益生菌(也就是我们说的活体生物药)之间的区别在哪儿呢?
一个就是它们的应用历史,我们都知道,二代益生菌目前是没有任何应用历史的。
在这里举两个例子,一个细菌就是AKK细菌,也就是噬黏蛋白阿克曼氏细菌。
这个细菌是在2000年之后才被研究者分离、发现、培养出来的。在这个细菌被发现的头几年,它一直是默默无闻的。但是到了2010年之后,研究者陆续发现,实际上这个细菌和人类健康是密切相关的。
另外一个例子就是前面我们提到的SK08活菌。
它是一株脆弱拟杆菌,来自于拟杆菌门,实际上这也就是为什么SK08菌株获批临床之后引起人们广泛关注的主要原因之一,因为它是来自一个从未被作为益生菌使用的这么一株细菌。
除了它们的应用历史以外,实际上一代益生菌和活体生物药的另一个主要区别来自于它们的应用范围。
一代益生菌更多的是应用于我们的食物和食品中的膳食补充剂,那么二代益生菌是要有明确的临床适应症,也就是说在临床上我们作为药品使用,它是要对症的。那么这就决定了活体生物药在其临床前研究和临床研究时,必须要严格按照药品的形式进行。

其实一直以来,研究者对于益生菌的作用原理、作用机制的研究从未减慢过他们的脚步。
最开始,大家对益生菌的认识可能更多的是来源于对消化系统的改善作用。随着研究的不断深入,越来越多的研究证实,益生菌对于人体的益处,可能远远不只是在消化系统。
比方说,在肥胖、糖尿病中,益生菌也被报道可能会发挥很大的作用,在神经系统中,比如自闭症,无论是在动物实验上还是在小部分人群实验上,已经显示了某些益生菌特别好的利处。
不同的益生菌作用的原理不一样,对于宿主的作用机制也不尽相同。
在这里我举了一个例子,2015年的时候就已经有研究者报道,一株双歧杆菌可以协助抗PD-1抗体在抗肿瘤治疗中发挥显著效果。
大家都知道,肿瘤的免疫治疗在2018年获得了诺贝尔生理学医学奖,可见益生菌的联合用药和其辅助用药,对于肿瘤的免疫治疗应用前景十分广阔。
既然益生菌对我们身体可能产生这么多好处,那么目前国际上已经进入临床,或待进入临床活体生物药的研究状况如何呢?
我们可以看一下,目前严格按照活体生物药这个标准,已经被批准和接受的活体生物药是很少的。
举个例子,在德国获批的Mutaflor 主要是适用于溃结(溃疡性结肠炎)缓解期的维持治疗,它的主要支持证据来自于三项临床的随机双盲对照实验。而且所有的实验所采用的阳性对照药物,都是溃结缓解期的一线药物——美沙拉嗪。
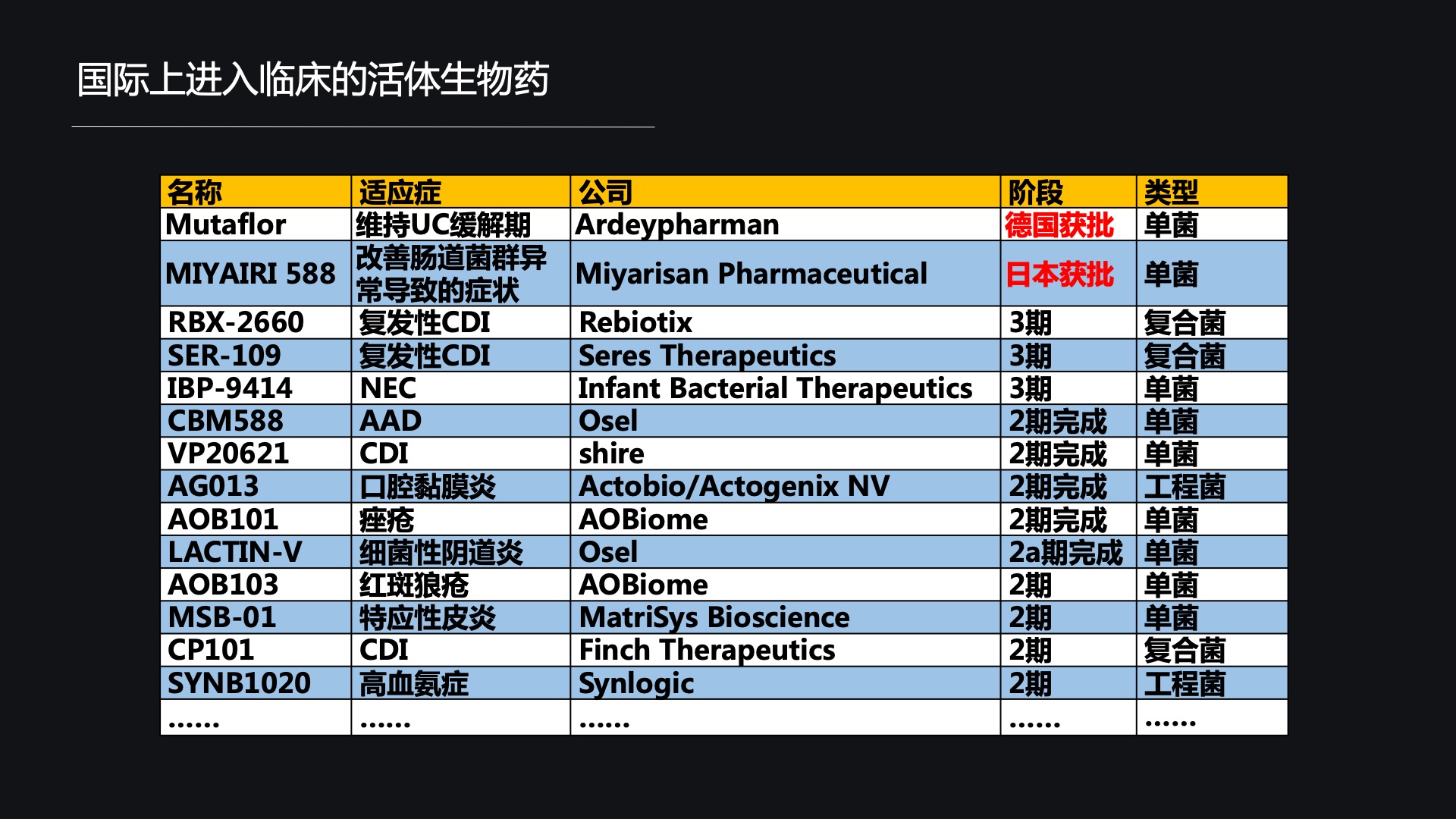
这是已经获批的活体生物药,实际上更多的活体生物药还处于临床前和临床阶段。

上面这张图片显示的,就是部分进入临床的活体生物药名单。大部分显示的是3期和2期的,其实还有一些进入临床的活体生物药是处于1期地位。
总体的数目大约也就20多种,围绕的领域主要就是三个大的领域——一个是消化道领域的疾病,一个就是泌尿感染,还有一个是皮肤系统的相关疾病。菌株的构成包括粪菌、复合菌、单菌以及一些工程菌。
这是已经进入到临床阶段的活体生物药的情况。实际上,在临床前阶段关于活体生物药的相关研究的范围更广,它可能更多地涉及到了自身免疫疾病、肿瘤和感染类疾病。
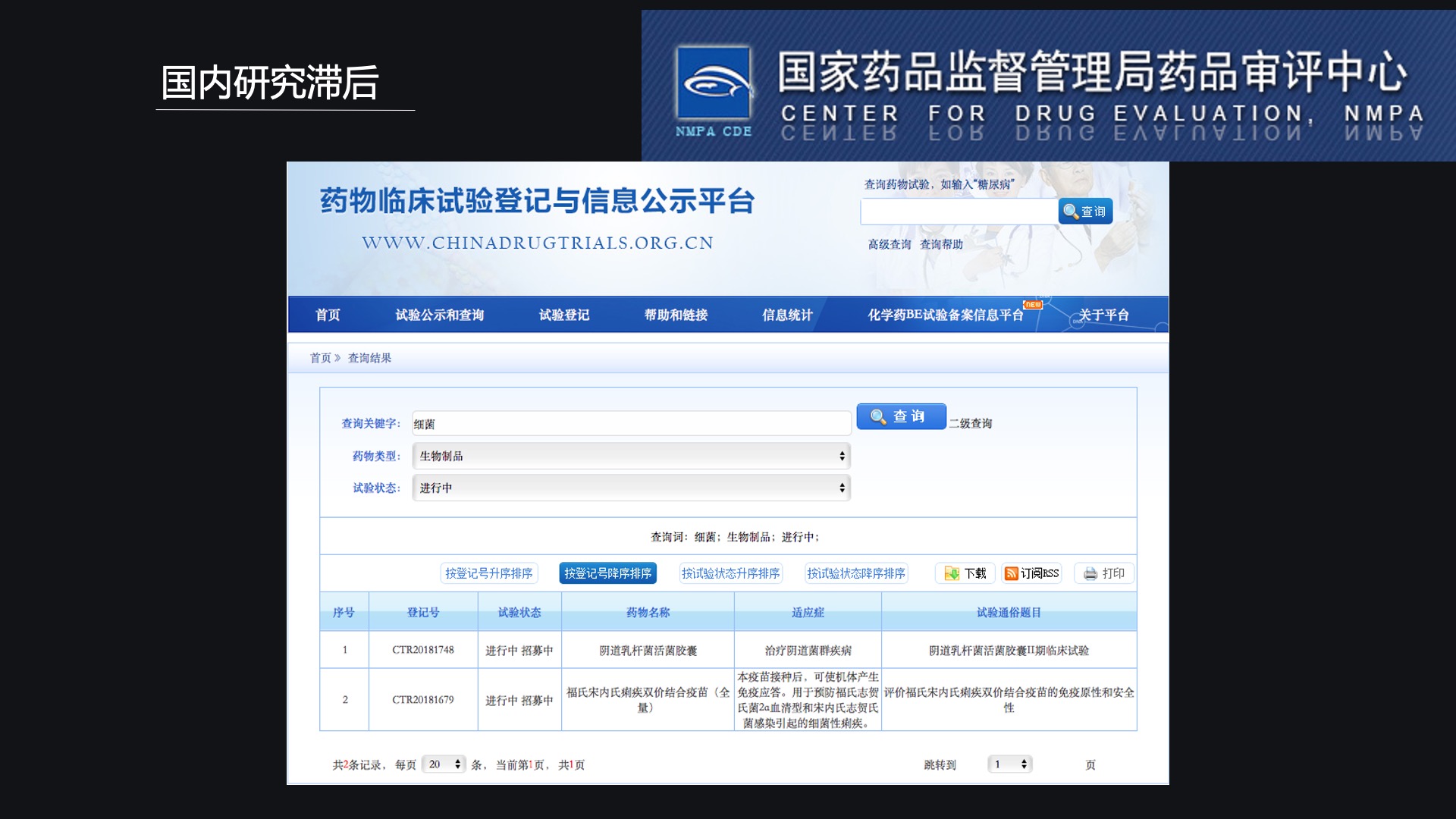
那么回过头来,我们来看一看国内研究到底到了什么阶段?
我们通过国家药品监督管理局药品评审中心的网站,以“细菌”和“生物制药”进行搜索。我们只找到了两项,而其中的第二项还是一个疫苗,疫苗是不属于活体生物药。
所以说从目前情况来看,只有一项——是利用阴道乳杆菌治疗细菌性阴道炎的。加上我们刚刚提到的获批的SK08项目,实际上加到一起也只有两项。这也就是为什么SK08项目获批引起广泛关注的另一个主要原因。
可见,与国际上的研究相比,我们国内的研究还是有些滞后的。

那么如何突破活体生物药的研究瓶颈?
我很荣幸参与到SK08项目的一些临床前研究,在这里我将我们的研究结果和一些研究经验与大家一起来分享,希望能助力我们国家活体生物药的研究。

像任何一项科研工作一样,在开始SK08项目临床前研究的时候,文献阅读是我们认为最重要的工作之一。
早在2005年的时候就已经有报道显示,脆弱拟杆菌及其荚膜多糖PSA对T细胞是有免疫调控效果的。继而的研究显示,脆弱拟杆菌可能对肠炎和自闭症是有显著改善疗效的。陆续的,一些关于脆弱拟杆菌作用机理的文章也被报道出来。
与此同时,南方医科大学智发朝教授团队成功地从一个健康的婴儿粪便中分离到了一株脆弱拟杆菌。

在我们进行这项工作的时候,FDA还没有颁布活体生物药临床研究指南,我们更多的是参考美国、欧盟等各个组织关于益生菌的指南和一些指导原则。
同时呢,结合我国药典关于微生态制剂的要求,列了以下四个大的研究方面。
第一部分就是菌株的分离培养与鉴定,实际上菌株分离培养这个工作已经完成了,所以说在临床前研究阶段的重点是菌株的鉴定;第二部分就是菌株的安全性评价,在活体生物药临床前研究菌株安全性评价是非常重要的;第三部分和第四部分分别围绕着药效和机制研究展开。
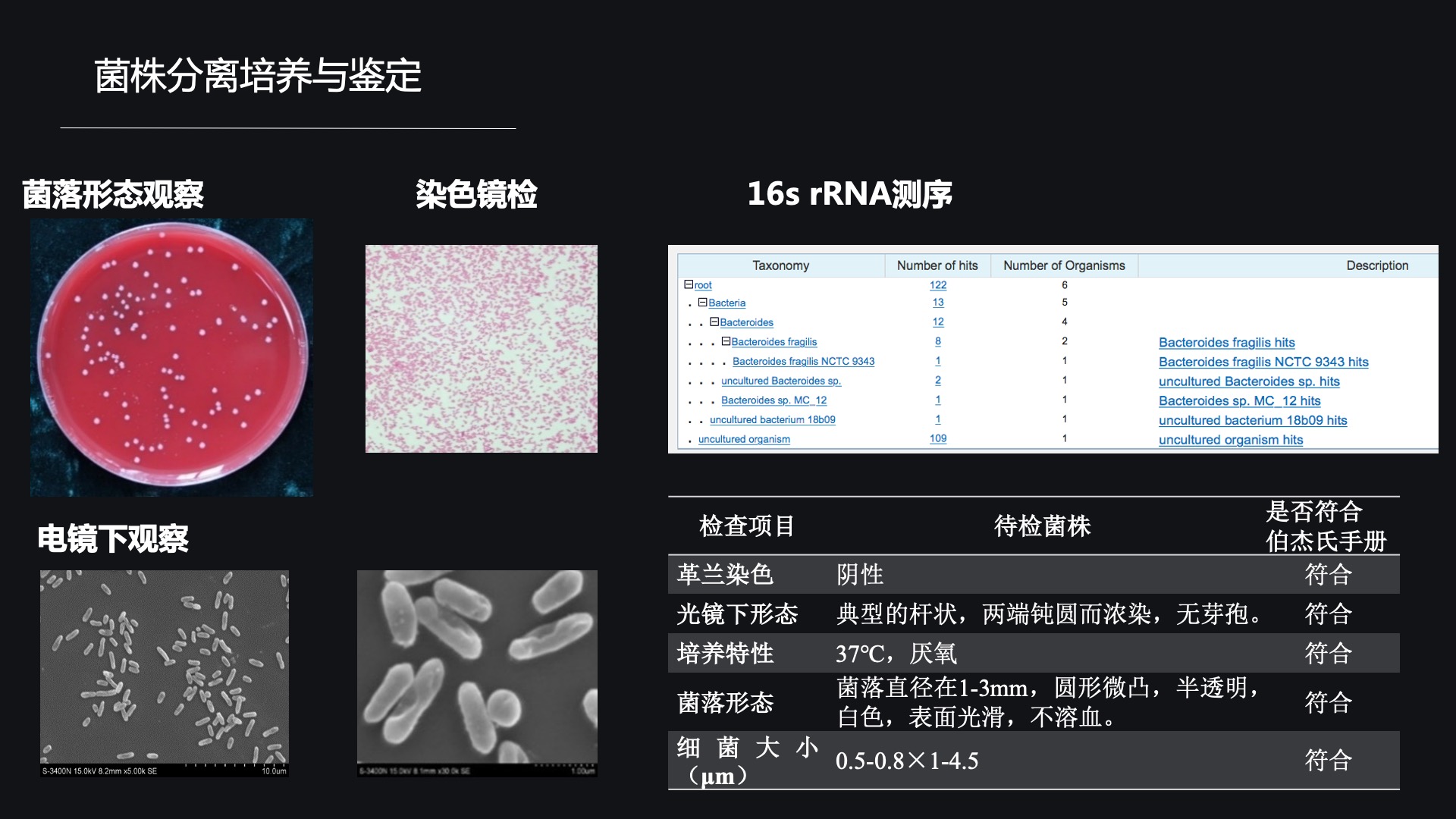
在菌株分离培养与鉴定的时候,我们首先对我们获得到的菌株进行了形态学的观察,观察了它是不是有溶血性,它是不是可以移动。
我们使用革兰染色法鉴定了它是一株革兰阴性细菌,也通过了光镜下的观察、电镜下的观察得到这个细菌的大小以及一些超微结构。
在利用16S rRNA基因测序之后,我们通过pubmed上的基因库比对,进一步明确了这株细菌的分类地位。

就像刚刚我说到的一样,菌株安全性评价非常重要,它也决定了这株菌株是否能满足后续产业化的需要。我们就结合各个国家关于益生菌安全评价的准则、指南和要求制定了以下三大方面的研究方向。
第一个研究方向叫做微生态活菌制剂常规研究。常规的一些研究项目更多包含的就是形态学检查、生理生化鉴定、药敏实验、耐酸耐胆盐评价和小鼠毒性评价。
21世纪作为基因组的时代,关于任何一个可能的活体生物药,在菌株的研究上一定不能忽略全基因组的研究。
第二部分研究是基于全基因组测序的研究,包含了基因型鉴定、产肠毒素基因的分析、毒力因子分析、耐药基因分析和传代稳定性分析。
在这里,产肠毒性分析是脆弱拟杆菌特异的菌种水平分析,如果大家做其他的细菌,可以根据细菌的特性来设计特异的基因分析。
对于毒力因子和耐药基因,我们更多的就是通过数据库的比对。如果通过数据库比对上了某些毒力因子的可能存在,那么我们就会对这些毒力因子进行逐一的分析,看看它到底是不是有潜在的致病性。
耐药基因也是同样的道理,对于比对上的耐药基因,我们会利用体外的药敏试验来完成这个分析,看一看这株细菌到底有没有耐药基因存在,耐药基因是否真的发挥作用。
另外一点就是传代稳定性。实际上传代稳定性是衡量一株细菌是否容易发生变异的一个特别重要的手段,它也是来衡量这株细菌是否满足后续产业化所需的一个重要指标。
在这个研究中,我们将这个细菌进行了连续100代的传代,传代之后我们分析了它的全基因组,也做了致病性相关的这些检查。
除了这两个部分以外,我们又设计了基于其它安全考虑的研究项目,包括细胞粘附评价和细胞毒性评价。这两部分更多的是来考量细菌的菌体本身、培养上清液(代表的就是它的代谢产物)以及细菌裂解液对于细胞有哪些影响。
考虑到FDA的特别强调,在对益生菌菌株进行安全性评价的时候,一定要采用免疫缺陷的动物来进行评价。在此呢,我们就设计了裸鼠的毒性评价实验。
那么对于GLP安评实验,我们是委托有资质的企业完成了相关的实验。
整体来说,我们对于这株SK08菌株进行了比较全面的安全性评价,几乎将所有可能考虑到的安全性要点都纳入进来了。

在药效学研究方面,我们的前期研究显示,这株脆弱拟杆菌可能会抑制某些致病菌。活体成像就显示出来,这株脆弱拟杆菌在小鼠体内是可以抑制副溶血弧菌的。
板崎杆菌是自噬性小肠结肠炎的一个主要的致病细菌。体内外研究也显示,这株脆弱拟杆菌可以抑制板崎杆菌的侵袭,可以抑制板崎杆菌给一些上皮细胞带来的裂解和凋亡,以及维持上皮细胞的屏障。
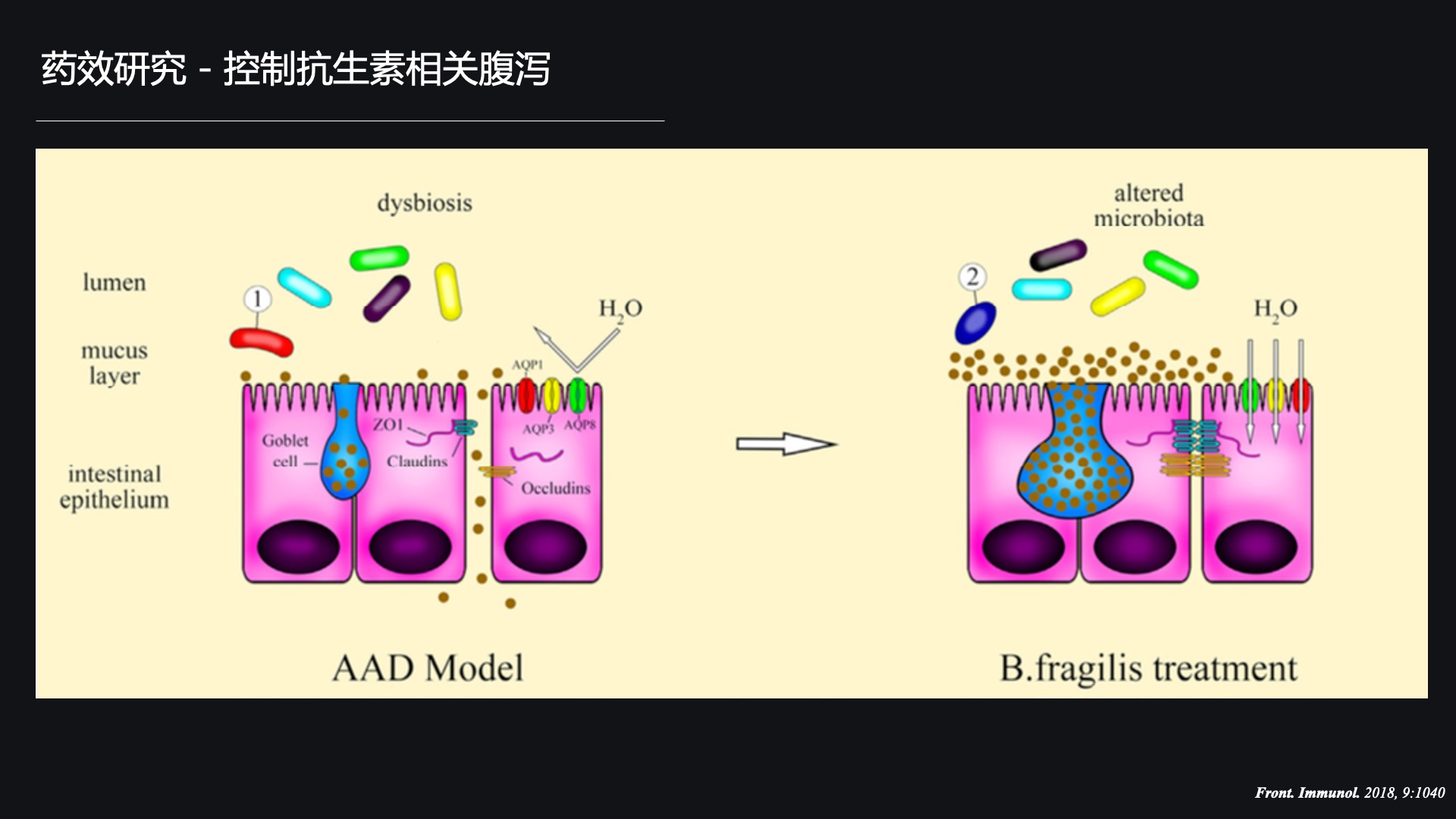
抗生素相关腹泻现在在临床上是比较常见的。我们的研究也显示,这株脆弱拟杆菌在大鼠身上可以调节大鼠的肠道菌群并维持肠道屏障,来保护大鼠免受抗生素相关腹泻的伤害。
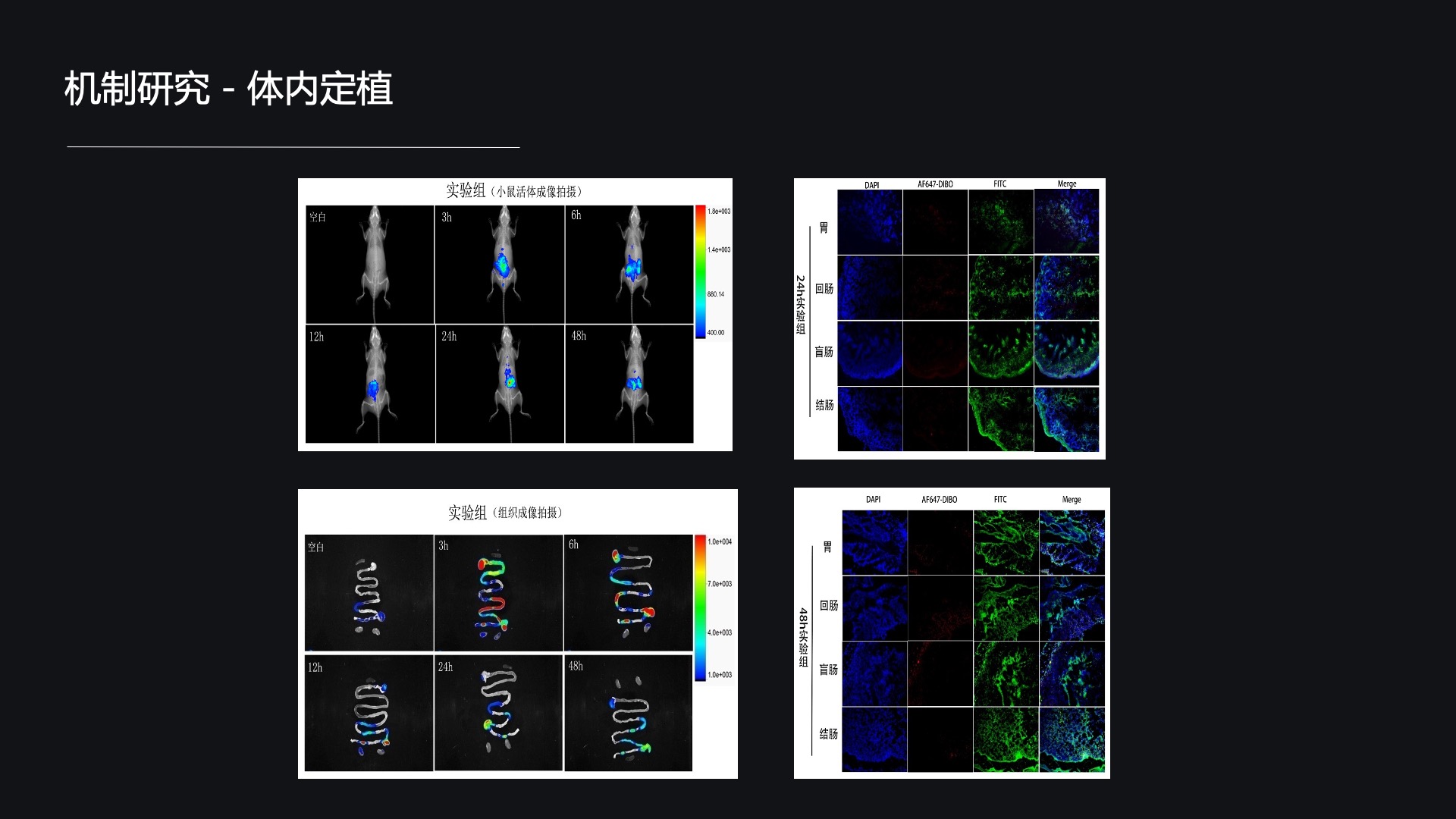
关于机制研究,首先我们想来看一看这株细菌在动物体内定植情况。活体成像显示,这株细菌在动物体内可以定植达到48小时以上,而且其定植部位主要是盲肠和结肠。

此外关于机制研究,我们还想探索一下这株细菌和免疫细胞之间是否能发生相互作用,它是怎么影响免疫细胞的。
我们的研究结果显示,这株细菌的代谢产物能够诱导M1型巨噬细胞,促进巨噬细胞的吞噬能力。
那么综合上面四个大的研究方向,我们对SK08这株菌株进行了比较全面的临床前的相关研究。
结合我们的研究结果以及现有的一些文献报道,对于活体生物药我还有以下几点思考和大家一起来探讨。
首先,活体生物药不同于任何一个化学药品,它有一个特殊性。就像上面这张图片所显示的,它的特殊性来自于细菌本身,也就是说我们的细菌都是活的细胞。
那么就引申出这样一个问题,当这个细菌活体生物药从药厂生产出来的时候,它一定是有一个活体细胞数目的存在,而且是严格要求它的数目要达到什么程度。
但是当这个活体生物药在患者手中真正开始应用的时候,它活菌的数目能达到多少?不同的活菌数目对于药效到底有多大的影响?实际上目前还没有相关的报道。
从这个问题就可以引出另外一个问题,它会让药企思考一下——我们如何通过改变剂型,如何通过添加一些保护剂来更好地维持活菌目前的一种状态,进而来维持它的药效?
从药房和患者的角度,他们应该思考的是,到底给这个活体生物药一个什么样的环境来帮助它维持活菌的数目,以期最终发挥良好的药效?
我认为这些是由活菌生物药的特殊性导致的,也是值得我们思考的一个问题。
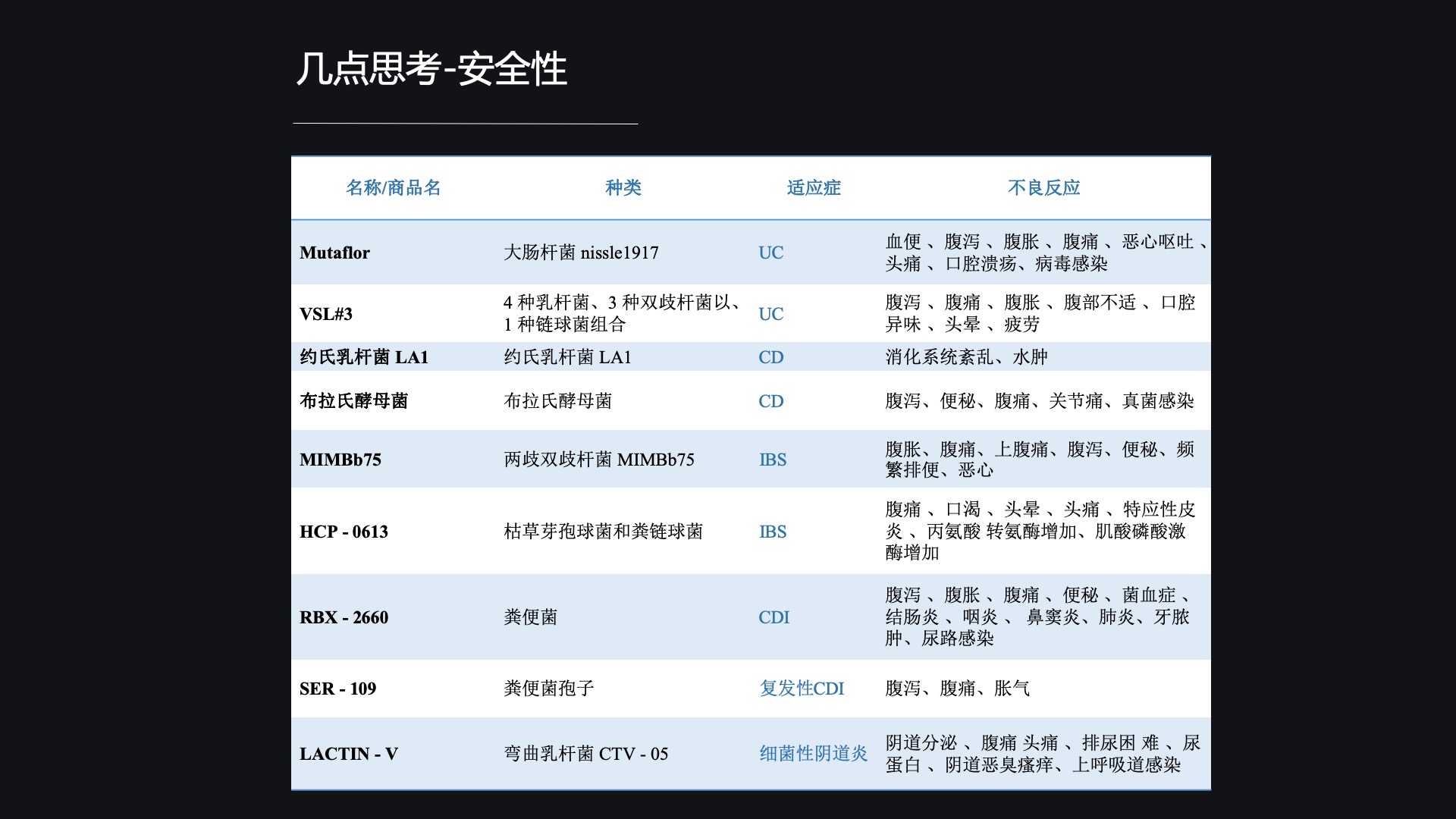
像其他的化学药品和生物药品一样,实际上活体生物药还需要考虑的就是它的安全性,安全性也是所有药品当中最为重要的一点。
与其它的化药和生物制品相比,从临床反应来看,活体生物药的不良反应率还是比较低的,处在了一个比较安全的角度。但是任何一种药品都是存在安全风险的,从目前来看,活体生物药主要的安全风险来自四个方面。
第一个方面就是消化道的反应,比方说可能会出现恶心、呕吐、腹痛、腹泻;第二个方面来自于它可能的一些代谢产物所引起的毒性反应;第三个方面,毕竟它还是一种细菌,所以说它还是有潜在感染的风险;第四个方面比较极端,就是可能会引起个别敏感的个体产生一些过激的免疫反应。
当然了,对于第四点目前也没有相关的临床报道,也没有临床的证据来支持。但是不管怎么说,一个药品的安全性始终是第一位的。当一个活体生物药真正面向临床的时候,我们一定要做好药物的安全预警。

那么目前活体生物药到底该如何定位呢?我们可以考虑它是作为一线用药、二线用药还是辅助用药呢?
从目前的情况来看,大多数活体生物药还是处于辅助用药和联合用药的地位。
但是我个人认为,这个还是要根据不同细菌的特性以及它所针对的临床症状,我们要因菌制宜,还是不要一概而论的。

在演讲的最后,我给大家带来的是2019年美国微生物学会“细菌作画”比赛的一等奖作品——“连年有余”。这是利用了不同形态、颜色的细菌在琼脂上给我们展现出来的画作。
我想就像这幅画作一样,伴随着我们人类一生的微生物一直在给我们带来惊喜。
从致病菌到共生菌,到益生菌,再到活体生物药,人们在不断地发现、认识细菌,人们在不断地利用细菌,使其帮助实现人类健康,实现细菌的“无所不能”。
最后我想说,活体生物药任重道远,我们一起努力!
谢谢大家!


